- 244.50 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
福建师大附中2017-2018学年上学期期末考试
高二化学试卷(实验班)
时间:
90分钟
满分:
100分
(1) 本卷共两大部分,共20题,解答写在答卷的指定位置上,考试结束后,只交答卷。
(2) 考试过程中不得使用计算器或具有计算功能的电子设备
(3) 可能用到的相对原子质量:H-1 Li-7 N-14 O-16 Na-23 Fe-56 Cu-64
第I卷(选择题,共48分)
一、单项选择题(只有一个正确选项,每小题3分,共48分)
1、改变下列条件,可以改变反应活化能的是
A.压强 B.温度 C.反应物浓度 D.催化剂
2、下列说法不正确的是
A. 沈括《梦溪笔谈》记载:“石穴中水,所滴者皆为钟乳。”,此过程涉及沉淀溶解平衡。
B. 古人用明矾水除铜镜上的铜锈是利用了盐类水解的原理。
C. 葛洪所记“青蒿一握,以水二升渍,绞取汁”,所述对青蒿素的提取属于化学变化。
D. 《本草经集注》记载的区分硝石(KNO3)和朴消(Na2SO4)的方法:“以火烧之,紫青烟起,乃真硝石也”,利用了焰色反应。
3、下列关于热化学方程式的说法正确的是
A.H2的燃烧热为-285.8 kJ·mol−1,则表示H2燃烧的热化学方程式可表示为:H2(g)+O2H2O(g) ΔH=−285.8 kJ·mol−1
B.中和热为-57.3 kJ·mol−1,则NaOH与醋酸反应的反应热可以表示如下:NaOH(aq)+CH3COOH(aq)CH3COONa(aq)+H2O(l) ΔH=−57.3 kJ·mol−1
C.已知:C(s,金刚石)+O2(g) CO2(g) ΔH=−395.4 kJ·mol−1,C(s墨)+O2(g)CO2(g) ΔH=−393.5 kJ·mol−1,则C(s,金刚石)C(s,石墨) ΔH=−1.9 kJ·mol−1
D.已知1 mol CH4完全燃烧生成CO2和液态水放出890.4 kJ的热量,则该反应中转移1 mol电子时放出的热量为222.6 kJ
4、下列能用勒夏特列原理解释的是
A.铁在潮湿的空气中易腐蚀
B.棕红色NO2加压后颜色先变深后变浅
C.往往需要在催化剂条件下SO2氧化成SO3
D.H2、I2、HI平衡混和气加压后颜色变深[来源]
5、一定量的锌粉和6 mol/L的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,但不影响产生H2的总量的是
①铜粉 ②铁粉 ③石墨粉 ④CuO ⑤浓盐酸 ⑥碳酸钠 ⑦醋酸钠
A. ①③⑤ B. ②③⑤⑦ C. ①③④⑤ D. ④⑤⑥
6、下列离子方程式书写正确的是
A.碳酸氢钠的水解:HCO3-+ H2OH3O++ CO32-
B.以硫酸铝和小苏打为主要反应物的泡沫灭火器中的反应原理:
Al3+ +3HCO3-===Al(OH)3↓+3CO2↑
C.1 mol/L NH4Al(SO4)2溶液中逐滴加入等体积4 mol/L NaOH溶液:
Al3++4OH— === AlO2-+2H2O
D.用惰性电极电解AlCl3溶液:2Cl- + 2H2O 2OH- + H2↑+ Cl2↑
7、一定条件下,在水溶液中1molCl-,ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示,下列有关说法正确的是
A.ClO2-→ClO3-+ClO4- 可以自发进行
B.A、B、C、D中C最稳定
C.B→A+D反应的活化能为60 kJ•mol-1
D.B→A+C反应的热化学方程式为3ClO-(aq)=ClO3-(aq)+2Cl-(aq) △H= -117 kJ•mol-1
8、将1 mol·L-1的下列物质的水溶液,从常温加热至100 ℃,溶液的pH保持不变的是
A.氯化钠 B.氢氧化钾 C.硫酸铵 D.硫酸
9、实验室用铅蓄电池作电源电解饱和食盐水制取Cl2,已知铅蓄电池放电时发生如下反应:负极:Pb + SO42-−2e−PbSO4;正极:PbO2 + 4H+ + SO42-+2e−PbSO4 +2H2O
今若制得0.050 mol Cl2,电池内消耗的H2SO4的物质的量至少是
A.0.025 mol B.0.050 mol C.0.10 mol D.0.20 mol
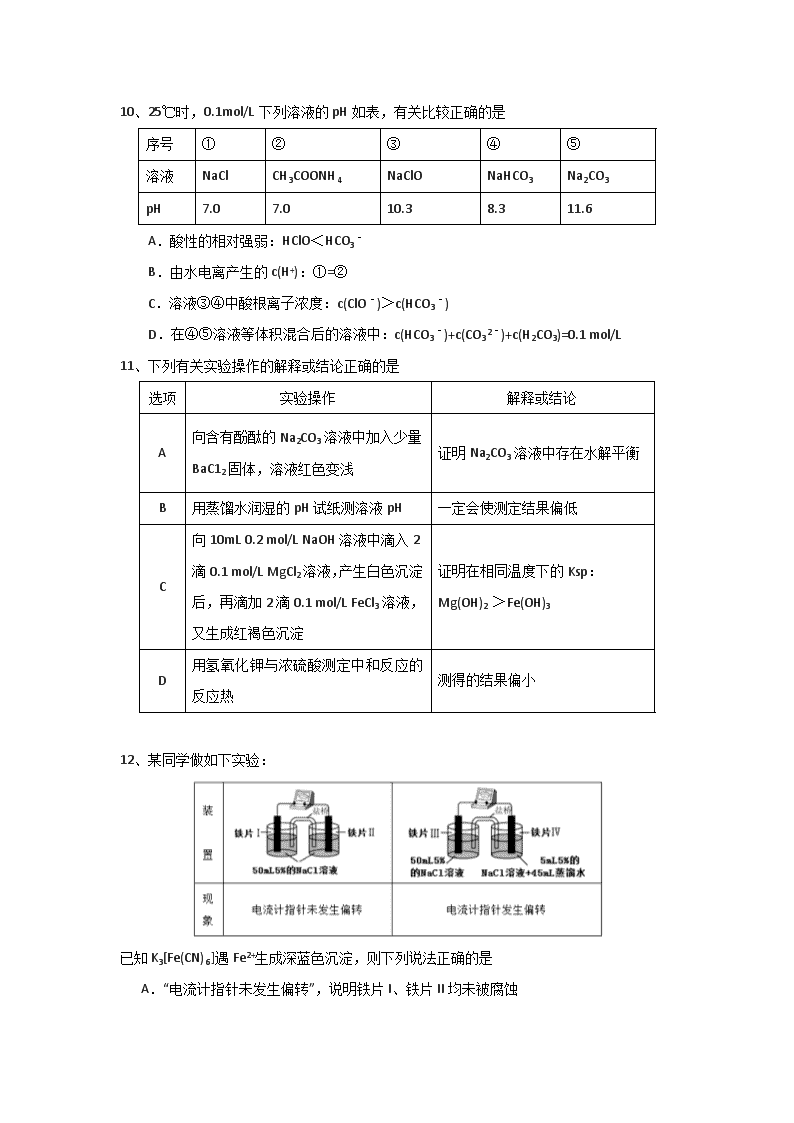
10、25℃时,0.1mol/L下列溶液的pH如表,有关比较正确的是
序号
①
②
③
④
⑤
溶液
NaCl
CH3COONH4
NaClO
NaHCO3
Na2CO3
pH
7.0
7.0
10.3
8.3
11.6
A.酸性的相对强弱:HClO<HCO3﹣
B.由水电离产生的c(H+):①=②
C.溶液③④中酸根离子浓度:c(ClO﹣)>c(HCO3﹣)
D.在④⑤溶液等体积混合后的溶液中:c(HCO3﹣)+c(CO32﹣)+c(H2CO3)=0.1 mol/L
11、下列有关实验操作的解释或结论正确的是
选项
实验操作
解释或结论
A
向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅
证明Na2CO3溶液中存在水解平衡
B
用蒸馏水润湿的pH试纸测溶液pH
一定会使测定结果偏低
C
向10mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/L FeCl3溶液,又生成红褐色沉淀
证明在相同温度下的Ksp:
Mg(OH)2 >Fe(OH)3
D
用氢氧化钾与浓硫酸测定中和反应的反应热
测得的结果偏小
12、某同学做如下实验:
已知K3[Fe(CN)6]遇Fe2+生成深蓝色沉淀,则下列说法正确的是
A.“电流计指针未发生偏转”,说明铁片I、铁片II均未被腐蚀
B.用K3[Fe(CN)6]溶液检验铁片III、IV附近溶液,可判断电池的正、负极
C.铁片I、III所处的电解质溶液浓度相同,二者的腐蚀速率相等
D.铁片IV的电极反应式为Fe-3e-=Fe3+
13、某温度下,向10 mL 0.1 mol/LCuCl2溶液中滴加0.1 mol/L的Na2S溶液,滴加过程中溶液中−lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是
已知:lg2=0.3,Ksp(ZnS)=3×10-25 mol2/L2。
A.a、b、c三点中,水的电离程度最大的为b点
B.Na2S溶液中:c(H+)+c(HS-)+c(H2S)= c(OH-)
C.该温度下Ksp(CuS)=4×10-36 mol2/L2
D.向100 mL Zn2+、Cu2+浓度均为10-5 mol•L-1的混合溶液中逐滴加入10-4 mol•L-1的Na2S溶液,Zn2+先沉淀
14、用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)===CH3OH(g)。在体积一定的密闭容器中按物质的量之比1∶2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
A.该反应的ΔH<0,且p1<p2
B.反应速率:v逆(状态A)>v逆(状态B)
C.在C点时, CO转化率为75%
D.在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数不同
15、25 ℃时,用0.1 mol·L-1的CH3COOH溶液滴定20 mL 0.1 mol·L-1的NaOH
溶液,当滴加V mL CH3COOH溶液时,混合溶液的pH=7。已知CH3COOH的电离平衡常数为Ka,忽略混合时溶液体积的变化,下列关系式正确的是
A.Ka = B.V= C.Ka = D.Ka =
16、电解质溶液的电导率越大,导电能力越强。用0.100 mol·L-1的NaOH溶液分别滴定10.00 mL浓度均为0.100 mol·L-1 的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是
A.曲线①代表滴定HCl溶液的曲线
B.A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol·L-1
C.在相同温度下,A、B、C三点溶液中水的电离程度:C<B<A
D.D点溶液中:c(Cl-)=2c(OH-)-2c(H+)
第II卷(非选择题,共52分)
二、填空题(5小题,共52分)
17、(12分)室温下向10 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。
(1)a点(横坐标为10)所示溶液中离子浓度从大到小的顺序为 ,其中c(Na+) c(A-)+c(HA)(填“>”“<”或“=”)。
(2)c点所示溶液中,c(Na+) c(A-)(填“>”“<”或“=”)。
(3)b点所示溶液中,c(A-) c(HA)(填“>”“<”或“=”)。
(4)a、b、c点所示溶液中,水的电离程度最大的是 。
(5)以下滴定操作会导致V(HA)偏大的是 。
A、滴定管滴定前有气泡,滴定后气泡消失
B、锥形瓶洗涤后没有干燥
C、滴定时锥形瓶中有液体溅出
D、滴定开始前读数时平视,滴定终点,读数时俯视
18、(10分)草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4工艺流程如下:
已知:
①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②酸性条件下Co3+的氧化能力很强。
③部分阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
沉淀物
Fe(OH)3
Fe(OH)2
Co (OH)2
Al(OH)3
Mn(OH)2
完全沉淀的pH
3.7
9.6
9.2
5.2
9.8
(1)浸出过程中加入Na2SO3的目的是将还原 (填离子符号)。
(2)请用平衡移动原理分析加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是: 。
(3)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。当加入过量NaF后,所得滤液c(Mg2+)/ c (Ca2+)= 。
【 已知:Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.00×10-10】
(1) 已知:NH3·H2O+OH− Kb=1.8×10−5;
H2C2O4H++ Ka1=5.4×10−2;
H++ Ka2=5.4×10−5。
所用(NH4)2C2O4溶液中离子浓度由大到小的顺序为______________________。
(2) 从萃后余液中制取CoC2O4·2H2O,需要进行的系列操作有蒸发浓缩、 、
过滤。
19、(14分)无色气体N2O4是一种强氧化剂,为重要的火箭推进剂之一。N2O4与NO2转换的热化学方程式为N2O4(g)2NO2(g) ΔH=+24.4 kJ/mol。
(1)将一定量N2O4投入固定容积的真空容器中,下述现象能说明反应达到平衡的是 。
A.v正(N2O4)=2v逆(NO2) B.体系颜色不变
C.气体平均相对分子质量不变 D.气体密度不变
达到平衡后,保持体积不变升高温度,再次到达平衡时,混合气体颜色 (填 “变深”“变浅”或“不变”),判断理由 。
(2)平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数[例如:p(NO2)=p总·x(NO2)]。写出上述反应平衡常数Kp表达式 (用p总、各气体物质的量分数x表示)。
(3)上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则Kp为 (以k正、k逆表示)。若将一定量N2O4投入真空容器中恒温恒压分解(温度298 K、压强100 kPa),已知该条件下k正=4.8×104 s-1,当N2O4分解20%时,v正= kPa·s-1。
(4)真空密闭容器中放入一定量N2O4,维持总压强p0恒定,在温度为T时,平衡时N2O4分解百分率为α。保持温度不变,向密闭容器中充入等量N2O4,维持总压强在2p0条件下分解,则N2O4的平衡分解百分率α` = 。
20、(16分)根据题目要求回答下列问题:
(1)某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀,相同温度下,溶解度AgSCN>AgI。
操作步骤
现象
步骤1:向2 mL 0.005 mol/L AgNO3溶液中加入2 mL 0.005 mol/L KSCN溶液,静置
出现白色沉淀
步骤2:取1 mL上层清液于试管中,滴加1滴2 mol/L Fe(NO3)3溶液
溶液变为红色
步骤3:向步骤2的溶液中继续加入5滴3 mol/L AgNO3溶液
溶液浑浊、红色变浅
步骤4:向步骤1余下的浊液中加入5滴3 mol/L KI溶液
出现黄色沉淀
① 步骤3实验目的是 。
② 用化学平衡原理解释步骤4中的实验现象: 。
(2)已知:
NH4Cl(s) = NH3(g) + HCl(g) ΔH = +163.9 kJ•mol-1
HCl(g) + CH3OH(g) = CH3Cl(g) + H2O(g) ΔH = -31.9 kJ•mol-1
①写出氯化铵和甲醇反应的热化学方程式 ,该反应在一定条件下能自发进行的原因是 。
②由下图知,HCl和CH3OH的混合气体通过催化剂时的最佳流速在20 L•min-1~30 L•min-1之间。流速过快,会导致氯甲烷产率下降,原因是 。流速过慢,会使副产物二甲醚增多,其反应为2CH3OH → CH3OCH3 + H2O,生产中常通入适量的水蒸气,该操作对制备CH3Cl的影响是 。
(3)某高能锂离子电池充电时,总反应方程式为LiMn2O4=Li1-xMn2O4+xLi。则充电时阳极的电极反应方程式为 。若电池的化学能转化为电能时的能量转化率为90%,则当消耗14 g锂时,电路中转移的电子数目为 NA。
福建师大附中2017-2018学年上学期期末考试
高二(实验班)化学答卷
1~16 DCCBA BDDCD ABCCA D
17(12分)
(1)c(Na+)>c(A-)>c(OH-)>c(H+) ; =
(2)= (3)> (4)a (5)A
18(10分)
(1)Fe3+、Co3+
(2)溶液中存在平衡Fe3++3H2OFe(OH)3+3H+、Al3++3H2OAl(OH)3+3H+,加入碳酸钠后,H+与CO32-反应,使水解平衡右移,从而产生沉淀
(3)0.735 (4)c()>c()>c(H+)>c()>c(OH−) (5)冷却结晶
19、(14分)
(1)BC ;变深;
正反应是吸热反应,其他条件不变,温度升高平衡正向移动,c(NO2)增加,颜色加深;
(2)p总x2(NO2)/x(N2O4);(3)K正/K逆 3.2×106
(4)
20、(16分)
(1)①证明AgSCN存在溶解沉淀平衡
②AgSCN(s) Ag+(aq)+SCN-(aq),加入KI后,因为溶解度AgI<AgSCN,故Ag+与I-反应生成AgI黄色沉淀:Ag++I-===AgI↓,AgSCN的溶解平衡正向移动
(2)①NH4Cl(s)+CH3OH(g)= NH3(g)+CH3Cl(g)+H2O(g)△H=+132kJ•mol-1;
化学反应自发进行满足条件△G=△H-T△S<0,该反应的△S>0、△H>0,适当提高反应温度△G可能小于0,能自发进行;
②流速过高反应物与催化剂的接触时间过短,原料利用率降低,导致产率降低;
对主副反应有抑制作用,提高CH3Cl纯度的同时,也降低了其产率;
(3)LiMn2O4–xe-=Li1-xMn2O4 + xLi+ 1.8