- 16.37 MB
- 2022-07-22 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
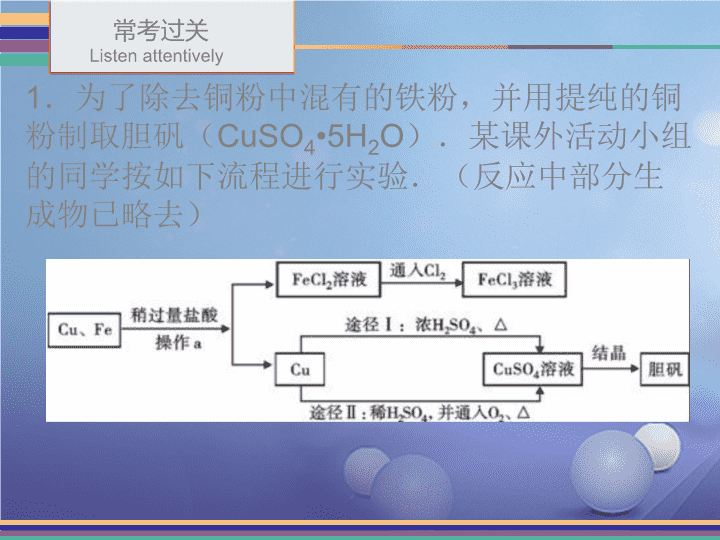
专题三工业流程\n目录contents常考过关能力提升中考再现\n常考过关Listenattentively1.为了除去铜粉中混有的铁粉,并用提纯的铜粉制取胆矾(CuSO4•5H2O).某课外活动小组的同学按如下流程进行实验.(反应中部分生成物已略去)\n常考过关目录contents\n常考过关Listenattentively已知:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O回答下列有关问题:(1)操作a的名称是;所用到的玻璃仪器有烧杯、和_____。除去铜粉中的铁粉,最简便的实验方法是.(2)FeCl2溶液中通入Cl2发生化合反应,写出该反应的化学方程式.(3)由Cu制CuSO4溶液的途径Ⅱ中,若不通入O2,反应将不会发生,原因是.过滤玻璃棒漏斗用磁铁吸引2FeCl2+Cl2=2FeCl3在金属活动顺序中,铜是位于氢之后的,与稀硫酸不反应\n常考过关Listenattentively途径Ⅱ与途径Ⅰ相比较,其显著的优点是_____________________________(回答一点即可).(4)FeCl3溶液可腐蚀铜以制作印刷线路板,反应只生成两种常见的盐,则该反应的化学方程式为.(5)CuSO4溶液转化为胆矾的操作步骤为:降温结晶,过滤,取滤渣,然后是洗涤、低温干燥,其中洗涤剂不可选用(选填序号)。a.热水b.冰水c.饱和CuSO4溶液不会产生污染空气的二氧化硫气体2FeCl3+Cu═2FeCl2+CuCl2加热浓缩a\n常考过关Listenattentively2.为了生产得到硫酸,用含硫铁矿石为原料,通过以下流程一系列的步骤进行,请根据流程回答下列问题::(1)含硫铁矿石进入沸腾炉燃烧前,需将其粉碎,其目的是:。增大反应物的接触面积\n常考过关Listenattentively(2)从沸腾炉出来的气体,含有二氧化硫、氧气、氮气、水蒸气以及砷硒化合物和矿尘等,在进入接触室之前,需对气体进行净化处理,主要有除尘(除去矿尘)、洗涤(除去砷硒化合物)、干燥(除去水蒸气)等过程,这过程发生了(填“物理变化”或“化学变化”)。(3)在接触室,在400-500℃,在五氧化二钒的催化作用下,二氧化硫被氧气氧化成三氧化硫。请写出此反应方程式:。物理变化2SO2+O2========2SO3400~500℃五氧化二钒\n常考过关Listenattentively(4)在吸收塔内,三氧化硫被浓硫酸中的水吸收,得到98.4%的浓硫酸(又叫“发烟硫酸”),可以被稀释成各种浓度的稀硫酸进行使用。这里发生反应的基本反应类型为_____________(5)整个流程可以循环使用的物质是。(6)尾气中含有二氧化硫,如果直接排放到空气中会造成环境污染,必须对尾气进行回收、净化处理。下列溶液用来处理尾气的效果最好的是:。(填写字母)A、稀硫酸B、氯化钡C、硝酸钠D、氨水化合反应SO2D\n能力提升目录contents\n能力提升Listenattentively3.(9分)海水是巨大的资源宝库。下图是某工厂对海水资源综合利用的示意图。(1)分离粗盐和母液的操作名称为_________;母液中一定含有的金属元素为__________。过滤钠和镁\n能力提升Listenattentively(2)步骤①的化学方程式是____________________________________;步骤②的基本反应类型为_____________。(3)甲同学提出,往母液中加入石灰乳应过量,其目的是,可以提高产率,乙同学认为将石灰乳换成NaOH溶液,也可以达到同样的效果,但给工厂的专业人员否定了,原因是________________________________。2NaCl+2H2O======2NaOH+Cl2↑+H2↑复分解反应将MgCl2完全转化为Mg(OH)2通电NaOH价格较贵,没有石灰乳廉价易得\n能力提升Listenattentively(4)下表为氯化钠在不同温度时的溶解度。结合表中数据回答:50℃时,氯化钠饱和溶液中溶质的质量分数为_______;从海水中获取粗盐,宜选用___________(填“蒸发结晶”或“降温结晶”)。27%蒸发结晶\n能力提升Listenattentively4.通过晾晒海水或者煮盐井水、盐湖水等,可以蒸发除去水分,得到粗盐.粗盐中含有多种可溶性杂质(氯化镁、氯化钙等)和不溶性杂质(泥沙等).工业上以粗盐为原料制取精盐,其生产流程如图所示:请回答下列问题:\n能力提升Listenattentively(1)已知操作a、b、c中均含同一种操作,其名称是;(2)加入过量的NaOH溶液的目的是;往溶液B中假如过量的X溶液,X的化学式是;(3)将足量稀盐酸加入溶液C中,反应的化学方程式为____________________________,_________________________________;(4)在蒸发操作中,用玻璃棒搅拌的作用是.过滤除去氯化镁Na2CO3NaOH+HCl=NaCl+H2O使液体受热均匀,防止局部过热造成液滴飞溅Na2CO3+2HCl=2NaCl+H2O+CO2↑\n能力提升Listenattentively(5)如果称量Ⅰ中称得粗盐的质量为5g,称量Ⅱ中称得精盐的质量为5.1g,则下列分析正确的是.A.精盐的产率一定为98.04%B.精盐的产率一定为102%C.蒸发操作中可能有水分没有蒸干D.溶解操作中可能有粗盐没有溶解E.除杂过程中有NaCl生成.CE\n能力提升Listenattentively5.从应用角度:利用空气制取氮肥的流程如图4所示。(1)利用空气制得N2和O2属于变化;(选填“物理”或“化学”)变化。(2)I中参加反应的单质甲为(填名称);Ⅱ中反应的化学方程式为;物理氨气4NH3+5O24NO+6H2O\n能力提升Listenattentively(3)物质所含元素化合价发生变化的反应称为氧化还原反应。则反应Ⅲ(填“属于”或“不属于”)氧化还原反应;(4)通过HNO3制得的氮肥一般是硝酸铵和硝酸钾,请写出一种能鉴别这两种氮肥的物质(填化学式);(5)从环保角度:下列保护空气措施合理的是(填标号)。A.工厂通过加高烟囱直接排放废气B.推广使用乙醇汽油代替普通汽油C.提倡步行、骑自行车等“低碳”出行方式属于NaOH或[Ca(OH)2]BC\n能力提升Listenattentively6.(7分)有一工业过程:(1)请将电石与水反应的化学方程式补充完整,C2H2\n能力提升Listenattentively(2)有关物质常温下的溶解度如下:上述流程中加入了KCl粉末,KCl与________(填化学式)发生了复分解反应得KClO3晶体,该过程得到KClO3晶体的原因是_____________________________。Ca(ClO3)2在常温下氯酸钾的溶解度较小,生成的氯酸钾过量会结晶析出\n能力提升Listenattentively为了提高KClO3晶体的产率,选择以下作为洗涤剂(填字母序号)。a.水b.饱和氯酸钾溶液c.饱和氯化钾溶液(3)写出向CaCl2溶液中通入两种气体生成CaCO3的化学方程式:___________________________。(4)该工业流程利用电石等原料制得产品中,可用于制取空气中体积含量约为0.03%的气体,在实验室制取该气体的反应方程式是。H2O+2NH3+CO2+CaCl2=CaCO3↓+2NH4ClCaCO3+2HCl═CaCl2+H2O+CO2↑b\n能力提升Listenattentively7.工业烟气脱硫就是将烟气中含有的二氧化硫除去。一种采用“双碱法”脱硫的工业流程示意图如下:(1)吸收塔中,用NaOH溶液吸收SO2,生成和H2O。NaOH溶液喷成雾状能充分吸收SO2的原因是。Na2SO3增大了反应物的接触面积\n能力提升Listenattentively(2)沉淀室中,发生反应的化学方程式为。(3)氧化室中,化学反应的基本类型是反应。(4)上述流程中,可以循环利用的物质是,有利于节约成本。Na2SO3+Ca(OH)2=CaSO3↓+2NaOH化合NaOH\n能力提升Listenattentively8.(10分)过氧化钙(CaO2)是一种对环境友好的多功能无机化合物,通常以下方法制备
已知:温度过高过氧化物会分解生成氧化物和氧气.方法:由鸡蛋壳(含CaCO3高达90%)为原料最终反应制得,其制备流程如下:\n能力提升Listenattentively(1)为了使鸡蛋壳反应更充分,请写出一种预处理鸡蛋壳的方法,煅烧过程中发生的反应方程式:;.(2)气体X是,实验室常用溶液来吸收.煅烧后的反应是化合反应,也能生成CaO2•8H2O,反应的化学方程式为.该反应需控制温度在0~2℃,可将反应器放置在,若温度过高会造成的后果有.(请写一点)洗涤干净后粉碎CaCO3高温CaO+CO2↑二氧化碳氢氧化钠Ca(OH)2+H2O2+6H2O=CaO2·8H2O冰水混合物中CaO2·8H2O分解\n能力提升ListenattentivelyCa(OH)2(3)获得的CaO2产品中主要含有的固体杂质是_________(填化学式)。\n能力提升Listenattentively9.某科研小组设计利用稀硫酸浸取某废弃的氧化铜锌矿(主要成分为Cu0和ZnO,其余成分既不与酸反应,也不溶解于水)的方案,实现废物综合利用。部分实验流程如下:\n能力提升Listenattentively请根据上述实验流程回答下列问题:(1)操作1的名称是_________。(2)在氧化铜锌矿中加入过量稀硫酸,主要成分发生反应的化学方程式为________________________,________________________。(3)加过量铁粉后,发生反应的基本反应类型是____________,得到滤渣1的成分为________(填化学式)。过滤ZnO+H2S04═ZnSO4+H2OCuO+H2SO4=CuSO4+H2O置换反应Fe、Cu\n能力提升Listenattentively(4)在实验过程中,双氧水会与反应生成和水,以便在后续的操作中将溶液中铁元素除去,高锰酸钾溶液也能将F氧化成。选用双氧水的优点是______________________。不引入较难除去的杂质\n能力提升Listenattentively10.某兴趣小组的同学从实验室收集到一桶含有FeSO4、CuSO4的废液,他们想从中回收金属铜和硫酸亚铁晶体,设计了如下操作方案,结合方案回答下列问题:\n能力提升Listenattentively(1)步骤(1)中,加入过量的金属X是,反应的化学方程式为,该反应属于四种基本类型中的反应;(2)固体A中含有,无色气体X为(均填化学式);(3)操作a的名称为,得到的溶液仍然浑浊的原因:;操作b是加热浓缩→→→洗涤→低温烘干。FeFe+CuSO4═FeSO4+Cu置换铁,铜H2过滤漏斗内液面高于滤纸边缘(或滤纸破损或仪器不干净)冷却结晶过滤\n能力提升Listenattentively(4)理论上所得硫酸亚铁晶体的质量(填“>”“<”或“=”)原废液中硫酸亚铁的质量.>\n能力提升Listenattentively11.人们的日常生活离不开金属,高科技新材料的开发和应用也需要金属.硅钢可用于制造变压器的铁芯,某化学兴趣小组的同学为了验证硅钢(主要含有Fe、C、Si),设计了如图的实验流程(有些反应的部分反应物和生成物已省略).\n能力提升Listenattentively查阅资料发现:常温下,单质硅(Si)不能与盐酸反应,但能与氢氧化钠溶液反应(Si+2NaOH+H2O═Na2SiO3+2H2↑).根据以上信息,回答下列问题:(1)固体A的成分为,E的化学式为;(2)滤液B中的阳离子有;(3)在过滤操作时,若发现滤液浑浊,应;碳、硅Fe2O3Fe2+查找原因,处理后重新过滤H+\n能力提升Listenattentively(4)步骤⑤中发生的是化合反应,尝试写出其化学方程式;(5)步骤⑦的反应属于反应(填基本反应类型),反应中元素的化合价的化合价升高。4Fe(OH)2+O2+2H2O=4Fe(OH)3置换碳\n能力提升Listenattentively【拓展探究】以锈蚀严重的废铜屑为原料,回收制取纯铜.查阅资料:Cu2(OH)2CO3+2H2SO4═2CuSO4+3H2O+CO2↑Cu2(OH)2CO3═2CuO+H2O+CO2↑如图是该兴趣小组设计的两种回收铜的实验方案:\n能力提升Listenattentively12.侯德榜是我国著名的化学家,为纯碱和氮肥工业技术的发展作出了杰出的贡献,他发明的侯氏制碱法大大提高了原料的利用率,其工业流程大致如图:\n能力提升Listenattentively【分析评价】①步骤Ⅱ反应过程中发生了还原反应的物质是(填化学式).②步骤Ⅲ、Ⅳ、Ⅴ都需要进行的实验操作是.③步骤Ⅴ过程发生反应的化学方程式为.④同一份废铜屑分别通过上述两种方案最终得到的铜的质量:方案一(填“>”或“=”或“<”)方案二.以上两种方案中,方案二优越于方案一,理由是(任答一点).CuO过滤Fe+H2SO4=FeSO4+H2↑=方案二不需加热\n能力提升Listenattentively(1)上述流程中,用到的原料有空气、焦炭、水、二氧化碳、等.(2)上述流程中,已知步骤②发生的是化合反应,步骤⑤发生的是分解反应,则步骤②、⑤发生反应的化学方程式是:②,⑤.(3)上述流程中,可循环利用的物质是.(4)上述流程中,“一种氮肥”的化学式是.氯化钠饱和溶液N2+3H22NH32NaHCO3Na2CO3+H2O+CO2↑.二氧化碳、水NH4Cl\n能力提升Listenattentively13.保险粉(化学式Na2S2O4)在工农业生产中有广泛的用途,Na2S2O4制备流程如下:[查阅资料]Na2S2O4在碱性溶液中稳定,在中性和酸性溶液中极不稳定;在NaCl存在下,Na2S2O4在水中溶解度显著下降。\n能力提升Listenattentively反应Ⅰ的原理为:Zn+2SO2==ZnS2O4,该反应类型为。反应Ⅱ为复分解反应,该反应的化学方程式为。操作a的名称为。(4)滤液中含有Na2S2O4,为使Na2S2O4结晶析出还需要加入少量NaOH的原因是,加入NaCl的原因是_______________________________________。198gZn(OH)2理论上能得到Zn的质量为。化合反应2NaOH+ZnS2O4==Zn(OH)2↓+Na2S2O4过滤使Na2S2O4稳定存在使Na2S2O4溶解度降低,更易结晶析出,提高产率130g\n中考再现Listenattentively14.Na2SO4是制造纸浆、染料稀释剂、医药品等的重要原料.某Na2SO4样品中含有少量CaCl2和MgCl2,实验室提纯Na2SO4的流程如图1\n目录contents中考再现\n中考再现Listenattentively(1)加入NaOH溶液可除去的阳离子是______(填离子符号),其反应的化学方程式为:________________________________.若添加的NaOH和Na2CO3添加过量,可加入适量_______(填名称)除去.(2)操作a的名称是_________,该操作中用到的有烧杯,玻璃棒、______.Mg2+2NaOH+MgCl2═Mg(OH)2↓+2NaCl稀硫酸过滤漏斗\n(3)溶液M中的溶质是Na2SO4和杂质NaCl,观察如图的溶解度曲线,则操作b是:先将溶液M蒸发浓缩,再降温结晶、过滤,降温结晶的最佳温度范围是______以下,因为Na2SO4的溶解度____________________________________________________________。中考再现Listenattentively在30℃以下比氯化钠小(或在30℃以下受温度影响比氯化钠大)30℃\n中考再现Listenattentively15.(9分)现有工厂丢弃的废铜屑(铜屑表面呈绿色,其中混有少量生锈铁屑)。课外活动小组同学欲利用其制取胆矾,他们设计了下面的两种制取流程。已知Cu+Fe2(SO4)3=2FeSO4+CuSO4,请回答:\n中考再现Listenattentively(1)铜屑表面呈绿色的物质化学式是Cu2(OH)2CO3,俗称,操作所用到的玻璃仪器有:烧杯、玻璃棒和。(2)溶液A的溶质有______________________(只写一种);铁锈与稀硫酸反应的化学方程式为:_____________________________________。(3)两种方法比较,符合绿色化学要求的是方法;方法II的化学方程式为:2Cu+2H2SO4+=2CuSO4+,操作‚实验步骤为:,降温结晶。铜绿漏斗硫酸铜(硫酸亚铁或硫酸)Fe2O3+3H2SO4===Fe2(SO4)3+3H2OIIO22H2O蒸发浓缩\n中考再现Listenattentively16.(9分)甲班学生做完实验室制备氧气和还原金属氧化物的实验后,剩余物质倒入同一废液缸里。乙班课外兴趣小组同学进行了如图所示的探究。请回答:\n中考再现Listenattentively(1)步骤①的操作名称是___________,所用到的玻璃仪器有漏斗、玻璃棒和___________。(2)由步骤②实验现象推知,甲班同学制取氧气所用的固体反应物是___________(写化学式)。(3)由步骤④所得溶液加入氢氧化钠可得红棕色沉淀,该反应的化学方程式为__________________________________。过滤烧杯KClO3Fe2(SO4)3+6NaOH=2Fe(OH)3↓+3Na2SO4\n中考再现Listenattentively(4)由步骤③产生的气体判断固体A中一定含有___________(写名称);综合步骤③④现象推理,固体A中还可能含有的物质是______________________________(写至少两种物质的化学式)。(5)根据上述实验和分析判断固体是___________(写化学式)。炭MnO2、Fe、Fe2O3(任写两个)MnO2\n谢谢观看!