- 173.50 KB
- 2022-08-12 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
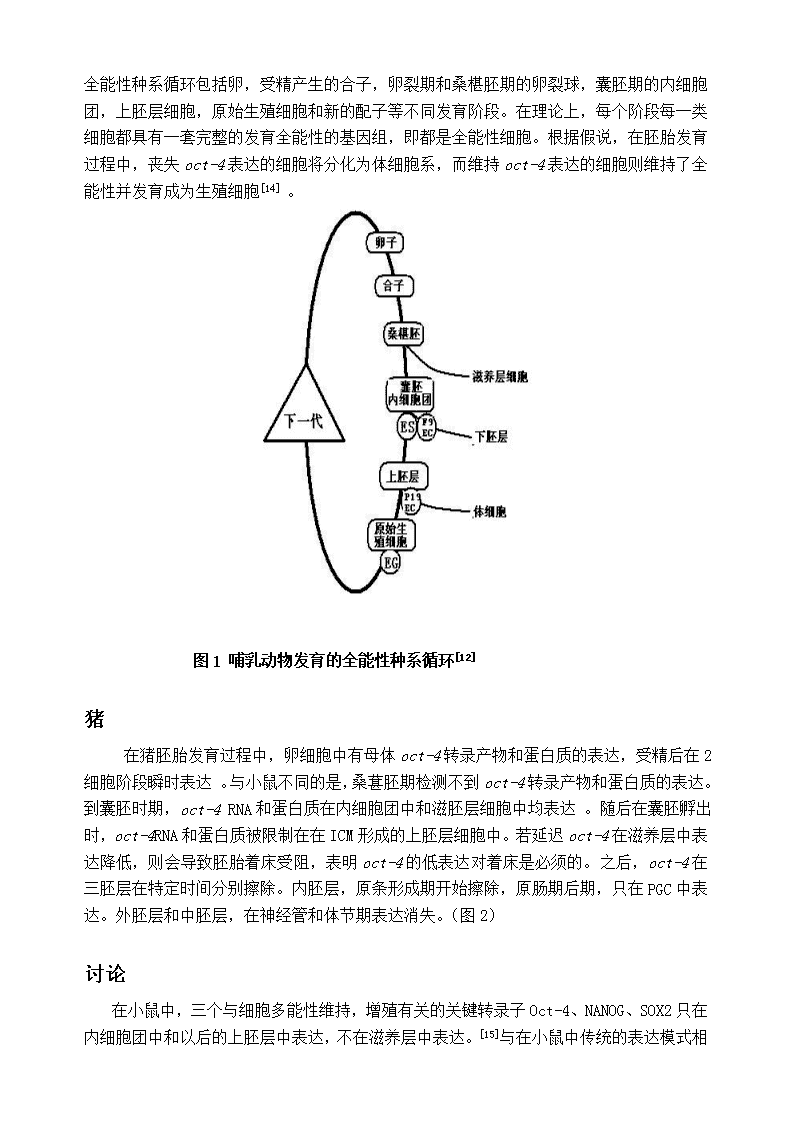
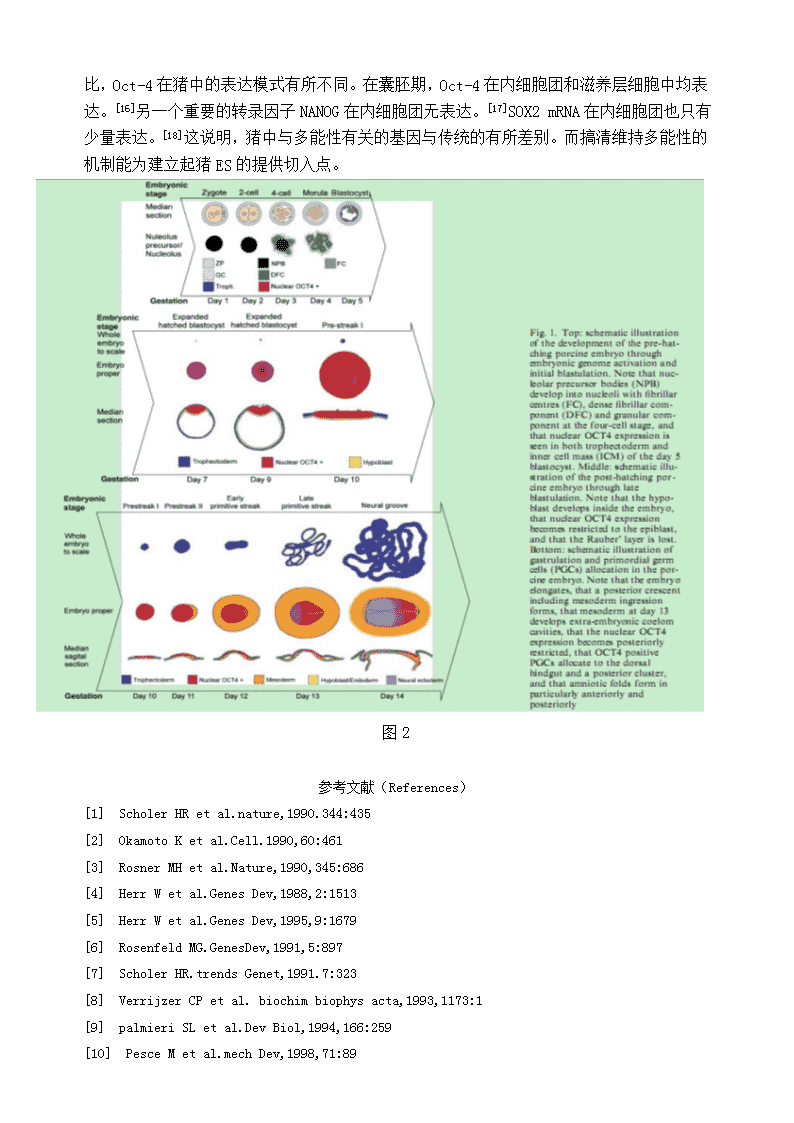
Oct4在小鼠和猪植入前胚胎的表达情况摘要Oct-4这种传统的多能因子在小鼠中研究较多,而猪中Oct-4的表达情况与传统表达模式有差别。搞清猪多能因子的表达情况及其机制可对猪的ES的建立提供切入点。关键词Oct-4小鼠猪Oct-4属于POU转录因子家族的一员[1~3]。POU家族转录因子都有一个保守的DNA结合结构域—POU结合域。它由于最先在转录因子Pit-1,Oct-1,Oct-2和Unc-86中发现而命名[4]。POU结合域分为两部分:N端大约74~82个氨基酸构成POU家族特有的保守结构域,POUs结构域;C端大约60个氨基酸构成传统的同源异型结构域,POUHD结构域。POUs和POUHD结构域间有连接肽连接。根据POU结构域的同源性和连接肽的长度,POU转录因子家族被分为7个亚族,Oct-4属于第V亚族[5,6]。Oct-4转录因子是因能与含八聚体模体(octamermotif)的DNA结合而命名的,除Oct-4外还有大量蛋白质能与这种八聚体模体结合,分别从Oct-1命名到Oct-10,它们有专一的细胞和组织的表达模式,但都属于POU家族[7]。Oct转录因子结合的八聚体模体的保守序列是ATGCAAAT[8],Oct-4转录因子正是通过结合到八聚体模体上而调节基因的转录的。小鼠在小鼠胚胎发育过程中,卵细胞中有母体oct-4转录产物和蛋白质的表达,受精后在2细胞和4细胞胚胎阶段,在所有卵裂球胞质中有相对低水平的Oct-4蛋白的表达[9~11]。合子oct-4的表达在4细胞胚胎阶段被激活,随后直到桑椹胚,在所有胚胎细胞核中可观察到高水平的Oct-4蛋白的表达[11]。到囊胚时期,oct-4RNA和蛋白质只在内细胞团中维持先前的表达水平,而在滋胚层细胞中表达下降[9]。随后oct-4RNA和蛋白质在ICM形成的上胚层细胞中一直维持表达,在下胚层细胞中的表达有暂时性升高,但随着其分化成脏壁、体壁内胚层细胞而消失[7,9]。在原肠胚形成的过程中,oct-4在上胚层中的表达从前端向后端逐渐减少,最后只在原始生殖细胞中表达,直到其开始性别分化为止[12,13]。在体外,oct-4只在未分化的胚胎干细胞(ES细胞)、胚胎癌细胞(EC细胞)和胚胎生殖细胞(EG细胞)中表达,当这些细胞被诱导向体细胞分化时,oct-4表达下降[1~3,12]。这一特异的表达模式提示我们,oct-4在哺乳动物胚胎发生中是一个关键的调控因子,而且可能在维持细胞的全能性及未分化状态中起着重要的作用,并因此提出了全能性种系循环假说,该假说提出:生物体有性繁殖的生殖细胞由于具有能分化形成单倍体配子,再通过受精,胚胎发育而形成新的个体,而被称为具有全能性。在哺乳动物中,生殖细胞是种系通过一系列发育过程逐渐演进而形成的,这一过程被称为全能性种系循环[12](\n图1)。哺乳动物的全能性种系循环包括卵,受精产生的合子,卵裂期和桑椹胚期的卵裂球,囊胚期的内细胞团,上胚层细胞,原始生殖细胞和新的配子等不同发育阶段。在理论上,每个阶段每一类细胞都具有一套完整的发育全能性的基因组,即都是全能性细胞。根据假说,在胚胎发育过程中,丧失oct-4表达的细胞将分化为体细胞系,而维持oct-4表达的细胞则维持了全能性并发育成为生殖细胞[14]。图1哺乳动物发育的全能性种系循环[12]猪在猪胚胎发育过程中,卵细胞中有母体oct-4转录产物和蛋白质的表达,受精后在2细胞阶段瞬时表达。与小鼠不同的是,桑葚胚期检测不到oct-4转录产物和蛋白质的表达。到囊胚时期,oct-4RNA和蛋白质在内细胞团中和滋胚层细胞中均表达。随后在囊胚孵出时,oct-4RNA和蛋白质被限制在在ICM形成的上胚层细胞中。若延迟oct-4在滋养层中表达降低,则会导致胚胎着床受阻,表明oct-4的低表达对着床是必须的。之后,oct-4在三胚层在特定时间分别擦除。内胚层,原条形成期开始擦除,原肠期后期,只在PGC中表达。外胚层和中胚层,在神经管和体节期表达消失。(图2)讨论在小鼠中,三个与细胞多能性维持,增殖有关的关键转录子Oct-4、NANOG、SOX2只在内细胞团中和以后的上胚层中表达,不在滋养层中表达。[15]\n与在小鼠中传统的表达模式相比,Oct-4在猪中的表达模式有所不同。在囊胚期,Oct-4在内细胞团和滋养层细胞中均表达。[16]另一个重要的转录因子NANOG在内细胞团无表达。[17]SOX2mRNA在内细胞团也只有少量表达。[18]这说明,猪中与多能性有关的基因与传统的有所差别。而搞清维持多能性的机制能为建立起猪ES的提供切入点。图2参考文献(References)[1]ScholerHRetal.nature,1990.344:435[2]OkamotoKetal.Cell.1990,60:461[3]RosnerMHetal.Nature,1990,345:686[4]HerrWetal.GenesDev,1988,2:1513[5]HerrWetal.GenesDev,1995,9:1679[6]RosenfeldMG.GenesDev,1991,5:897[7]ScholerHR.trendsGenet,1991.7:323[8]VerrijzerCPetal.biochimbiophysacta,1993,1173:1[9]palmieriSLetal.DevBiol,1994,166:259[10]PesceMetal.mechDev,1998,71:89\n[11]YeomYletal.MechDev,1991,35:171[12]YeomYletal.Development,1996,122;881[13]PesceMetal.Bioessays,1998,20:271[14]PesceMetal.Stemcells,2001,19:271[15]BoyerLA,LeeTI,ColeMF,JohnstoneSE,LevineSS,ZuckerJP,JacobP,GuentherMG,KumarRM,MurrayHL,JennerRG,GiffordDK,MeltonDA,JaenischR,YoungRA,2005:Coretranscriptionalregulatorycircuitryinhumanembryonicstemcells.Cell122,947–956.[16]KeeferCL,PantD,BlombergL,TalbotNC,2007:Challengesandprospectsfortheestablishmentofembryonicstemcelllinesofdomesticatedungulates.AnimReprodSci98,147–168.[17]KuijkEW,DuPuyL,VanTolHTA,OeiCHY,HaagsmanHP,ColenbranderB,RoelenBA,2008:Differencesinearlylineagesegregationbetweenmammals.DevDyn237,918–927.[18]MagnaniL,CabotRA,2008:Invitroandinvivoderivedporcineembryospossesssimilar,butnotidentical,patternsofOct4,Nanog,andSox2mRNAexpressionduringcleavagedevelopment.MolReprodDev75,1726–1735.