- 11.05 MB
- 2022-08-12 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
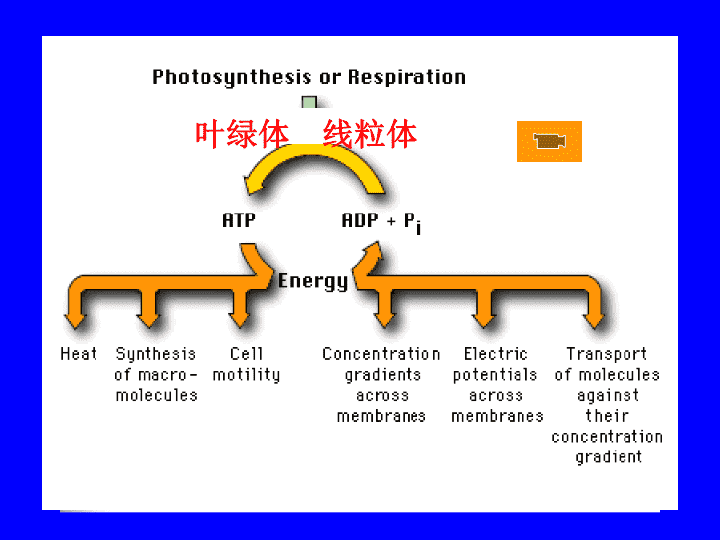
第六章线粒体与叶绿体\n生物能量的转化叶绿体线粒体\n第一节线粒体与氧化磷酸化Altmann(1890)、Meves(1904)分别首次在动植物细胞中观察到线粒体;Michaelis(1900)用JanusgreenB(氧化态呈淡蓝绿色)对其进行活体染色,证实其可发生氧化还原反应;Kennedy&Lehninger(1943-1950)证实其为柠檬酸循环、氧化磷酸化和脂肪酸氧化的场所;(细胞组分分离技术)Palade&Sjostrand(1952~1953)观察到其电镜下精细结构;(电镜技术)随后发现其中存在DNA及转录、翻译系统。线粒体(mitochondrion)的认识历程:\n一线粒体的形态结构随细胞种类和生理状态变化而变化;外形:线状、颗粒状、哑铃状、环形、圆柱形等。大小:直径为0.5~1μm,长约2~3μm。显微镜下一个线粒体的变形(一)线粒体的形态、大小、数量和分布\n数目:动物细胞较植物细胞多;代谢旺盛的细胞中较多,人成熟红细胞中无线粒体;分布:集中在细胞功能旺盛区域;•迁移时以微管为导轨、由马达蛋白提供动力。心肌细胞精子尾部鞭毛髓部线粒体\n(二)线粒体的超微结构由外向内分为4个部分:外膜(outermembrane)膜间腔(intermembranespace)内膜(innermembrane)基质/内室(matrix/innerchamber)电镜下是由两层单位膜围成的封闭囊状结构\n1外膜一层厚约6nm的单位膜,包围在线粒体最外面;脂类组成与内质网相似;含大量孔蛋白(Porin),允许<10KDa分子通过,具高通透性,使得膜间隙环境几乎与胞质溶胶相似。含一些特殊的酶(单胺氧化酶monoamineoxidase)外膜\n2内膜外膜内侧的一层单位膜心磷脂(一个分子含4个非极性链)含量高(达20%)通透性很低,仅允许不带电荷的小分子透过,利于ATP形成;含转运蛋白,以进行物质运输;向内折叠形成嵴(cristae),嵴上有基粒。\n线粒体内膜向基质侧折叠形成的突起;扩大内膜表面积(达5~10倍),成板层状或管状;形态、数量因细胞类型而异。基粒(elementaryparticle)内膜和嵴的基质面上带柄的颗粒;由头部(F1)和基部(F0)构成。嵴(cristae):(F1-F0ATP酶)\n长轴垂直板层状嵴管状嵴心肌细胞排列紧密的板层状嵴纵行排列板层状嵴\n3膜间腔外膜与内膜间的空腔,由于外膜通透性很强,而内膜的通透性又很低,所以膜间隙中的化学成分几乎接近细胞质基质,功能是建立和维持H+梯度。\n4基质(matrix)充斥在内膜包围的嵴外空间(又称内室innerchamber)中,内有:酶:参与三羧酸循环、脂肪酸氧化及蛋白合成;基质颗粒:内含Ca2+、Mg2+、Zn2+等离子;线粒体DNA、RNA及核糖体。\n二线粒体的化学组成及酶定位◆蛋白质(干重的65~70%)◆脂类(干重的25~30%):·磷脂占3/4以上,外膜主要是卵磷脂,内膜主要是心磷脂。·脂类/蛋白质:◆核酸:DNA、RNA和tRNA内膜:0.3:1;外膜:1:1\n线粒体组分的分离技术低渗处理一定转速下离心,上清液为膜间腔组分膜间腔组分转入高渗溶液使其回缩密度梯度离心,分离外膜去垢剂(Lubrol)裂解内膜并离心内膜基质外膜\n线粒体主要酶的分布(第一个为各部分标志酶)\n三线粒体的功能氧化磷酸化:糖、脂和氨基酸彻底氧化放能;参与氧自由基ROS的生成;参与细胞程序性死亡(通过开启内膜上非特异性通道而改变线粒体通透性实现);胞内Ca++调节、信号转导;离子跨膜转运等;线粒体的存在状况反映了细胞对能量的需求\n生物氧化的分区和定位多糖、蛋白和脂肪最初的分解(细胞质基质)TCA循环(线粒体基质)电子传递、氧化磷酸化(线粒体内膜)氧化磷酸化过程是能量转换过程,即有机分子中的能量高能电子质子动力势ATP\n(一)氧化磷酸化作用的分子结构基础氧化(电子传递、消耗氧,放能)与磷酸化(ADP+Pi,储能)同时进行,密切偶连,分别由两个不同的结构体系执行。\n尿素或胰蛋白酶超声波光滑线粒体小泡电子传递+ATP合成-ATP酶活性-F1颗粒电子传递-ATP合成-ATP酶活性+重组颗粒电子传递+ATP合成+ATP酶活性-亚线粒体颗粒电子传递+ATP合成+ATP酶活性-分离颗粒电子传递+ATP合成-ATP酶活性+完整线粒体电子传递+ATP合成+\n电子传递链(electron-transportchain):由供体到受体进行电子传递的一组电子载体,链上每一步都伴随能量释放。1)呼吸链的氧化还原酶系:烟酰胺脱氢酶;黄素相关的脱氢酶/黄素蛋白;铁硫蛋白(iron-sulfurprotein);泛醌/辅酶Q(ubiquinone/CoQ):Q,QH2,QH细胞色素(cytochrome,Cyt):以铁卟啉为辅基。1电子传递链(呼吸链)的组成\n2)电子传递链的四种复合物(哺乳类)◆复合物Ⅰ:NADH-CoQ还原酶复合物(电子传递体和H+移位体)组成:含42个亚基,至少6Fe-S中心和1黄素蛋白。作用:氧化NADH,将2e-CoQ;泵出4H+◆复合物Ⅱ:琥珀酸脱氢酶复合物(电子传递体而非H+移位体)组成:含FAD辅基,2Fe-S中心,1Cytb作用:氧化琥珀酸,2e-FADFe-SCoQ\n◆复合物Ⅲ:细胞色素bc1复合物(电子传递体和H+移位体)组成:二聚体,单体含1cytc1、2cytb、1Fe-S蛋白作用:催化CoQ氧化,2e-cytc;泵出4H+(2个来自UQ,2个来自基质)◆复合物Ⅳ:Cytc氧化酶(电子传递体和H+移位体)组成:二聚体,单体含1cyta,1cyta3和2Cu作用:氧化cytc,2e-O2,泵出2H+,\n3)呼吸链的电子传递及其抑制剂和作用部位鱼藤酮×抗霉素A××氰化物叠氮钠CO氧化还原电势\n\n琥珀酸脱氢酶通过电子传递链实现了跨膜的H+浓度差\n的多亚基蛋白复合物,由水溶性F1头部和疏水性F0基部所组成,也叫F1F0ATPase。线粒体基质膜间腔2ATP合成酶(ATPsynthase)F0F1:亲水性头部,易分离,催化ATP水解,含3α、3β、γ、δ和ε;β:催化ATP合成/水解;ε:抑制ATP水解,堵塞H+通道;F0:疏水性基部,传送H+到F1,含1a,2b,10-14c。a:H+通道;“转子”:γ,ε“定子”:a,b,δ\nγ亚单位包含一个弯曲的螺旋环,由其组成“轴”插入由α和β组成的环中.F1ATPase的晶体结构α,β,γ,δ,ε\nATP合成酶是一个可逆的偶联装置,它可利用质子动力势合成ATP,又可利用ATP水解的能量将质子由基质中泵出内膜\n(二)氧化磷酸化偶联机制氧化电子传递链磷酸化ATP合成酶1953年由SlaterE.C.提出“化学偶联学说”。1961年MitchellP.提出“化学渗透假说”。1964年BoyerP.D.提出“构象假说”。至20世纪70年代,化学渗透假说在取得大量实验结果证实的基础上,成为氧化磷酸化作用中较为流行的一种假说。\n化学渗透假说主要内容在呼吸链电子传递过程中,通过线粒体内膜上呼吸链组分间氢与电子的交替传递,使H+从内膜内侧向外侧定向转移。由于线粒体内膜对H+高度不通透,造成内膜两侧跨膜质子梯度,形成质子动力势(H+浓度差&膜电位)。其中蕴藏的能量驱使H+穿过ATP合酶,驱动ADP与Pi形成ATP。\n电子传递链可作为质子泵,将线粒体基质中的H+泵至膜间腔\n膜内外质子浓度差和电势差构成质子动力势,驱动质子穿过ATP酶,促使ATP合成;\n化学渗透假说的实验证据:细菌视紫红质质子泵·ATP合成动力为质子动力势·完整性膜是维持质子动力势的前提;·电子传递和ATP合成是相关但又不同的事件。?去垢剂ATP酶加入磷脂并去除去垢剂脂质体\n(三)ATP合成酶作用机制以PDBoyer为代表,提出了通过ATP合酶合成ATP的“结合变化”(bindingchangemechanism)和“旋转模型”(rotationalmodel)。内容:ATP合酶3个β亚基各具一定构象,不同构象与核苷酸亲和力不同。H+流驱动γ和ε旋转1200的情况下,3β亚基构象发生相互转变,引起β亚基对ATP、ADP和Pi亲和力的改变,使ATP合成和释放。P.D.Boyer和J.E.Walker荣获1997年诺贝尔化学奖(各1/4,另1/2由Na+-K+泵学说提出者获得)。\na和c产生/失去瞬间盐桥c的Asp结合/解离H+c极性环和转子结合/分离产生扭力距使转子转动H+通过a和c亚基形成的通道,推动转子旋转质子动力势推动H+沿膜间腔Ic-AspII流动,驱动c和γ旋转;象水轮发电机一样工作。ArgH+通IIH+通道I\n结合变化机制:β三种状态:O空置状态T紧密结合态L松散结合态γ和ε的转动引起β构象变化,催化ATP生成ATPADP+Pi\n在嗜热菌的F1ATPaseβ的N端添加10个His,固定在Ni-NTA膜上;将γN端的一个Ser换为Cys,以连上肌动蛋白丝(荧光标记);加ATP后可观察到肌动蛋白丝旋转;NojiHetal.1997,Nature转子旋转的试验学证据:\n四半自主性的细胞器—线粒体线粒体是一个含有DNA并能进行转录和转译的细胞器。线粒体中含有DNA、mRNA、tRNA、核糖体、氨基酸活化酶等。1966年Slonimski证明了线粒体DNA具有遗传功能,被认为是真核细胞的第二遗传系统。\n1线粒体DNA的结构线粒体DNA(简称mtDNA)较小,结构简单,位于线粒体基质中和线粒体内膜上。不含组蛋白,呈环形,与细菌基因组相似。哺乳动物线粒体基因组大小为16500碱基对(bp)。\n\n\n2线粒体基因组编码的RNA和蛋白质线粒体DNA转录的rRNA、tRNA均通过线粒体核糖体用于合成线粒体蛋白质(数目有限)。真核生物线粒体核糖体的RNA组分和蛋白质的构成、大小及对抗生素敏感性方面均不同于细胞质核糖体,但某些方面类似原核生物核糖体。线粒体中的多数蛋白由核基因编码、在细胞质核糖体中合成。故线粒体基因在转录与转译过程中受核基因控制,对核基因具很大依赖性。\n\n\n3线粒体蛋白的跨膜分选在游离核糖体合成,以包含“成熟”蛋白和N端导肽(1eaderpeptide)的前体(precursor)存在。导肽引导蛋白通过内外膜的接触点进入线粒体,指导蛋白进入线粒体特定部位后被切除。蛋白前体跨膜时需解折叠(unfolding);跨膜后需重新折叠(refolding),需“分子伴侣”参与。\n导肽结构特点常疏水,由非电负性氨基酸构成,中间有碱性氨基酸,但无酸性氨基酸;(线粒体基质带负电荷)羟基氨基酸含量高(特别是Ser),易形成双亲螺旋;不同导肽缺乏同源性,和识别有关的信号不是一级结构,而是二、三级结构;\n导肽运送蛋白质时具有以下特点:①需受体;②消耗ATP;③需分子伴侣;④由电化学梯度驱动;⑤导肽被切除;⑥通过接触点进入;⑦解折叠形式运输。\n\n线粒体内外膜的接触点\n位于N端,富含带正电荷和疏水的氨基酸,形成两性α螺旋,完成转运后被切除。不被切除,含疏水性停止转移序列,被安插到外膜。被切除,含疏水性的停止转移序列,被安插到内膜。含两个信号序列,先到基质,第一个信号被切除,第二个信号引导入内膜或膜间隙。结构类似于N端信号序列,但位于蛋白质内部。膜转运蛋白,具多个内部信号序列和停止转移序列,形成多次跨膜蛋白。基质外膜内膜内膜膜间隙内膜内膜信号序列定位线粒体蛋白分选信号\n进入线粒体不同部位的蛋白具有不同的转运途径:1)外膜蛋白:具不被切除的N端信号序列和疏水的停止转移序列,蛋白质被转运复合体安装到外膜上(孔蛋白);2)基质蛋白:通过线粒体内外膜之间的接触点,由质子动力势提供的能量跨越内膜进行运送。\n3)进入线粒体内膜和膜间腔的蛋白①N端具2个信号,先被运到基质后导肽被切除,暴露出第2个信号序列,指导其插入内膜。\n②具导肽和可结合膜上的通道复合体的停止转移序列,前者被切除,后者脱离通道复合体进入内膜(B),若其被切除,则成为膜间腔蛋白(C)。\n③内膜转运蛋白:其N端无可被切除的信号序列,但含3-6个内部信号序列,可被TIM22复合体插到内膜上(D)。\n五线粒体的增殖通过已有线粒体的生长与分裂进行繁殖。1.间壁分离的方式,即分裂时先由内膜向中心皱褶,中间产生隔膜,将线粒体分为两个;2.通过线粒体中部缢缩并向两端不断拉长,然后再分裂为两个,如蕨类和酵母等的线粒体分裂;3.出芽生殖。\n\n六线粒体与疾病线粒体疾病多由MtDNA突变与功能缺陷所致;其突变率比核DNA大10~20倍。自1997年以来,已知由人类线粒体疾病引起的遗传疾病已达百种以上。线粒体疾病常包含在一些高能量需求的组织中,如心脏、肌肉和中枢神经系统等。肌阵挛羊癫风;地方性心肌病(克山病)。线粒体与衰老也密切有关(体内约95%氧自由基由Mt产生)。线粒体的功能与细胞凋亡密切相关。(cytc释放)克山病地方性心肌病,1935年首先流行于黑龙江克山县。流行于我国东北、西北、华北及西南一带山区或丘陵地带。以心肌的变性、坏死及修复后形成瘢痕为特点,伴急性或慢性心功能不全。病理:心肌线粒体功能与结构的破坏。ATPases和琥珀酸脱氢酶等活性被明显抑制,心肌线粒体肿胀,嵴膜破坏,线粒体膜融合、消失。病因不清:病毒感染,营养结构(缺硒),黄绿青霉素(CIT)中毒;CIT是ATP的类似物,可与ATPases相作用而降低其活性。传播途径:病区产粮食如玉米、小米等被青霉菌污染并产生CIT毒素而传病。杨福愉