- 886.50 KB
- 2022-08-16 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
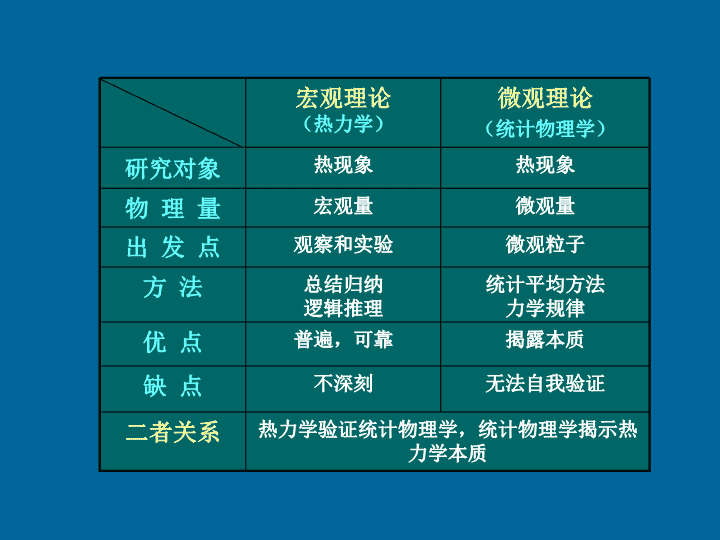
第11章热力学基础风力发电为了环境不受污染,也为解决一次性能源大量消耗终将导致枯竭的危险,人们在不断的寻求新能源。目前全球风力发电装机容量已超过13932MW\n§11.1热力学的研究对象和研究方法一.热学的研究对象热现象热学物体与温度有关的物理性质及状态的变化研究热现象的理论热力学从能量转换的观点研究物质的热学性质和其宏观规律宏观量二.热学的研究方法微观量描述宏观物体特性的物理量;如温度、压强、体积、热容量、密度、熵等。描述微观粒子特征的物理量;如质量、速度、能量、动量等。\n微观粒子观察和实验出发点热力学验证统计物理学,统计物理学揭示热力学本质二者关系无法自我验证不深刻缺点揭露本质普遍,可靠优点统计平均方法力学规律总结归纳逻辑推理方法微观量宏观量物理量热现象热现象研究对象微观理论(统计物理学)宏观理论(热力学)\n§11.2平衡态与准静态过程理想气体状态方程一.系统和外界热力学系统热力学所研究的具体对象,简称系统。外界系统是由大量分子组成,如气缸中的气体。系统以外的物体系统与外界可以有相互作用例如:热传递、质量交换等系统••••系统的分类开放系统系统与外界之间,既有物质交换,又有能量交换。\n封闭系统孤立系统系统与外界之间,没有物质交换,只有能量交换。系统与外界之间,既无物质交换,又无能量交换。二.气体的状态参量温度(T)体积(V)压强(p)气体分子可能到达的整个空间的体积大量分子与器壁及分子之间不断碰撞而产生的宏观效果大量分子热运动的剧烈程度温标:温度的数值表示方法国际上规定水的三相点温度为273.16K\n1.定义在没有外界影响的情况下,系统各部分的宏观性质在长时间内不发生变化的状态。三.平衡态说明(1)不受外界影响是指系统与外界不通过作功或传热的方式交换能量,但可以处于均匀的外力场中;如:两头处于冰水、沸水中的金属棒是一种稳定态,而不是平衡态;处于重力场中气体系统的粒子数密度随高度变化,但它是平衡态。低温T2高温T1(2)平衡是热动平衡\n(3)平衡态的气体系统宏观量可用一组确定的值(p,V,T)表示(4)平衡态是一种理想状态四.准静态过程系统从某状态开始经历一系列的中间状态到达另一状态的过程。热力学过程1221准静态过程在过程进行的每一时刻,系统都无限地接近平衡态。\n非准静态过程系统经历一系列非平衡态的过程实际过程是非准静态过程,但只要过程进行的时间远大于系统的驰豫时间,均可看作准静态过程。如:实际汽缸的压缩过程可看作准静态过程S说明(1)准静态过程是一个理想过程;(3)准静态过程在状态图上可用一条曲线表示,如图.(2)除一些进行得极快的过程(如爆炸过程)外,大多数情况下都可以把实际过程看成是准静态过程;OVp\n五.理想气体的状态方程气体的状态方程(3)混合理想气体的状态方程为其中理想气体的状态方程(平衡态)(1)理想气体的宏观定义:在任何条件下都严格遵守克拉珀龙方程的气体;(2)实际气体在压强不太高,温度不太低的条件下,可当作理想气体处理。且温度越高、压强越低,精确度越高.说明(克拉珀龙方程)\n一柴油的汽缸容积为0.827×10-3m3。压缩前汽缸的空气温度为320K,压强为8.4×104Pa,当活塞急速推进时可将空气压缩到原体积的1/17,使压强增大到4.2×106Pa。解T2>柴油的燃点若在这时将柴油喷入汽缸,柴油将立即燃烧,发生爆炸,推动活塞作功,这就是柴油机点火的原理。例求这时空气的温度\n§11.3功热量内能热力学第一定律一.功热量内能1.概念热力学系统与外界传递能量的两种方式作功传热是能量传递和转化的量度;是过程量。功(A)•••热量(Q)是传热过程中所传递能量的多少的量度;是过程量内能(E)是物体中分子无规则运动能量的总和;是状态量系统吸热:系统对外作功:;外界对系统作功:;系统放热:\n2.功与内能的关系12外界仅对系统作功,无传热,则说明(1)内能的改变量可以用绝热过程中外界对系统所作的功来量度;绝热壁绝热过程(2)此式给出过程量与状态量的关系\n3.热量与内能的关系外界与系统之间不作功,仅传递热量系统说明(1)在外界不对系统作功时,内能的改变量也可以用外界对系统所传递的热量来度量;(2)此式给出过程量与状态量的关系(3)作功和传热效果一样,本质不同二.热力学第一定律外界与系统之间不仅作功,而且传递热量,则有\n系统从外界吸收的热量,一部分使其内能增加,另一部分则用以对外界作功。(热力学第一定律)对于无限小的状态变化过程,热力学第一定律可表示为(1)热力学第一定律实际上就是包含热现象在内的能量守恒与转换定律;说明(2)第一类永动机是不可能实现的。这是热力学第一定律的另一种表述形式;(3)此定律只要求系统的初、末状态是平衡态,至于过程中经历的各状态则不一定是平衡态。(4)适用于任何系统(气、液、固)。\n§11.4准静态过程中功和热量的计算一.准静态过程中功的计算SV1V2热力学第一定律可表示为OVp(功是一个过程量)12\n二.准静态过程中热量的计算1.热容•热容比热容••摩尔热容注意:热容是过程量,式中的下标x表示具体的过程。\n2.定体摩尔热容CV和定压摩尔热容Cp(1摩尔物质)(1)定体摩尔热容CV(2)定压摩尔热容Cp3.热量计算若Cx与温度无关时,则\n§11.5理想气体的内能和CV,Cp一.理想气体的内能气体的内能是p,V,T中任意两个参量的函数,其具体形式如何?1.焦耳试验问题:(1)实验装置温度一样实验结果膨胀前后温度计的读数未变\n气体绝热自由膨胀过程中(2)分析说明(1)焦耳实验室是在1845完成的。温度计的精度为0.01℃水的热容比气体热容大的多,因而水的温度可能有微小变化,由于温度计精度不够而未能测出。通过改进实验或其它实验方法(焦耳—汤姆孙实验),证实仅理想气体有上述结论。气体的内能仅是其温度的函数。这一结论称为焦耳定律(2)焦耳自由膨胀实验是非准静态过程。\n二.理想气体的摩尔热容CV、Cp和内能的计算1.定体摩尔热容CV和定压摩尔热容Cp定体摩尔热容CV••定压摩尔热容Cp1mol理想气体的状态方程为压强不变时,将状态方程两边对T求导,有\n迈耶公式比热容比2.理想气体内能的计算\n根据热力学第一定律,有解因为初、末两态是平衡态,所以有如图,一绝热密封容器,体积为V0,中间用隔板分成相等的两部分。左边盛有一定量的氧气,压强为p0,右边一半为真空。例求把中间隔板抽去后,达到新平衡时气体的压强绝热过程自由膨胀过程\n§11.6热力学第一定律对理想气体在典型准静态过程中的应用一.等体过程l不变l功吸收的热量内能的增量ⅠⅡ···SOVpV1等体过程中气体吸收的热量,全部用来增加它的内能,使其温度上升。\n二.等压过程功吸收的热量内能的增量在等压过程中理想气体吸收的热量,一部分用来对外作功,其余部分则用来增加其内能。SlⅠⅡ···p1OVpV1V2\n恒温热源Sl三.等温过程内能的增量功吸收的热量在等温膨胀过程中,理想气体吸收的热量全部用来对外作功,在等温压缩中,外界对气体所的功,都转化为气体向外界放出的热量。ⅠⅡS···OVpV1V2\n质量为2.8g,温度为300K,压强为1atm的氮气,等压膨胀到原来的2倍。氮气对外所作的功,内能的增量以及吸收的热量解例求根据等压过程方程,有因为是双原子气体