- 1.71 MB
- 2022-08-16 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
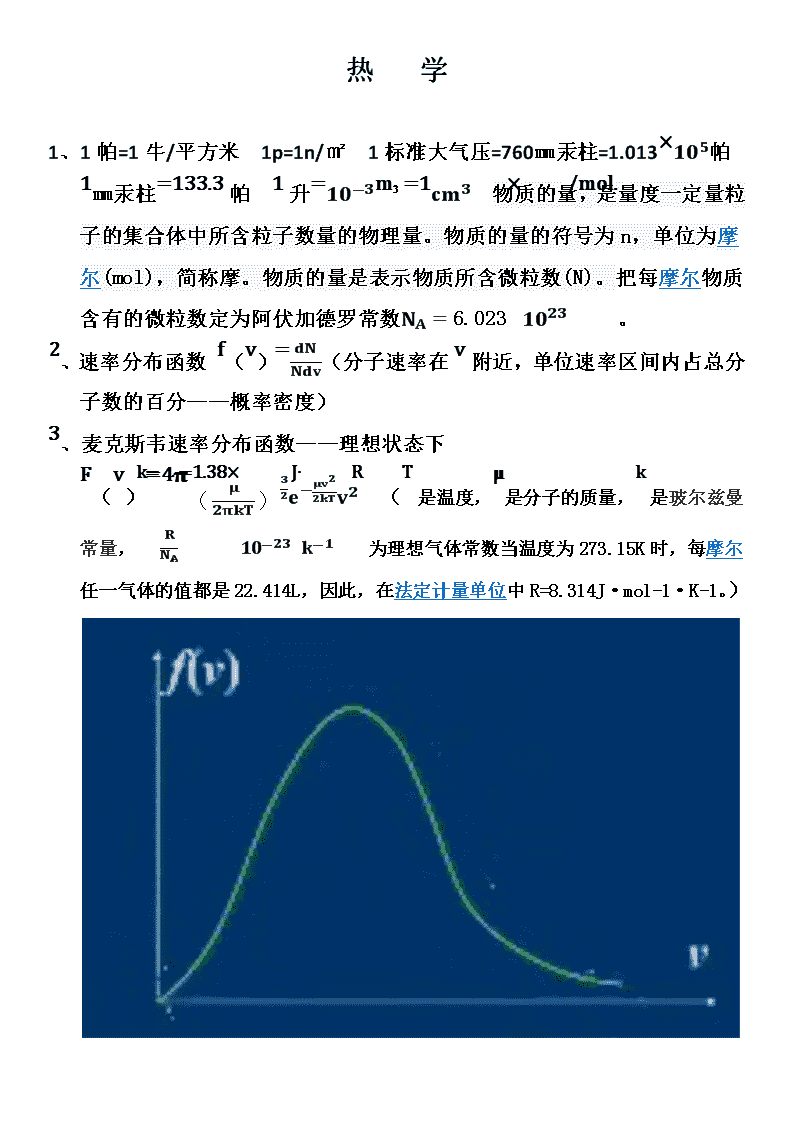
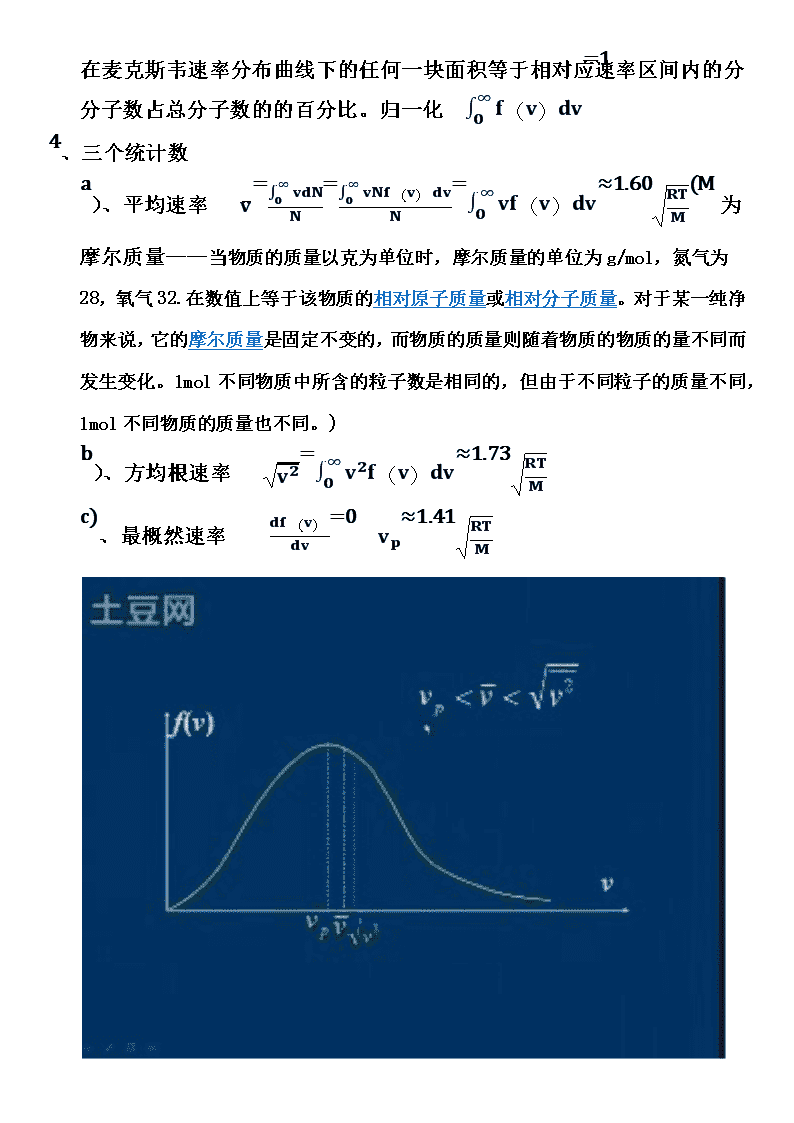
热学1、1帕=1牛/平方米1p=1n/㎡1标准大气压=760㎜汞柱=1.013×105帕1㎜汞柱=133.3帕1升=10-3m³=1cm3物质的量,是量度一定量粒子的集合体中所含粒子数量的物理量。物质的量的符号为n,单位为摩尔(mol),简称摩。物质的量是表示物质所含微粒数(N)。把每摩尔物质含有的微粒数定为阿伏加德罗常数NA=6.023×1023/mol.。2、速率分布函数f(v)=dNNdv(分子速率在v附近,单位速率区间内占总分子数的百分——概率密度)3、麦克斯韦速率分布函数——理想状态下F(v)=4?(μ2πkT)32e-μv22kTv2(T是温度,?是分子的质量,k是玻尔兹曼常量,k=RNA=1.38×10-23J∙k-1R为理想气体常数当温度为273.15K时,每摩尔任一气体的值都是22.414L,因此,在法定计量单位中R=8.314J·mol-1·K-1。)\n在麦克斯韦速率分布曲线下的任何一块面积等于相对应速率区间内的分分子数占总分子数的的百分比。归一化0∞f(v)dv=14、三个统计数a)、平均速率v=0∞vdNN=0∞vNf(v)dvN=0∞vf(v)dv≈1.60RTM(M为摩尔质量——当物质的质量以克为单位时,摩尔质量的单位为g/mol,氮气为28,氧气32.在数值上等于该物质的相对原子质量或相对分子质量。对于某一纯净物来说,它的摩尔质量是固定不变的,而物质的质量则随着物质的物质的量不同而发生变化。1mol不同物质中所含的粒子数是相同的,但由于不同粒子的质量不同,1mol不同物质的质量也不同。)b)、方均根速率v2=0∞v2f(v)dv≈1.73RTMc)、最概然速率df(v)dv=0vp≈1.41RTM\n5、速率在v1~v2之间的平均速率vv1~v2=v1v2vf(v)dvv1v2f(v)dv6、理想气体的微观模型自由的无规则运动的弹性质点群7、平衡态理想气体的几个假设a)、均匀分布b)、vx=vy=vzvx2=vy2=vz2=13v28、理想气体的压强公式压强等于单位时间内单位面积上器壁所受的平均冲量P=23nεlkεlk=12?v2(εlk分子平均平动动能,n单位体积内的分子数)9、理想气体的温度公式P=nkTεlk=32kT10、理想气体的温度是衡量气体平动动能的标志,是分子热运动激烈程度的标志。11、质点有三个自由度(x,y,z)刚体有六个自由度(质心三个——x,y,z转轴二个——?,?,?转动一个?定轴转动一个)12、气体分子的自由度平动自由度+转动自由度+振动自由度i=t+r+s单原子分子i=3刚性双原子分子i=3+2=5多原子分子613、能量均分定理分子的平均总动能εk=i2kT分子平均平动动能εlk=32kT每个自由度上的平均平动动能12?vx2=12?vy2=12?vz2=12kT每个转动和振动上的平均动能12kT14、理想气体的内能1molEmol=Nai2kT=i2RtE=mMi2Rt15、理想气体是温度的单值函数\n单原子分子E=mM32RT双原子分子E=mM52RT多原子分子E=mM62RTmM32RT质量为m气体的平均平动动能之和mMi2RT质量为m气体的内能16、热力学概率包含微观状态多的宏观状态出现的几率大。N各分子全部出现在A室的概率为W=12n。17、热力学概率Ω宏观状态下的微观状态数量。宏观态出现的概率W=每个微观态的概率×Ω。18、热力学第二定律在孤立系统中,自发进行的过程是不可逆的,总是沿着热力学概率增加的方向进行(无序性)。也就是宏观态中微观态数量小的向宏观态中微观态数量大的进行。19、波尔兹曼公式S=klnΩ(S为熵,表示气体的无序程度的量度。是系统状态的单值函数,与过程无关\n。是系统接近平衡态的量度,平衡态是熵值最大,最概然状态)20、孤立系统中自然发生的热力学过程总是向着熵增加的方向进行。21、描述热力学宏观态性质的物理量P、V、T、S、、E⋯⋯(可以直接测量)22、温度是A、B两个有联系的系统,达到热平衡时的一个共同的宏观量。23、热力学第零定律A和B平衡,B和C平衡,则A和B一定是平衡的。24、t(摄氏温标)=T(热力学温标)-273.1525、理想气体状态方程PV=mMRTPVT=常量(内能E=mMi2RT)1mol理想气体在标准状态(P0=1.013×105PaT0=273.15K)下V0=22.4×10-3m3∙mol-1R=8.31J∙mol-1∙k-126、准静态过程下气体对外界做的功dW=PdV=V1V2PdV\n功是一个过程量30、热量Q是一个过程量定压摩尔热容量CP=dQdTp(1mol气体温度升高一度所需的热量)定容摩尔热容量Cv=dQdTv31、热力学第一定律Q=(E2-E1)+W微小物质dQ=dE+dW(系统吸收热量Q>0,系统放热Q<0.系统对外界做工W>0,外界对系统做功W<0.)a)、等容过程过程方程PT=常量系统对外不做功dW=0dQ=dEQ=E2-E1dQV=mMCvdT∆E=mMCv(T2-T1)b)、等压过程\n过程方程VT=常量系统对外界做的功W=P(V2-V1)=mMR(T2-T1)dQp=mMCpdTQp=mMCp(T2-T1)∆E=mMCv(T2-T1)Cp>CvCp=Cv+R(迈耶公式)C)、等温过程过程方程PV=常量系统对外界做的功W=QPV=RTP=RTVW=V1V2mMRTVdv=mMRTlnv2v1=mMRTlnp1p2∆E=0QT=W\nd)、绝热过程过程方程PVγ=常量,TVγ-1=常量,Pγ-1T-γ=常量?=CpCv(泊松比)系统对外界做的功W=V1V2Pdv=P1V1γV1V21Vγdv=P1V1-P2V2γ-1Q=0∆E=-W32、循环过程内能增量为零,所做的功W=WAaB+WBbA(WAaB>0,WBbA<0)33、顺时针——正循环、热机循环(W净>0)逆时针——\n逆循环、制冷循环(W净<0)34、热机效率系统从高温热源吸收热量Q1,向低温热源放出热量的绝对值Q2,对外界做的净功W定义热机效率?=WQ1=1-Q2Q135、制冷系数系统从低温物体吸收热量Q2,向高温物体释放热量Q1,外界对系统做功W,-W=Q2-Q1?=Q2W=Q2Q1-Q236、卡诺循环AB、CD是两个等温过程。BC、DA是两个绝热过程Q1=mMRT1lnV2V1Q2=mMRT2lnV3V4?=1-Q2Q1=1-T2T1(提高效率的途径升高高温热源的温度)?=T2T1-T2任何一个循环都可以看做n个卡诺循环合成37、热力学第二定律开尔文表述:不能从单一热源吸收热量全部变成有用功,而不产生其它\n任何影响。克劳修斯表述:热量不能自动滴从低温物体传到高温物体。38、气体自由膨胀的过程是不可逆的。气体等温过程在准静态、无摩擦是可逆的,只有理想状态是可逆的。39、道尔顿气体分压定律某一气体在气体混合物中产生的分压等于在相同温度下它单独占有整个容器时所产生的压力;而气体混合物的总压强等于其中各气体分压之和。