- 1.07 MB
- 2022-08-16 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
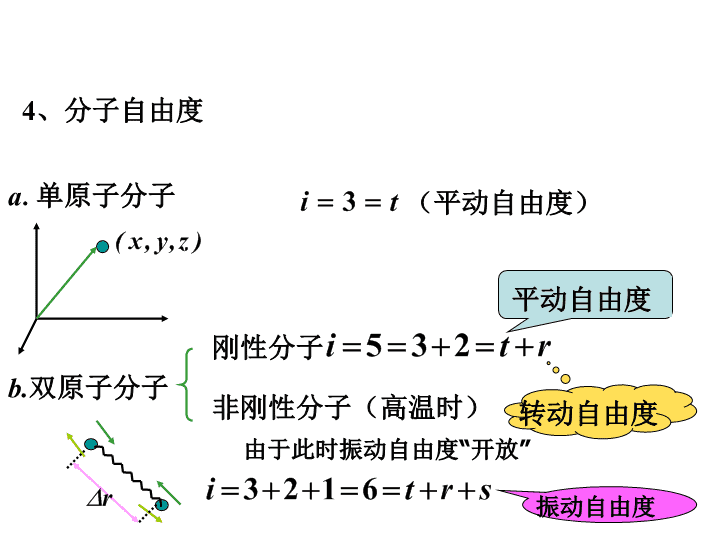
1.何为平衡态和状态参量?何为准静态过程和过程曲线?2.理想气体状态方程3.理想气体的压强和温度公式及各自的微观本质是什么?m:气体质量kg;M:摩尔质量kg/molV:体积(m3、L)R:气体普适恒量(8.31J/mol·K)1L=10-3m3p:气体压强N/m2(Pa)——气体摩尔数\n例:某种气体,则气体质量密度ρ=?由由于所以例.在容积为10-2m3的容器中,装有100g气体,若气体分子的方均根速率为200m/s,则气体的压强为\na.单原子分子(平动自由度)b.双原子分子刚性分子6个自由度?平动自由度转动自由度非刚性分子(高温时)由于此时振动自由度“开放”振动自由度4、分子自由度\n5.能量按自由度均分原理分子的每个自由度上都有的平均动能平均一个分子的总动能振动学证明:谐振动在一个周期内的平均振动势能和平均振动动能相等对具有个振动自由度的分子7.平均一个分子的总能量应为:对具有一个振动自由度的分子6.一个分子平均振动势能为多少?\n例:单原子分子气体He,Ne,Ar…双原子分子气体H2,O2,N2…常温及以下高温时(振动自由度开放)8.理想气体内能与摩尔内能\n例:在容积为2.010-3m3的容器中有内能为6.75102J刚性双原子分子理想气体。(1)求压强;(2)分子总数为5.41022个,求分子平均平动动能和气体的温度\n练习水蒸气分解为同温度的氢气和氧气,即H2OH2+O2/2,也就是1mol的水蒸气可分解为同温度的1mol氢气和1/2mol氧气,不计振动自由度,求此过程中内能的增量。\n9.10.气体分子速率分布函数的物理意义2°对每个分子而言,速率出现在v附近单位速率间隔内的概率1°分子速率在v附近、单位速率间隔内的分子数dNv占总分子数的比\n例:简要说明下列各式的物理意义:m—气体的质量,M—该气体的摩尔质量分子一个自由度上的平均动能或平均振动势能分子的平均平动动能或单原子分子的平均能量分子的平均总动能一摩尔刚性分子理想气体的内能ν摩尔刚性分子理想气体的内能ν摩尔单原子分子理想气体的内能ν摩尔理想气体的内能,且为振动自由度开放\n[回答问题](1)气体中一个分子的速率在v~v+Δv间隔内的概率为多少?(2)一个分子具有最概然速率的概率为多少?(3)气体中所有分子在某一瞬间速率的平均值是,则一个分子在较长时间内的平均速率应如何考虑?(4)伽尔顿板实验说明什么\n例:导体中自由电子的运动可看做类似气体分子运动。故常称导体中的电子为电子气。设导体中有N个自由电子,电子的最大速率vF.电子的速率出现在v—v+dv内的概率为:其中为恒量1)写出电子气中电子的速率分布函数2)求常数A由归一化条件\n3)画速率分布曲线4)求电子的平均速率及速率倒数的平均值\n5)求电子的平均动能(设电子质量为m)所以注意:前面已得出显然6)求内的电子数用到\n练习:图为分子数为N的理想气体,在温度为和(T1T2)时的速率分布曲线,设两曲线交点的速率为v0。若阴影部分的面积为S,则在两种温度下气体分子运动速率小于v0的分子数之差为多少?由于曲线下的面积值为1,所以有两种温度下气体分子速率小于的分子数之差为\noa0v02voa0v02v练习二:有N个质量均为mf的同种气体分子,速率分布如图。(1)说明曲线与横坐标所围面积的意义;(2)由N和v0表示出a的值;(3)速率在v0/2——3v0/2之间的分子数(4)分子的平均平动动能\n11.对任意一个关于分子速率v的函数g(v),其统计平均值12.分子平均碰撞平率和平均自由程13.常见有哪三种输运过程?从微观来说气体内的热传导是分子热运动能量的输运所形成的气体内摩擦现象是气体内部分子定向动量的输运所形成气体内的扩散是分子热运动过程中质量的输运所形成的若积分是对0—的速率求积分则分母的值为1\n——速率在v—v+dv间隔内的分子数占总分子数的比——速率在v1—v2间隔内的分子数占总分子数的比——速率在v1—v2间隔内的分子数——速率在v1—v2间隔内的分子的平均速率14.下列各式物理意义?——速率在v附近单位速率间隔内的分子数占总分子数的比,或:对每一个分子而言,速率出现在v附近单位速率间隔内的概率\n15.热力学第一定律E—系统的内能规定:Q—系统从外界吸收的热量A—系统对外所做的功功的表达式热量的表达式\n16.热容量的定义理想气体的i=t+r+s自由度?均为系统吸收的热量热容量定义式中的dQ定义为定压mol热容量为定容mol热容量\n迈尔公式对单原子分子气体对刚性双原子分子气体对非刚性双原子分子气体对刚性多原子分子气体\n绝热线等温线例:理想气体经历12;1’2;1’’2时热容量的正负如何?\n(1)bca为理想气体绝热过程,b1a和b2a是任意过程,则上述两过程中气体做功与吸收热量的情况是此题答案有问题b1a过程()热,做()功;b2a过程()热,做()功(1)设正循环过程b1acb设逆循环过程b2acbpVoab1c2pVoab1c2pVoab1c2ab1cabcabc2abc2abc2\n(2)一定量的理想气体,由平衡态A变化到B,且它们的压强相等,则在A和B之间,气体无论经过的是什么过程,气体必然()(A)对外做正功(B)内能增加(C)从外界吸热(D)向外界放热真空pVoABpVoABpVoAB为什么其他的答案不对?....我们来找一个例子该题的目的:强调热量Q和功A——过程量内能增量与过程无关QAC=0,AAC=0\n17.理想气体几个准静态等值过程中的Q,A,ΔE18.对任意正循环的热机,定义热机的工作效率η定义为放热对逆循环热机定义致冷系数——ω为从低温热源吸收的热量为向高温热源放出的热量理想气体做卡诺循环的效率等温、等容、等压、绝热等温热量的表达式第一定律\n例:一定量的某单原子分子理想气体装在封闭的汽缸里,此汽缸有可活动的活塞(活塞与汽缸壁之间无摩擦且无漏气)。已知气体的初压强p1=1.013105Pa、体积V1=1.00L,现将该气体在等压下加热直到体积为原来的两倍,然后在等容下加热到压强为原来的两倍,最后作绝热膨胀,直到温度下降到初温为止。求(1)在p-V图上将整个过程表示出来;(2)整个过程中气体内能的变化;(3)整个过程中气体所作的功;(4)整个过程中气体吸收的热量(1)(2)(3)由热力学第一定律整个过程中的吸热与作功Q=A等压过程中等容过程中绝热过程中(4)\n例.一卡诺循环的热机,高温热源的温度是400K,每一循环从此热源吸收100J热量并向一低温热源放出80J热量。求(1)低温热源的温度;(2)这循环的热机效率。高温T1低温T2从温度为Ti的热源吸收的热量\n19.热力学第二定律的两种表述热二的实质?微小的可逆过程积分沿1,2态间任一可逆过程曲线20.熵的定义:21.熵增原理?22.求理想气体在以下过程中的熵变[2]向真空自由膨胀过程[3]等温膨胀过程[4]等压过程[5]等容过程[1]1mol理想气体从经某一过程达到积分值即熵变与选取的可逆积分路程(过程)有关吗?