- 3.36 MB
- 2022-08-16 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
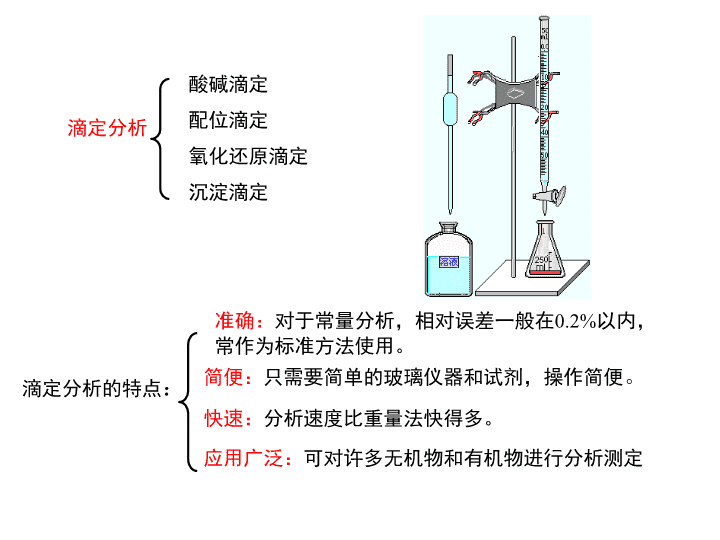
第十七章滴定分析——酸碱滴定法17-1滴定分析法概论:一、滴定分析过程和方法分类滴定分析(titrationanalysis):将一种已知准确浓度的试剂溶液(标准溶液),滴加到被测物质的溶液中(或者是被测物质的溶液滴加到标准溶液中),直到所加的试剂与被测物质按照化学计量关系定量反应为止,然后根据试剂溶液的浓度和用量,计算被测物质的含量。由于被测物是通过测定标准滴定溶液的体积进行测定的,又叫容量分析(volumetricanalysis)。化学计量点(stoichiometricpoint,sp):当滴加的滴定剂的量与被测滴定物的物质的量正好符合滴定反应式中的化学计量关系式时的点——理论终点。滴定终点(titrationendpoint,ep):在滴定中指示剂改变颜色的那个点。\n滴定分析酸碱滴定配位滴定氧化还原滴定沉淀滴定滴定分析的特点:准确:对于常量分析,相对误差一般在0.2%以内,常作为标准方法使用。简便:只需要简单的玻璃仪器和试剂,操作简便。快速:分析速度比重量法快得多。应用广泛:可对许多无机物和有机物进行分析测定\n二、滴定分析对化学反应的要求和滴定方式1)要求:●反应必须根据一定的反应式按化学计量关系定量进行,其反应的完全程度通常要求达到99.9%.●反应迅速,不能在瞬间完成的反应不适合于作滴定分析。对于某些反应速率慢的反应,有时可采取适当的措施(加热、加催化剂等)来加快反应速率。●必须有适当的简便方法指示滴定终点。●有适当方法消除干扰。\n2)滴定方式直接滴定(directtitration):凡是满足滴定反应要求的反应都可以用直接滴定。返滴定(backtitration)或剩余滴定法(俗称回滴):对一些慢反应或滴定剂直接滴定固体试样。1)Al3+与EDTA的反应慢,加入过量的EDTA,然后用Zn2+或Cu2+返滴定EDTA。2)HCl溶液滴定固体CaCO3,反应慢,加入过量的HCl,然后用NaOH返滴定HCl。3)用AgNO3滴定Cl-,缺乏合适的指示剂。可加入过量的AgNO3,然后用NH4SCN返滴定Ag+,用Fe+3作指示剂。AgSCN(白色沉淀)[Fe(SCN)]2+血红色\n间接滴定(indirectiontitration):某些被测物质不能直接与滴定剂反应,可通过适当的化学反应将其转化为可直接滴定的物质,用间接方法进行滴定。NaS2O3不能直接被K2Cr2O7等一些强氧化剂滴定NaS2O3S4O62-+SO42-2Na2S2O3+I2=Na2S4O6+2NaICr2O72-+2I-+14H+=2Cr3++I2+7H2O置换滴定(replacementtitration):某些滴定剂与被测物的反应伴有副反应,不遵循一定的化学计量关系式,或者有的反应缺乏适当的指示剂。可用置换滴定,即先用某种试剂与被测物反应,定量生成另一种可以直接滴定的物质,然后进行滴定。Ca2+不能用KMnO4溶液直接滴定Ca2+CaC2O4+H2SO4C2O42-6H++2MnO4-+5C2O42-=2Mn2++10CO2+8H2O\n三、标准滴定溶液和基准物质标准溶液:已知其准确浓度,用于滴定分析的溶液,用物质的量浓度(mol/L)表示,常量分析中一般要求有4位有效数字。基准溶液:能够直接配制,获得其准确浓度的溶液。基准物质:能用来配制基准溶液的物质。基准物质必须满足的要求:●组成与化学式完全相符,有结晶水的物质,其结晶水的含量也应与化学式相符。●纯度高,其质量份数不低于99.9%。●化学性质稳定,不分解、不吸潮、不吸收空气中的CO2,不失结晶水。●满足滴定分析对反应的各项要求,不发生副反应。●摩尔质量相对较大,以减少称量的相对误差。标准溶液可直接配制和间接配制:当欲配制标准溶液的试剂不是基准物质时,要用间接法(标定法)配制。\n\n17-2酸碱滴定酸碱滴定法:以酸碱反应为基础的滴定分析法。一、弱酸(碱)溶液中各物种的分布分布份数:溶液中某酸碱组分的平衡浓度占其总浓度的分数,用表示。1)一元弱酸(碱)溶液HAc(c)(总分析浓度)HAc[HAc]Ac-[Ac-]c=[HAc]+[Ac-]\n\n2)多元弱酸溶液H2A(c)(总分析浓度)H2A[H2A];HA-[HA-];A2-[A2-]c=[H2A]+[HA-]+[A2-]\n\n\n\n二、质子条件与pH的计算平衡溶液H+浓度(pH)的计算的依据有:物料平衡式(massormaterialbalanceequation,MBE),电荷平衡式(chargebalanceequation,CBE),质子平衡式(protonbalanceequation,PBE)。1)物料平衡式(MBE)HAc(c)(总分析浓度)HAc[HAc]Ac-[Ac-]c=[HAc]+[Ac-]Na2CO3(c)Na2CO32Na++CO32-CO32-+H2OHCO3-+OH-HCO3-+H2OH2CO3+OH-对于Na+2c=[Na+]对于CO32-有关的组分:c=[CO32-]+[HCO3-]+[H2CO3]\n1)物料平衡式(MBE)H3PO4(c)(总分析浓度)H3PO4;H2PO42-;HPO42-;PO43-c=[H3PO4]+[H2PO42-]+[HPO42-]+[PO43-]HgCl2cmol/LHgCl2HgCl++Cl-HgCl+Hg2++Cl-HgCl2+Cl-HgCl3-HgCl3-+Cl-HgCl42-Hg2++H2OHgOH++H+HgOH++H2OHg(OH)2+H+Hg:c=[Hg2+]+[HgCl+]+[HgCl2]+[HgCl3-]+[HgCl42-]+[HgOH+]+[Hg(OH)2]Cl:2c=[HgCl+]+2[HgCl2]+3[HgCl3-]+4[HgCl42-]+[Cl-]\n2电荷平衡(CBE)HCl(c)(总分析浓度)HClH++Cl-H2OH++OH-[H+]=[Cl-]+[OH-][H+]=c+[OH-]NaClNa++Cl-cmol/LH2OH++OH-[Na+]+[H+]=[Cl-]+[OH-]c+[H+]=c+[OH-][H+]=[OH-]Na2CO3cmol/LNa2CO32Na++CO32-CO32-+H2OHCO3-+OH-HCO3-+H2OH2CO3+OH-H2OH++OH-[H+]+[Na+]=[OH-]+[HCO3-]+2[CO32-][H+]+2c=[OH-]+[HCO3-]+2[CO32-]\n3质子条件(PBE)由物料平衡和电荷平衡得到质子条件NaCNcmol/LNaCNNa++CN-CN-+H2O=HCNH2OH++OH-MBE:c=[Na+]c=[CN-]+[HCN]CBE:[H+]+[Na+]=[OH-]+[CN-][H+]+c=[OH-]+{c–[HCN]}PBE:[H+]=[OH-]–[HCN]\nH3PO4cmol/LH3PO4H++H2PO4-H2PO4-H++HPO42-HPO42-H++PO43-H2OH++OH-MBE:c=[H3PO4]+[H2PO42-]+[HPO42-]+[PO43-]CBE:[H+]=[OH-]+[H2PO4-]+2[HPO42-]+3[PO43-]PBE:[H+]=[OH-]+[H2PO4-]+2[HPO42-]+3[PO43-]二、从溶液中各组分得失质子的关系列出质子条件:确定零水准点:大量存在于溶液中,并参与质子转移的物质为零水准点。H2CO3HCO3-CO32--H++H+H3O+H2OOH--H++H+[H2CO3]+[H+]=[CO32-]+[OH-][H+]=[CO32-]+[OH-]–[H2CO3]\nH2C2O4HC2O4--H+H3O+H2OOH--H++H+H2C2O4C2O42--2H+[H+]=[HC2O4-]+2[C2O42-]+[OH-]例17-6:写出含有浓度为c1的HAc和浓度为c2的NaAc水溶液的质子条件。HAcAc--H+H3O+H2OOH--H++H+[H+]=[Ac-]´+[OH-][H+]=[Ac-]–c2+[OH-]HAcAc-+H+H3O+H2OOH--H++H+[HAc]´+[H+]=[OH-][HAc]–c1+[H+]=[OH-][H+]=c1+[OH-]–[HAc][HAc]+[Ac-]=c1+c2\nHAcc1NaAcc2Na+,H+,OH-,Ac-[Na+]+[H+]=[OH-]+[Ac-]c2+[H+]=[OH-]+[Ac-][H+]=[OH-]+[Ac-]-c2\npH的计算1)强酸强碱溶液HB(总分析浓度为cmol/L)HB=H++B-H2OH++OH-[H+]=[B-]+[OH-][H+]=c+[OH-][H+]=c+Kw/[H+][H+]2-c[H+]–Kw=0(精确式)如果c2>20Kw,[OH-]可以忽略。[H+]=c(最简式)\npH的计算2)一元弱酸(碱)溶液HA(cmol/L)HA=H++A-H2OH++OH-[H+]=[A-]+[OH-]精确式当Ka[HA]20Kw可以忽略Kw近似式当[H+]<500,可进一步简化为:\npH的计算4)两性物质溶液NaHA(cmol/L)如:NaHCO3PBE:[Na+]+[H+]=[HCO3-]+2[CO32-]+[OH-][H+]+[H2CO3]=[CO32-]+[OH-]精确式若Ka1>>Ka2,可认为[HA-]c,同时若Ka2c20Kw,Kw可略去。近似式再若c/Ka1>20,最简式\npH的计算5)弱酸及其共轭碱溶液HA(c1mol/L)+NaA(c2mol/L)物料平衡:c1+c2=[HA]+[A-]用电荷平衡推导PBE得:[H+]+[Na+]=[A-]+[OH-][H+]+c2=[A-]+[OH-]一元三次方程(精确式)若酸性,[H+]>>[OH-]\n若碱性,[OH-]>>[H+]若共轭酸、碱浓度较大时,c1>>[OH-]–[H+],c2>>[H+]–[OH-]最简式缓冲溶液pH计算公式6)混合酸溶液●强酸+弱酸HCl(c1)+HAc(c2)用电荷平衡推导PBE得:[H+]=[OH-]+[Cl-]+[Ac-][H+][Cl-]+[Ac-]\n[H+]c1+[Ac-]考虑H+的同离子效应,求解[Ac-]HAc=H++Ac-起始c2c10平衡:c2-x[H+]x当c1>>[Ac-],可简化为[H+]=c1\n●弱酸+弱酸HA(c1)+HB(c2)用电荷平衡推导PBE得:[H+]=[OH-]+[A-]+[B-][H+][A-]+[B-]当HA、HB的离解度都很小时,[HA]=c1,[HB]=c2HA=H++A-\n三、缓冲溶液(buffersolution)缓冲溶液:缓冲容量(buffercapacity):溶液的pH改变一个单位所需强酸或强碱的量,用表示。物理意义:相关酸、碱组分分布曲线的斜率。以HA-A-缓冲体系为例:\n标准缓冲溶液:准确知道其pH的缓冲溶液,其数值由准确的实验测得,用来作为测定溶液pH时的参考,如校正pH计。表19-2和19-3\n\n标准缓冲溶液pH(25℃时的标准值)饱和酒石酸氢钾(0.034mol/L)0.05mol/L邻苯二甲酸氢钾0.025mol/LKH2PO4+0.025mol/LNa2HPO40.01mol/L硼砂饱和氢氧化钙3.5574.0086.8659.18012.454几种常见的标准缓冲溶液\n四、酸碱指示剂1)酸碱指示剂的工作原理酸碱指示剂:酸碱指示剂一般是一些有机弱酸或弱碱,它们的酸式结构和碱式结构具有不同的颜色,当pH改变时,其颜色发生变化,可用其颜色的变化来指示酸碱滴定的终点。OH-H+红色,醌式黄色,偶氮式pKa=3.4甲基橙MO\n四、酸碱指示剂2)酸碱指示剂的变色范围HIn(酸式结构)In-(碱式结构)HInH++In-指示剂的离解常数,或指示剂常数呈酸式颜色呈碱式颜色在10-1/10之间,pH=pKHIn1,呈混合色。\n当[In-]=[HIn]时,[H+]=KHInpH=pKIn指示剂的理论变色点pH=pKHIn1,理论变色范围由于人眼对不同颜色的敏感程度不同,加上两种颜色的互相影响,实际观察到的指示剂的变色范围与理论值有区别。表19-4(p351)\n\n\n甲基橙甲基红酚酞TP\n混合指示剂:利用两种染料之间的颜色互补,使颜色改变敏感,变色范围变窄。两种或两种以上的指示剂一种指示剂+惰性染料混合指示剂分两类:互补色:按照一定比例混合后能够得到白光的那两种光叫互补光,互补光的颜色叫互补色。溴甲酚绿:pK=4.9,变色范围为3.8-5.4黄蓝甲基红:pK=5.2,变色范围为4.4-6.2红黄5.13.85.44.46.24.95.2黄+红=紫红色蓝+黄=蓝绿色蓝绿+紫红色\n五、酸碱滴定的滴定曲线及指示剂的选择1)强碱滴定强酸H++OH-=H2O0.1000mol/L的NaOH滴定20mL0.1000mol/L的HCl,计算滴定过程中H+的浓度。当加入的NaOH为20mL时,达到化学计量点。计量点后:化学计量点前:\n加入NaOHV/mLHCl被中和的百分数%剩余HCl体积/mL过量NaOH/mLpH0.1000mol/L的NaOH滴定20.00mL0.1000mol/L的HCl0.0100mol/L的NaOH滴定20.00mL0.0100mol/L的HCl0.0010.0018.0019.8019.9619.9820.0020.0220.0420.2022.0030.0040.000.0050.0090.0099.0099.8099.90100.00100.10100.20101.00110.00150.00200.0020.0010.002.000.200.040.020.000.020.040.202.0010.0020.001.001.482.283.304.004.317.009.7010.0010.7011.6812.3012.522.002.483.284.305.005.307.008.709.009.7010.6811.3011.52pH=5.39pH=3.4\n9.74.38.0-9.84.4-6.23.3-4.4\n五、酸碱滴定的滴定曲线及指示剂的选择2)强碱滴定弱酸OH-+HB=B-+H2O0.1000mol/L的NaOH滴定20mL0.1000mol/L的HAc,计算滴定过程中H+的浓度。滴定前:满足Kac>20Kw,c/Ka>500,用最简式:pH=2.87当滴定到化学计量点前:(缓冲体系)(考虑体积变化)若加入19.98mLNaOH,pH=7.76\n化学计量点时,全部生成NaAc,浓度为0.05000mol/L,Ac-可看成是弱碱,满足条件:Kb>20Kw,c(盐)/Kb>500。pH=8.72化学计量点后,NaAc为弱碱,NaOH过量,pH由过量的NaOH决定。若加入20.2mLNaOH。计量点后:pH=9.70\n加入NaOHV/mLHAc被中和的百分数%剩余HCl体积/mL过量NaOH/mLpH0.1000mol/L的NaOH滴定20.00mL0.1000mol/L的HAcpKa=4.760.0100mol/L的NaOH滴定20.00mL0.0100mol/L的HApKa=7.00.0010.0018.0019.8019.9820.0020.0220.2022.0040.000.0050.0090.0099.0099.90100.00100.10101.00110.00200.0020.0010.002.000.200.020.000.020.202.0020.002.884.765.716.767.768.739.7010.7011.6812.524.007.007.959.009.709.8510.0010.1411.6812.52pH=1.94pH=0.30\n强碱滴定0.1mol/L各种强度酸的滴定曲线HAc强酸滴定各种强度的弱碱因为人眼对指示剂变色的判断至少有0.2个pH单位的不确定性(终点观察误差),即使在指示剂理论变色点与化学计量点完全一致的情况下,为使滴定终点与化学计量点只相差0.2个pH单位,则要求突越范围至少有0.4个pH单位。\nKac10-80.140.421.04pH0.140.421.082.00pH0.140.421.062.003.00pH8.43-9.578.79-9.218.00-9.04突变范围0.01mol/L10.43-10.579.79-10.218.96-10.048.00-10.00突变范围0.1mol/L11.43-11.5710.79-11.219.96-11.029.00-11.008.00-11.0突变范围1.0mol/L98765pKa浓度强碱滴定弱酸的突变范围随弱酸浓度和强度的变化\n如果要求测量误差不大于0.2%,则要求Kac10-8。也就是说,Kac<10-8,用目测法不可能得到准确的测量结果。Kac10-8是判断一元弱酸能否被强碱直接准确滴定的判据。Kbc10-8是判断一元弱碱能否被强酸直接准确滴定的判据。\n有的弱酸不满足Kac10-8。不能直接滴定,但可以采用其它方法滴定。如:1)H3BO3(Ka1=5.810-10)甘露醇甘露醇酸pKa=4.262)利用沉淀反应使弱酸强化H3PO4只能作为二元酸进行直接滴定,HPO42-不能直接滴定。3Ca2++2HPO42-=Ca3(PO4)2(s)+2H+置换出H+,用NaOH滴定\n3)使弱酸(碱)转化为共轭碱(酸)后滴定。如:极弱酸NH4Cl,极弱碱NaF的滴定。R-SO3H++NaF=R-SO3Na++HFHF可以用NaOH直接滴定。三、多元酸碱的滴定多元酸有多个Ka,哪一步满足Kac10-8,哪一步的H+就有可能直接准确滴定。若相邻两个H+都满足要求,则要求它们的Ka之比大于104,可以分步准确滴定。H2A=H++HA-HA-=H++A2-\n如:H2C2O4Ka1=5.610-2Ka2=5.110-5Ka1/Ka2=1.1103<104Ka1c=c5.610-210-8Ka2c=c5.110-510-8不能分步滴定H3PO4和H2PO4-可直接滴定,而且可分步滴定,HPO42-不能直接滴定。H3PO4Ka1=6.910-3Ka2=6.210-8Ka3=4.810-13Ka1/Ka2=1105假如:0.1000mol/LNaOH滴定0.1000mol/LH3PO4第一计量点:产物是H2PO4-,浓度为0.05000mol/L。H3PO4+OH-=H2PO4-+H2ONa2CO3?H2CO3Ka1=4.310-7Ka2=5.610-11Kb1=1.810-4Kb2=2.310-8\nH2PO4-,为两性物质溶液,满足:Ka1与Ka2相差较大,且Ka2c>>20Kw,pH=4.71,H3PO4+2OH-=HPO42-+2H2O因为Ka3c=0.03310-13=7.2610-14Kw,不满足Ka3c>>20Kw,精确式pH=9.66,第二计量点:产物是HPO42-,浓度为0.03300mol/L。H2PO4-+OH-=HPO42-+H2O甲基红(4.4-6.2)或溴甲酚绿(3.8-5.4)作指示剂(哪个好?)酚酞(8.0-9.8)或百里酚酞(9.4-10.6)作指示剂(哪个好?)\nNaOH滴定H3PO4的滴定曲线4.4-6.28.0-9.84.719.66\n六、酸碱滴定法的应用(一)酸碱标定:HCl的标定Na2CO3Na2B4O710H2ONaOH的标定H2C2O42H2OKHC8H4O4(邻苯二甲酸氢钾)(二)混合碱的分析:混合碱:NaOH+Na2CO3的混合物NaHCO3+Na2CO3的混合物\n双指示剂法:NaOH+Na2CO3的混合物HClV1NaOHNa2CO3酚酞红色消失8.0-9.8NaCl(pH=7.0)NaHCO3(pH8.3)HClV2H2CO3pH3.89甲基橙变成橙红色3.1-4.4Na2CO3可分步滴定Na2CO3中和到NaHCO3和NaHCO3中和到NaCl所需HCl体积相同,因此,中和NaOH所需HCl体积为V1-V2。Na2CO3+HCl=NaHCO3+NaClNaHCO3+HCl=NaCl+CO2+H2O\nb)BaCO3沉淀法:NaOH+Na2CO3的混合物HClV1NaOHNa2CO3甲基橙变成橙红色3.1-4.4NaOHNa2CO3BaCl2NaOHBaCO3HClV2酚酞红色消失8.0-9.8V1-V2为与Na2CO3反应消耗HCl的量。Na2CO3+2HCl=2NaCl+CO2+H2O滴定中BaCO3能被HCl溶解吗?如何判断?