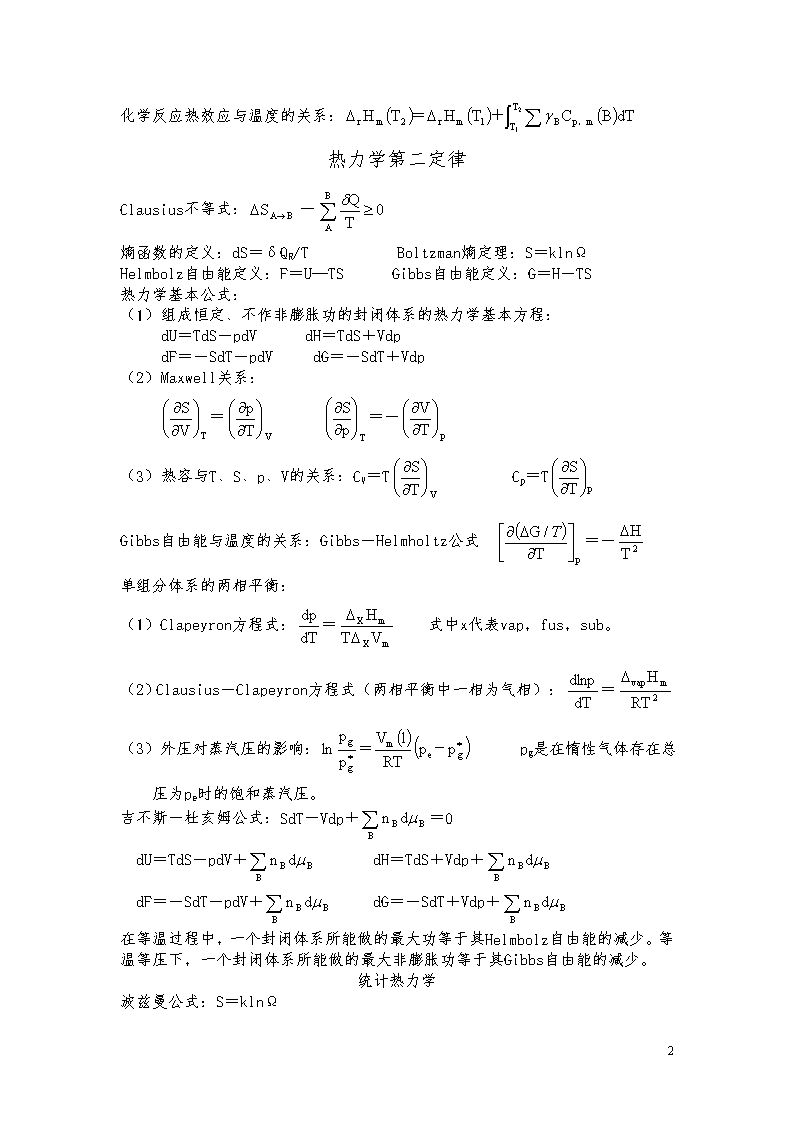- 701.50 KB
- 2022-08-16 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
大学化学公式热力学第一定律功:δW=δWe+δWf(1)膨胀功δWe=p外dV膨胀功为正,压缩功为负。(2)非膨胀功δWf=xdy非膨胀功为广义力乘以广义位移。如δW(机械功)=fdL,δW(电功)=EdQ,δW(表面功)=rdA。热Q:体系吸热为正,放热为负。热力学第一定律:△U=Q—W焓H=U+pV理想气体的内能和焓只是温度的单值函数。热容C=δQ/dT(1)等压热容:Cp=δQp/dT=(∂H/∂T)p(2)等容热容:Cv=δQv/dT=(∂U/∂T)v常温下单原子分子:Cv,m=Cv,mt=3R/2常温下双原子分子:Cv,m=Cv,mt+Cv,mr=5R/2等压热容与等容热容之差:(1)任意体系Cp—Cv=[p+(∂U/∂V)T](∂V/∂T)p(2)理想气体Cp—Cv=nR理想气体绝热可逆过程方程:pVγ=常数TVγ-1=常数p1-γTγ=常数γ=Cp/Cv理想气体绝热功:W=Cv(T1—T2)=(p1V1—p2V2)理想气体多方可逆过程:W=(T1—T2)热机效率:η=冷冻系数:β=-Q1/W可逆制冷机冷冻系数:β=焦汤系数:μJ-T==-实际气体的ΔH和ΔU:ΔU=+ΔH=+化学反应的等压热效应与等容热效应的关系:Qp=QV+ΔnRT当反应进度ξ=1mol时,ΔrHm=ΔrUm+RT13\n化学反应热效应与温度的关系:热力学第二定律Clausius不等式:熵函数的定义:dS=δQR/TBoltzman熵定理:S=klnΩHelmbolz自由能定义:F=U—TSGibbs自由能定义:G=H-TS热力学基本公式:(1)组成恒定、不作非膨胀功的封闭体系的热力学基本方程:dU=TdS-pdVdH=TdS+VdpdF=-SdT-pdVdG=-SdT+Vdp(2)Maxwell关系:==-(3)热容与T、S、p、V的关系:CV=TCp=TGibbs自由能与温度的关系:Gibbs-Helmholtz公式=-单组分体系的两相平衡:(1)Clapeyron方程式:=式中x代表vap,fus,sub。(2)Clausius-Clapeyron方程式(两相平衡中一相为气相):=(3)外压对蒸汽压的影响:pg是在惰性气体存在总压为pe时的饱和蒸汽压。吉不斯-杜亥姆公式:SdT-Vdp+=0dU=TdS-pdV+dH=TdS+Vdp+dF=-SdT-pdV+dG=-SdT+Vdp+在等温过程中,一个封闭体系所能做的最大功等于其Helmbolz自由能的减少。等温等压下,一个封闭体系所能做的最大非膨胀功等于其Gibbs自由能的减少。统计热力学波兹曼公式:S=klnΩ13\n一种分布的微观状态数:定位体系:ti=N!非定位体系:ti=波兹曼分布:=在A、B两个能级上粒子数之比:=波色-爱因斯坦统计:Ni=费米-狄拉克统计:Ni=分子配分函数定义:q=-i为能级能量q=-i为量子态能量分子配分函数的分离:q=qnqeqtqrqv能级能量公式:平动:εt=转动:εr=振动:εv=一些基本过程的ΔS、ΔG、ΔF的运算公式(Wf=0)基本过程ΔSΔGΔF理想气体等温可逆过程ΔFT=-WR=-任意物质等压过程ΔH-Δ(TS)ΔU-Δ(TS)任意物质等容过程ΔH-Δ(TS)ΔU-Δ(TS)理想气体绝热可逆过程0ΔH-SΔTΔU-SΔT13\n理想气体从p1V1T1到p2V2T2的过程1)2)3)ΔH-Δ(ST)ΔU-Δ(ST)等温等压可逆相变0-WR等温等压化学反应ΔrGm=ΔrHm-TΔrSmΔrGm=-RTln+RTlnQpΔU-TΔS一些基本过程的W、Q、ΔU、ΔH的运算公式(Wf=0)过程WQΔUΔH理想气体自由膨胀0000理想气体等温可逆00等容可逆任意物质理想气体00QVΔU+VΔp等压可逆任意物质理想气体p外ΔVp外ΔVQp-pΔVQp理想气体绝热过程CV(T1-T2)0理想气体多方可逆过程pVγ=常数ΔU+W可逆相变(等温等压)p外ΔVQpQp-WQp(相变热)13\n化学反应(等温等压)p外ΔVQpQp-WΔrUm=ΔrHm-QpΔrHm=溶液-多组分体系体系热力学在溶液中的应用溶液组成的表示法:(1)物质的量分数:(2)质量摩尔浓度:(3)物质的量浓度:(4)质量浓度拉乌尔定律亨利定律:化学势的各种表示式和某些符号的物理意义:气体:(1)纯理想气体的化学势标准态:任意温度,p=pφ=101325Pa。μφ(T)为标准态时的化学势(2)纯实际气体的化学势标准态:任意温度,f=pφ且复合理想气体行为的假想态(即p=pφ,γ=1),μφ(T)为标准态时的化学势。(1)混合理想气体中组分B的化学势因为所以不是标准态时的化学势,是纯B气体在指定T、p时的化学势。溶液:(1)理想溶液组分的化学势所以不是标准态时的化学势而是温度为T、溶液上方总压为p时,纯液体B的化学势。(2)稀溶液中各组分的化学势溶剂:不是标准态时的化学势而是温度为T、溶液上方总压为p时,纯溶剂A的化学势。溶质:13\n,,均不是标准态时的化学势,均是T,p的函数,它们分别为:当xB=1,mB=1molkg-1,cB=1moldm-3时且服从亨利定律的那个假想态的化学势。(1)非理想溶液中各组分的化学势溶剂:不是标准态的化学势,而是aA,x=1即xA=1,γA=1的纯组分A的化学势。溶质:,,均不是标准态时的化学势,均是T,p的函数,它们分别为:当aB,x=1,aB,m=1,aB,c=1时且服从亨利定律的那个假想态的化学势。(4)活度a的求算公式:ü蒸汽压法:溶剂aA=γAxA=pA/pA*溶质:aB=γBxB=pA/kcü凝固点下降法:溶剂üGibbs-Duhem公式从溶质(剂)的活度求溶剂(质)的活度。(5)理想溶液与非理想溶液性质:理想溶液:非理想溶液:超额函数:溶液热力学中的重要公式:(1)Gibbs-Duhem公式(2)Duhem-Margule公式:对二组分体系:13\n稀溶液依数性:(1)凝固点降低:(2)沸点升高:(3)渗透压:化平衡学化学反应亲和势:A=-化学反应等温式:平衡常数的表达式:温度,压力及惰性气体对化学平衡的影响:电解质溶液法拉第定律:Q=nzFm=t+=====r+为离子移动速率,U+(U-)为正(负)离子的电迁移率(亦称淌度)。近似:(浓度不太大的强电解质溶液)13\n离子迁移数:tB===+=1电导:G=1/R=I/U=kA/l电导率:k=1/ρ单位:S·m-1莫尔电导率:Λm=kVm=k/c单位S·m2·mol-1科尔劳乌施经验式:Λm=离子独立移动定律:=奥斯特瓦儿德稀释定律:=平均质量摩尔浓度:=平均活度系数:=平均活度:==电解质B的活度:aB==m+=v+mBm-=v-mB离子强度:I=德拜-休克尔公式:lg=-A|z+z--|可逆电池的电动势及其应用(ΔrG)T,p=-Wf,max(ΔrGm)T,p=zEFNernstEquation:若电池反应为cC+dD=gG+hHE=Eφ-标准电动势Eφ与平衡常数Kφ的关系:Eφ=还原电极电势的计算公式:=计算电池反应的有关热力学函数变化值:=13\n=-zEF+QR=T=zFzF=电极书面表示所采用的规则:负极写在左方,进行氧化反应(是阳极),正极写在右方,进行还原反应(是阴极)电动势测定的应用:(1)求热力学函数变量ΔrGm、ΔrGmΦ、、及电池的可逆热效应QR等。(2)求氧化还原反应的热力学平衡常数KΦ值:KΦ=EΦ=E=(3)求难溶盐的溶度积Ksp、水的离子积Kw及弱酸弱碱的电离常数等。(4)求电解质溶液的平均活度系数和电极的值。(5)从液接电势求离子的迁移数。Pt,H2(p)|HCl(m)|HCl(m’)|H2(p),Pt1-1价型:Ej=E=Ec+Ej=高价型:Mz+Az-(m1)|Mz+Az-(m2)Ej=(6)利用醌氢醌电极或玻璃电极测定溶液的pH电解与极化作用E分解=E可逆+ΔE不可逆+IRΔE不可逆=η阴+η阳η阴=(φ可逆-φ不可逆)阴η阳=(φ不可逆-φ可逆)阳φ阳,析出=φ阳,可逆+η阳φ阴,析出=φ阴,可逆-η阴η=a+blnjE(实际分解)=E(理论分解)+η(阴)+η(阳)+IR对电解池,由于超电势的存在,总是使外加电压增加而多消耗电能;对原电池,由于超电势的存在,使电池电动势变小而降低了对外作功的能力。在阴极上,(还原)电势愈正者,其氧化态愈先还原而析出;同理,在阳机上,则(还原)电势愈负者其还原态愈先氧化而析出。(需外加电压小)化学反应动力学13\n半衰期法计算反应级数:kp=kc(RT)1-nEa-Ea’=Q化学反应动力学基础二:ZAB==μ=若体系只有一种分子:ZAA==碰撞参数:b=dABsinθ碰撞截面:反应截面:kSCT(T)=kSCT(T)==几个能量之间的关系:Ea=Ec+RT/2=E0+mRT=式中是反应物形成活化络合物时气态物质的代数和,对凝聚相反应,13\n=0。对气相反应也可表示为:Ea=(式中n为气相反应的系数之和)原盐效应:弛豫法:36.79%对峙反应的表达式k1+k-1k2([A]e+[B]e)+k-1K1+2k-2xek2([A]e+[B]e)+k-2([G]e+[H]e)界面现象与T的关系:两边均乘以T,,即的值将随温度升高而下降,所以若以绝热方式扩大表面积,体系的温度必将下降。杨-拉普拉斯公式:ps为曲率半径,若为球面ps=,平面ps。液滴愈小,所受附加压力愈大;液滴呈凹形,R‘为负值,ps为负值,即凹形面下液体所受压力比平面下要小。毛细管:ps==ΔρghΔρgh=(R为毛细管半径)开尔文公式:p0和p分别为平面与小液滴时所受的压力对于液滴(凸面R‘>0),半径愈小,蒸汽压愈大。对于蒸汽泡(凹面R‘<0),半径愈小,蒸汽压愈小。13\n两个不同液滴的蒸汽压:溶液越稀,颗粒越大。液体的铺展:非表面活性物质使表面张力升高,表面活性物质使表面张力降低。吉不斯吸附公式:为表面超额若,>0,正吸附;,<0,负吸附。表面活性物质的横截面积:Am=粘附功:Wa值愈大,液体愈容易润湿固体,液固界面愈牢。内聚功:浸湿功:铺展系数:,液体可在固体表面自动铺展。接触角:Langmuir等温式:θ:表面被覆盖的百分数。离解为两个分子:混合吸附:即:BET公式:弗伦德利希等温式:乔姆金吸附等温式:13\n吸附剂的总表面积:S=AmLnn=Vm/22400cm3mol-1气固相表面催化反应速率:单分子反应:(产物吸附很弱)(产物也能吸附)双分子反应:(AB都吸附)(AB均吸附,但吸附的B不与吸附的A反应)(B不吸附)胶体分散体系和大分子溶液布朗运动公式:(D为扩散系数)球形粒子的扩散系数:渗透压:渗透力:F=扩散力=-F沉降平衡时粒子随高度分布公式:瑞利公式:电势表面电势Stern电势电解质浓度增加电势减小。电泳速度:k=6时为电泳,k=4时为电渗。大分子稀溶液渗透压公式:13