- 1.98 MB
- 2022-08-16 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
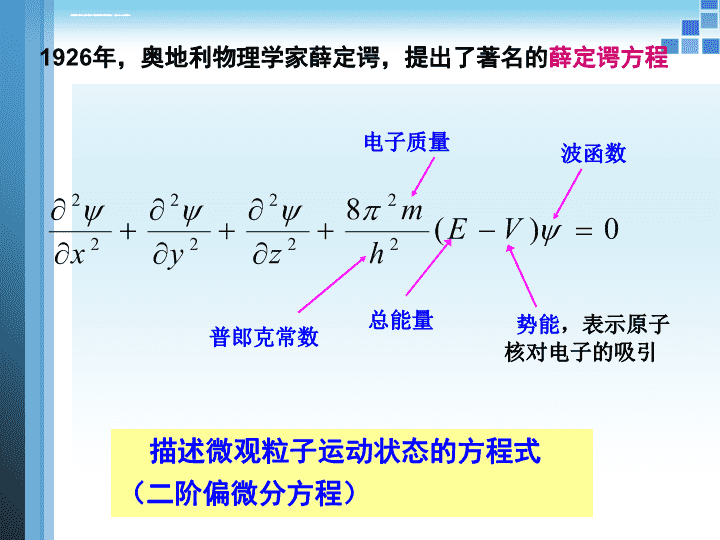
大学化学——原子结构大学化学—原子结构\n核外电子运动状态的描述经典波(如水波):可用波动方程来准确描述其运动轨迹。具有波粒二象性的电子是否也有相应的波动方程呢?\n1926年,奥地利物理学家薛定谔,提出了著名的薛定谔方程描述微观粒子运动状态的方程式(二阶偏微分方程)势能,表示原子核对电子的吸引总能量普郎克常数电子质量波函数\n原则上讲,只要找出体系势能(V)的表达式,带入薛定谔方程,便可得到波函数(),即求出电子的运动状态。但是,解薛定谔方程并非易事,至今只能求解单电子体系(H,He+,Li2+)的薛定谔方程。在此,我们只用其结论。\n波函数、原子轨道-就是薛定谔方程的解。可见,波函数就是描述核外电子运动状态的数学函数式。(x,y,z)量子力学中,要使所得的解有特定物理意义,中的n,l,m三个量子数必须符合一定条件n,l,m(x,y,z)1、波函数()\n原子轨道量子力学中,把原子体系的每一个波函数称为一条原子轨道。如n=2,l=0,m=0,波函数2,0,0就称为2s原子轨道因而,波函数与原子轨道同义,常混用。or:原子轨道是由三个量子数(n,l,m)所确定的一个波函数n,l,m(x,y,z)。\n解薛定谔方程可得到一个波函数,也就得到一条原子轨道。四个量子数【即】三个量子数(n,l,m)一定时就确定了一个波函数或一条原子轨道也就确定了核外电子的一种空间运动状态。(1,0,0);(2,0,0);【但是】要使其合理,需要指定三个量子数n,l,m;\n【后来】原子光谱的精细结构表明核外电子除空间运动外,还有一种“自旋运动”,用自旋量子数ms表示。n,l,m,mS称为四个量子数。\n1、主量子数n【意义】描述电子出现概率最大的区域离核的距离,是决定电子能量高低的主要因素(但不是唯一因素)。n越小,电子离核越近,能量越低。n越大,电子离核越远,能量越高。\n【n的取值及符号】1,2,3,4……n正整数光谱学上用K,L,M,N……表示分别称为第一、第二、第三…….第n电子层\n2、角量子数l研究发现,n=1,只有1种原子轨道n=2,有2种原子轨道;n=3,有3种原子轨道为了表示此现象,引入角量子数(l)\n【l的取值及符号】受主量子数n的限制;用s,p,d,f,g……表示。l:0,1,2,3,4……(n-1),共n个取值。\nl=0:s轨道,形状为球形,即3s轨道;zxsl=1:p轨道,形状为哑铃形,3p轨道;l=2:d轨道,形状为花瓣形,3d轨道;因此,在第三层上,有3种不同形状的轨道(亚层)当n=3时l可取0,1,2\n【l的意义】(1)决定原子轨道(或电子云)的形状,即表示亚层(2)决定电子空间运动的角动量(3)在多电子原子中与n共同决定电子能量的高低【亚层】同一层中(n相同)不同形状的轨道\n第n层有多少个亚层?有n个电子亚层如n=4,l可取0,1,2,3,分别表示4s、4p、4d,4f亚层;【因此】l标志电子亚层\n3、磁量子数mn=2,l=1(2p亚层),发现在空间有3种不同的取向n=3,l=2(3d亚层),发现在空间有5种不同的取向为了表示此种现象,引入磁量子数(m)\n【m的取值及符号】受角量子数l的限制对于给定的l,m可取0,1,2,3,…l,共(2l+1)个值。这些取值意味着?在角量子数为l的亚层有(2l+1)个取向,即有(2l+1)条取向不同的原子轨道。\ns轨道:l=0,m=0,只有一种空间取向,所以s轨道为球形。zxs\np轨道:l=1,m=0,+1,-1,在空间有三种取向。\nd轨道:l=2,m=0,+1,-1,+2,-2,在空间有五种取向;\nf轨道:l=3,m=0,+1,-1,+2,-2,+3,-3,七个值在空间有七种取向;f轨道为花瓣形。\n【m的物理意义】描述原子轨道或电子云在空间的伸展方向。每一个m的取值,对应一种空间取向。\nm的不同取值,意味着原子轨道的空间取向不同,但一般不影响能量。【简并】把同一亚层(即l相同),伸展方向不同的原子轨道称为等价轨道或简并轨道。l=1,m=0,+1,-1,有3种空间取向。Px,Py,Pz为3条简并轨道,或者说p轨道是3重简并的。\nd轨道有5种不同的空间取向,d轨道是5重简并的。f轨道有7种不同的空间取向,f轨道是7重简并的。\n【小结】量子数与电子云的关系主量子数n:决定电子云的能量;角量子数l:描述电子云的形状;磁量子数m:描述电子云的空间取向;n,l,m一定,原子轨道也就确定\n4、自旋量子数ms用高分辨光谱仪研究原子光谱时发现:在无外磁场作用时,每条谱线由两条十分接近的谱线组成。为了解释这种现象,认为电子有自旋运动,并提出了自旋量子数,用ms表示。因此,电子既围绕原子核旋转运动,也自身旋转。\nms的取值只有两个:+1/2和-1/2;即电子的自旋方式只有两种,通常用“”和“”表示。\n【注意】【1】指定三个量子数n,l,m,就解出一个波函数(),得到一条原子轨道,因此,可用三个量子数n,l,m描述一条原子轨道;3,0,0,3s轨道;3,1,13p轨道中的一条【2】描述一个电子的运动状态,需要四个量子数,n,l,m,mS。(3,1,0,+1/2)表示在3p轨道上“正旋”的一个电子。\n【四个量子数总结】解薛定谔方程可能得到多个解(),要使解有意义,还取决于n,l,m三个量子数。-n(主量子数)决定电子的能量和离核的远近;-l(角量子数)决定轨道的形状;-m(磁量子数)决定轨道的空间伸展方向;因此,描述一个电子的运动状态需要n,l,m,ms四个量子数为了描述电子的自旋,引入自旋量子数(ms)\n【1】主量子数nn=1,2,3,……;K,L,M,N,…【2】角量子数ll=0,1,2……n-1;s,p,d,f…共n个【3】磁量子数mm=+l,……0,……-l;共2l+1个【4】自旋量子数ms\n概率密度、电子云核外电子没有固定的运动轨迹,只能用统计规律来描述其运动状态。把电子在核外空间某一区域内出现机会的多少,称为概率。电子在核外空间某处单位体积内出现的概率叫概率密度。1、概率密度\n量子力学中,用波函数绝对值的平方表示电子出现的概率密度。因此,空间某点(x,y,z)附近体积内电子出现的概率=概率密度×体积\n2、电子云化学上习惯用小黑点分布的疏密来表示电子出现几率的大小。可表示电子出现的概率密度,但不直观,较复杂。\n这种形象化表示概率密度分布的图形称为电子云,是电子行为具有统计性的一种形象化描述。小黑点较密的地方,表示该点较大,单位体积内电子出现的机会多,概率密度大。\n【需要注意的是】在研究原子中电子的运动时,无法说明电子恰好在某一位置,只能指出电子在空间的几率密度分布,即电子云分布。\n电子云的角度分布图电子云的角度分布图既Y2(,)对,作图\n几率密度和电子云\n【原子轨道和电子云角度分布图的比较】分布图类似,区别在于:(1)电子云的角度分布图要“瘦”些,∵Y(,)<1,则Y2(,)更小。(2)原子轨道的角度分布图有正、负之分(不是指带正电或带负电),而电子云的角度分布图全部为正,∵Y(,)平方后总为正值。\n核外电子排布和元素周期律电子在原子核外如何排列?有无规律可言?光谱实验表明:基态原子核外电子的排布有严格规律,首先必须遵循能量最低原理。为此,必须先知道各原子轨道的能级顺序,再讨论电子排布!\n单电子体系:n相同的轨道,能量相同:E4s=E4p=E4d=E4fn越大能量越高:E1sr共\n(3)范德华半径单原子分子(He,Ne等稀有气体),原子间靠范德华力结合,因此无法得到共价半径。低温高压下,稀有气体能形成分子晶体,原子核间距的一半定义为范德华半径。\n卤素在极低温度下能形成双原子的分子晶体,相邻的不同分子中的两个卤素原子的核间距的一半,就是卤素原子的范氏半径。\n范德华半径(非键合)>金属半径(紧密堆积)>共价半径(轨道重叠)讨论原子半径的变化规律时,常采用共价半径。由此可见:\n(4)原子半径的周期性同周期中,有哪些因素影响原子半径?(a)从左向右,核电荷数(Z),对电子吸引力,r(b)从左向右,核外电子数,电子之间排斥力,r这是一对矛盾,以哪方面为主?以(a)为主。即同周期中从左向右,原子半径减小。\n同族中,原子半径如何变化?(a)从上到下,Z,对电子吸引力,r(b)从上到下,核外电子增多,增加一个电子层,r这一对矛盾中,(b)起主导作用。同族中,从上到下,原子半径一般逐渐增大。主族元素Li123pmNa154pmK203pmRb216pmCs235pm依次增大\n主族元素\n【副族元素和主族元素的情况有所差异】副族元素TiVCrr/pm132122118ZrNbMo145134130HfTaW144134130对于第五、第六周期的副族元素,它们的原子半径非常接近(镧系收缩)\n2、电离能(I)的周期性1mol基态气态原子,失去最高能级的1mol电子,形成1mol气态正离子(M+)所吸收的能量,叫这种元素的第一电离能(用I1表示)。M(g)——M+(g)+eH=I1\n1mol气态M+继续失去最高能级的1mol电子,形成1mol气态M2+所吸收的能量为第二电离能I2M+(g)——M2+(g)+eH=I2用类似的方法定义I3,I4,……In。【可见】电离能(I)表示原子失去电子的能力,I越大,越难失去电子;I越小,越易失去电子。\n失去电子形成正离子后,半径减小,核对电子的引力增加,再失去电子变得困难。对一种元素而言:I12为非金属。\n原子性质从左到右从上到下原子半径减小增大,第五、第六周期接近电离能增大,全满半满结构稍大减小,过渡元素略增,多处不规律电子亲和能增大减小,但O和F并非本族最大值,由于半径小,内层电子排斥力大所致电负性增大减小,副族不明显\n谢谢!