- 242.50 KB
- 2022-08-16 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
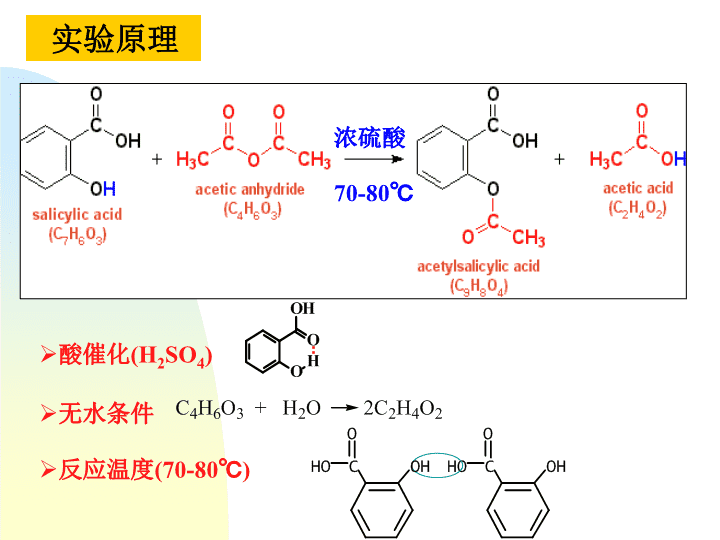
乙酰水杨酸的合成\n实验目的1掌握乙酰化反应原理及常量合成操作2掌握固体有机物纯化方法—混合溶剂重结晶法\n实验原理浓硫酸70-80℃酸催化(H2SO4)无水条件反应温度(70-80℃)\n仪器:锥形瓶烧杯量筒布氏漏斗玻璃棒滤纸恒温水槽抽滤系统试剂:水杨酸乙酐浓硫酸95%乙醇FeCl3溶液(10g·L-1)实验仪器与试剂\n1合成150mL锥形瓶3.0g水杨酸6mL乙酐8滴浓硫酸70~80ºC水浴5min冷却至室温30mL水冰水浴中冷却减压过滤蒸馏水洗涤2~3次检查纯度乙酰水杨酸粗品(无水)实验步骤充分振摇\n95%乙醇6~7mL70~80ºC水浴加热溶解冷却至室温20mL水减压过滤蒸馏水洗涤2~3次检查纯度乙酰水杨酸粗品70~80ºC水浴加热溶解冰水浴结晶用滤纸压干水分称重并计算产率(锥形瓶)2重结晶\n3纯度检查取少量样品溶于10滴95%乙醇中,加1~2滴FeCl3溶液(10g·L-1)。观察颜色变化。最可能存在于最终产物中的杂质是水杨酸本身,它的存在是由于乙酰化反应不完全,或者由于产物在分离步骤中发生水解造成的。水杨酸像大多数酚一样,与Fe3+离子形成深色络合物。\n4产率计算3.0g水杨酸=0.022mol水杨酸++浓硫酸70~80ºC理论产量=0.022mol×180.2g·mol-1=3.9g(水杨酸为限量试剂)\n1、抽紧滤纸:在抽滤之前,在布氏漏斗中铺一张直径略小于漏斗内径的圆形滤纸,用水将滤纸润湿,打开水泵,关闭安全瓶上的活塞,抽气,使滤纸紧贴在漏斗底部。2、抽干母液:将要过滤的混合物到入布氏漏斗中,使晶体均匀分布,使其将漏斗内滤纸表面完全覆盖,并用玻璃棒挤压晶体,抽干母液。3、洗涤结晶:为了除去晶体表面的母液,应洗涤结晶。加入少量水(~5mL)均匀洗涤结晶,抽干,重复操作2~3次。4、结束抽滤:先将安全瓶上的活塞打开与大气相通,之后关闭水泵,然后将布氏漏斗从抽滤瓶上取出。减压过滤\n减压过滤操作(布氏漏斗)(抽滤瓶)\n从有机化学反应得到的固体粗产物往往含有未反应的原料、副产物及杂质,必须加以分离纯化。提纯固体有机物最常用的方法之一就是重结晶。固体有机物在溶剂中的溶解度随温度变化而改变。通常升高温度溶解度增大,反之则溶解度降低。若使固体溶解在热溶剂中,并使其达到饱和溶液,冷却时,溶解度下降,溶液变为过饱和而析出结晶。利用溶剂对被提纯化合物及杂质的溶解度不同,使溶解度很小的杂质在热滤时除去或冷却后溶解度很大的杂质被留在母液中,从而达到分离提纯固体有机化合物的目的。重结晶根据所用溶剂的数量分为单一溶剂重结晶和混合溶剂重结晶。单一溶剂重结晶是利用被提纯化合物及杂质在一种溶剂中的溶解度不同提纯有机化合物。混合溶剂重结晶是利用被提纯化合物及杂质在混合溶剂中的溶解度不同提纯有机化合物。重结晶溶剂选择原则见教材,p19。重结晶\n先用适量溶解度较大的溶剂,加热使样品溶解(趁热过滤除去不溶杂质)将滤液加热至接近沸点,慢慢滴加溶解度较小的溶剂至刚好出现混浊,再加热使滤液转为清亮静置冷却析出结晶4若已知两种溶剂的某一比例适用于重结晶,可事先配好混合溶剂,按单一溶剂方法进行重结晶操作\n注意事项合成过程中注意加样顺序。抽滤操作:关闭水泵前,先将安全瓶上的活塞打开与大气相通。样品不用红外灯干燥。\n思考题1反应容器为什么要干燥无水?2混合溶剂重结晶法如何操作?减压过滤时应注意哪些问题?