- 1.22 MB
- 2022-08-16 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
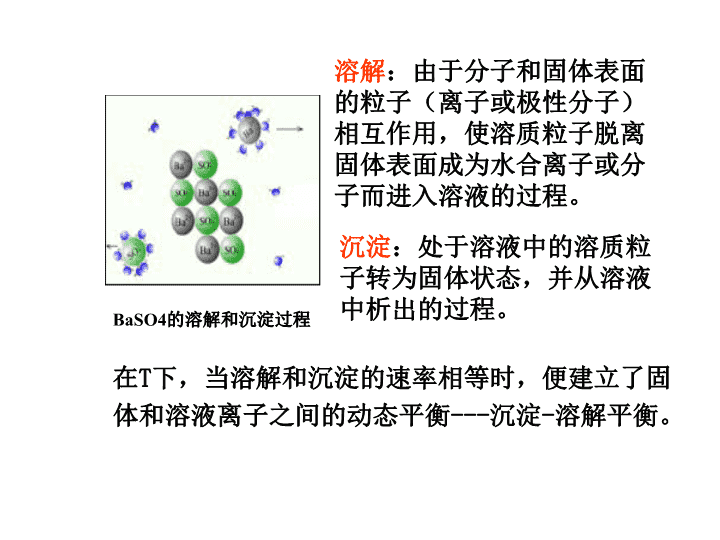
多相离子平衡3.3沉淀-溶解平衡相——体系中物理性质和化学性质都相同的部分。相与相之间有明确的界面;一个相可以由一种物质或几种物质构成,但内部必须均匀;由一个相构成的体系——单相体系;由两个或两个以上相构成的体系——多相体系\n在T下,当溶解和沉淀的速率相等时,便建立了固体和溶液离子之间的动态平衡---沉淀-溶解平衡。溶解:由于分子和固体表面的粒子(离子或极性分子)相互作用,使溶质粒子脱离固体表面成为水合离子或分子而进入溶液的过程。沉淀:处于溶液中的溶质粒子转为固体状态,并从溶液中析出的过程。BaSO4的溶解和沉淀过程\n3.3.1溶度积1.溶解度物质的溶解度(solubility)是指在一定温度和压力下,固液达到平衡状态时,饱和溶液里的物质浓度。常表示为s单位是:g·dm-3或mol/dm-3。\n2溶度积SolubilityProductBaSO4(s)Ba2++SO42-沉淀溶解若:V溶解>V沉淀溶解过程未饱和溶液V溶解<V沉淀沉淀过程过饱和溶液V溶解=V沉淀平衡饱和溶液平衡常数表达式为:Ks=c(Ba2+)·c(SO42-)对于一般的反应:\n难溶强电解质饱和溶液
离子浓度(s)的计算1)已知溶度积Ks,求难溶电解质的溶解度ss——难溶电解质饱和溶液的浓度,sB=cB(饱和)2)已知溶解度s,求溶度积Ks平衡时 ssKs=c(Ag+)·c(Cl-)=s2s=(Ks)1/2AgCl(s)Ag++Cl-例\n一般式AB型,如:AgCl、AgBr、AgIS=(Ks)1/2A2B型或AB2型,如:Ag2CO4、Ag2SS=(Ks/4)1/3AB3型,如:Fe(OH)3S=(Ks/27)1/4\n溶度积和溶解度之间的区别●与溶解度概念应用范围不同,Ks只用来表示难溶电解质的溶解度。●Ks不受离子浓度的影响,而溶解度则不同。●用Ks比较难溶电解质的溶解性能只能在相同类型化合物之间进行,溶解度则比较直观。\n1)比较298.15K时,AgCl和AgI在水中的溶解度。AgClAgIKs1.8×10-10>8.51×10-17S=(Ks)1/21.3×10-5mol·dm-3>9.2×10-9mol·dm-3∴对同类型的难溶盐,Ks越大溶解解度越大。2)比较298.15K时,AgCl和Ag2CrO4在水中的溶解度。AgClAg2CrO4Ks1.8×10-10>9.0×10-12S1.3×10-5mol·dm-3<1.34×10-4mol·dm-3∴对不同类型的难溶电解质,不能直接用Ks来判断溶解度的大小,应计算S的大小。\nQuestion1298K时铬酸银Ag2CrO4的溶度积常数为2.0×10-12,求该温度下的溶解度。解:设饱和溶液中CrO42-离子的浓度smol·dm-3,则代入溶度积常数表达式得:Ks(Ag2CrO4)={c(Ag+)}2c(CrO42-)=(2s)2·s=4s3溶液中CrO42-离子的浓度为7.9×10-5mol·dm-3。\nΔrGm(T)=RTlnJc/Kθ3.3.2溶度积规则SolubilityProductPrincipleAgCl(s)Ag++Cl-Jc={c(Ag+)/cθ}·{c(Cl-)/cθ}Kθ={c(Ag+)平/cθ}·{c(Cl-)平/cθ}ΔrGm(T)=RTln{c(Ag+)/cθ}·{c(Cl-)/cθ}{c(Ag+)平/cθ}·{c(Cl-)平/cθ}\n任意态时,离子浓度的乘积c(Ag+)·c(Cl-)——离子积c(Ag+)·c(Cl-)=Ks,ΔrGm=0,平衡态,饱和溶液c(Ag+)·c(Cl-)>Ks,ΔrGm>0,逆向自发,有AgCl↓c(Ag+)·c(Cl-)<Ks,ΔrGm<0,正向自发,AgCl↓溶解,或无AgCl↓生成,未饱和溶液。将离子积与溶度积进行比较:ΔrGm(T)=RTlnc(Ag+)·c(Cl-)Ks\n溶度积规则Av+Bv-(s)v+Az++v-Bz-{c(Az+)}v+·{c(Bz-)}v-=Ks,ΔrGm=0,饱和溶液{c(Az+)}v+·{c(Bz-)}v->Ks,ΔrGm>0,有沉淀生成{c(Az+)}v+·{c(Bz-)}v-<Ks,ΔrGm<0,沉淀溶解,或无沉淀生成,未饱和溶液。\n25℃时,腈纶纤维生产的某溶液中,c()为6.0×10-4mol·dm-3。若在40.0L该溶液中,加入0.010mol·L-1BaCl2溶液10.0L,问是否能生成BaSO4沉淀?Question2解:\nQuestion3解:利于BaCO3的溶解。①加酸②加或或促使BaCO3的生成。对已达到平衡的反应分别给其加入HCl、BaCl2或Na2CO3溶液,结果怎样?\n在难溶电解质饱和溶液中加入含有相同离子的强电解质时,导致难溶电解质溶解度降低的现象叫同离子效应(commonioneffect)。同离子效应是吕·查德里原理的一种体现形式,重量分析中利用这种效应,通过加大沉淀剂的用量使被测组分沉淀更完全。同离子效应\nQuestion4试计算298K时BaSO4在0.10mol·dm-3Na2SO4溶液中的溶解度,并与其在纯水中的溶解度(1.04×10-5mol·dm-3)做比较。解:设c(Ba2+)=smol·dm-3则:c(SO42-)=(s+0.10)mol·dm-3(BaSO4)=s(s+0.10)=1.1×10-10由于s<<0.10,式中的(s+0.10)可用0.10代替,从而算得:s=1.1×10-9即c(Ba2+)=1.1×10-9mol·dm-3。该结果即BaSO4在0.10mol·dm-3Na2SO4溶液中的溶解度,比纯水中的溶解度下降了10-4倍。或者说,下降至原来的1/10000。\n让我们先看一个实验:Cu(OH)2沉淀[Cu(NH3)4]SO4溶液CuSO4溶液Cu(OH)2沉淀[Cu(NH3)4]SO4溶液CuSO4溶液NH3水NH3水\n3.4.1配合物的基本概念3.4配离子的离解平衡Complex-IonEquilibria配位键——原子间的共用电子对是由一个原子单方面提供而形成的共价键A←B配离子——是由一个简单正离子和一定数目的中性分子或负离子结合而成的复杂离子。如:[Cu(NH3)4]2+[Ag(NH3)2]+[Fe(CN)6]3+配合物——配离子与带相反电荷的离子组成的电中性化合物(或含有配离子的化合物)称为配位化合物,简称配合物。\n(1)配合物的组成中心离子(配合物形成体)内界配合物配位体(配体)外界←外界内界只有内界\n讨论正离子(多)中性原子(少)金属元素(多)非金属元素(少)2.配位体和配位原子与中心原子结合的分子或离子(如例中的NH3分子、CO分子和CN-离子)叫做配位体(Ligand),配位体中与中心原子直接键合的原子叫配位原子(如配位体NH3中的N原子,配位体CN-和CO中C原子)。中心离子位于配离子中心的正离子或中性原子\n配位体又因含有的配位原子数目不同分为单齿配位体(Monodentateligand)和多齿配位体(Polydentateligand)。●单齿配体:一个配体中只含一个配位原子\n●多齿配体:一个配体中含有多个配位原子乙二胺(en)乙二酸根(草酸根)卟啉(Porphyrin),其中的8个R基团都为H的化合物叫卟吩(Porphine)。它们都是四齿配位体,配位原子是4个N原子(具有孤对电子的两个N原子和H+解离后留下孤对电子的两个N原子)。\n叶绿素(chlorophyllsa)是镁的大环配合物,作为配位体的卟啉环与Mg2+离子的配位是通过4个环氮原子实现的。叶绿素分子中涉及包括Mg原子在内的4个六元螯环。叶绿素是一种绿色色素,它能吸收太阳光的能量,并将储存的能量导入碳水化合物的化学键。阳光nCO2+nH2O(CH2O)n+nO2叶绿素这就是光合作用(photosynthesis)\n血红素是个铁卟啉化合物,是血红蛋白的组成部分。Fe原子从血红素分子的血红蛋白本身不含图中表示出来的那个O2分子,它与通过呼吸作用进入人体的O2分子结合形成氧合血红蛋白,通过血流将氧输送至全身各个部位。下方键合了蛋白质链上的1个N原子,圆盘上方键合的O2分子则来自空气。oxyhemoglobin氧合血红蛋白\n特殊配合物这类配合物是最近几十年才蓬勃发展起来的一类新型配合物。(1)羰合物以一氧化碳为配体的配合物称为羰基配合物。如Fe(CO)5(2)夹心配合物金属原子F被夹在两个平行的碳环之间,形成夹心配合物。(3)原子簇状化合物有两个或两个以上金属原子以金属—金属键(M—M)直接结合而形成的化合物。\n(4)烯烃配合物:配体是不饱和烃。如:[PdCl3(C2H4)]-。(5)多酸型配合物:配体是多酸根。如:(NH4)3[P(Mo3O10)]6H2O。(6)多核配合物:含两个或两个以上的中心离子。如[(H2O)4Fe(OH)2Fe(H2O)4]4+。\n与中心离子(或原子)成键的配位原子的总数3.配位数例如:\n1、配体的名称(1)电中性配体的名称:保留原来名称不变,例外的有:CO-羰基、N0-亚硝酰、O2-双氧、N2-双氮。(2)无机阴离子配体的名称:在名称后加一“根”字,例如:SCN-硫氰酸根等;但是名称只有一个汉字时,省去“根”字。例如:F-氟、Cl-氯、O2-氧、OH-羟、HS-巯、CN-氰等。(2)配合物的命名\n(3)有机阴离子配体的名称:有机配体一般不使用俗名,有机配体中凡是从有机化合物失去质子而形成的物种,看作阴离子,其名称一般用“根”字结尾,例如:CH3COO-乙酸根。(4)两可配体的名称:如果单齿配体中的两个不同的原子都能充当配位原子时,它就称为两可配体。同种配体以不同的原子作配位原子时,其名称不相同,例如:当以S原子配位时,称之为硫氰酸根,记为-SCN;当以N原子配位时,称之为异硫氰酸根,记为-NCS。当以O原子配位时,称为亚硝酸根,记为-ONO;当以N原子配位时,称为硝基,记为-NO2。亚硝酸根NO2-硫氰酸根SCN-\n外界-配位体中心离子合1)具有配正离子的配合物:(2)配合物的命名例:[Cu(NH3)4]SO4硫酸四氨合铜(Ⅱ)[Co(NH3)6]Cl3三氯化六氨合钴(Ⅲ)\n合酸配位体中心离子-外界例:K2[HgI4]四碘合汞(Ⅱ)酸钾K3[Fe(CN)6]六氰合铁(Ⅲ)酸钾K4[Fe(CN)6]六氰合铁(Ⅱ)酸钾2)具有配负离子的配合物:\n(1)无机物优先原则:例如,K[SbCl5(C6H5)]五氯·苯基合锑(V)酸钾。(2)离子优先原则:例如,[Pt(NH3)2Cl2]二氯·二氨合铂。(3)英文字母顺序:例如,[Co(NH3)5H2O]Cl3氯化五氨·水合钴(III)。(4)少数优先原则:原子数较少的配体在前,相同时则比较与配位原子相连的原子,按英文字母顺序命名。例如,[Pt(NO2)(NH3)(NH2OH)(Py)]Cl氯化硝基·氨·羟氨·吡啶合铂(II)。例如,[Pt(NH2)(NO2)(NH3)2]氨基·硝基·二氨合铂。3)有两个以上配体先阴离子后中性分子,先简单,后复杂,先无机,后有机,不同配体之间,以“·”隔开。\n例:[Cu(NH3)4]2+四氨合铜(Ⅱ)离子[Ag(NH3)2]+二氨合银(Ⅰ)离子[Fe(CN)6]3+六氰合铁(Ⅲ)离子[Co(NH3)3Cl3]三氯·三氨合钴(Ⅲ)Ni(CO)4四羰(基)合镍Co2(CO)8八羰(基)合二钴4)配离子和配分子:\n硫酸四氨合铜(Ⅱ)六异硫氰根合铁(Ⅲ)酸钾六氯合铂(Ⅳ)酸氢氧化四氨合铜(Ⅱ)五氯•氨合铂(Ⅳ)酸钾硝酸羟基•三水合锌(Ⅱ)(三)氯化水•五氨合钴(Ⅲ)五羰(基)合铁三硝基•三氨合钴(Ⅲ)乙二胺四乙酸根合钙(Ⅱ)羟基•草酸根•水•乙二胺合铬(Ⅲ)命名练习:\n向CuSO4溶液中加入过量的氨水,深蓝色溶液:Cu2++4NH3=Cu(NH3)42+(深蓝色)3.4.2配离子的离解平衡Cu(NH3)42+Cu2++4NH3配合离解这种平衡称为配离子的离解平衡。c(Cu2+)c(NH3)4K不稳=c{[Cu(NH3)4]2+}\nK不稳=K1·K1·K3·K4Cu(NH3)42+Cu2++4NH3K不稳分四步离解:Cu(NH3)42+Cu(NH3)32++NH3K1Cu(NH3)32+Cu(NH3)22++NH3K2Cu(NH3)22+Cu(NH3)2++NH3K3Cu(NH3)2+Cu2++NH3K4分步离解\nK稳=1/K不稳Cu2++4NH3Cu(NH3)42+c{[Cu(NH3)4]2+}K稳=c(Cu2+)c(NH3)4配离子的解离常数也可用稳定常数K稳来表示\n例室温下,0.010mol的AgNO3(s)溶于1.0L0.030mol·L-1的NH3·H2O中(设体积不变),计算该溶液中游离的Ag+、NH3和Ag(NH3)2+的浓度。解:很大,且c(NH3)大,预计生成Ag(NH3)2+的反应完全,生成了0.010mol·L-1Ag(NH3)2+。c(Ag(NH3))+很小,可略而不计。\n黑白照相中的定影:就是用定影剂(Na2S2O3)洗去不溶性的AgBr,3.4.3配合物的应用AgBr+2S2O32-Ag(S2O3)23-+Br-1)定影过程的化学反应\n2)鉴别和分离离子AgBr和AgI的分离:Fe2+和Fe3+的鉴定:AgBrAgI1mol/lNa2S2O3Ag2[S2O3]2+不溶解Fe2+Fe3+K3[Fe(CN)6]蓝色沉淀无现象K4[Fe(CN)6]蓝色沉淀无现象\n有六个配位原子,能与大多数金属离子形成环状结构的配合物(螯合物),比一般配合物更稳定。3)EDTA(乙二胺四乙酸钠)\n除用于定量分析外,它还是铅、镉、汞等重金属中毒的解毒剂。解毒剂\n补充:配合物的应用(applicationofcomplexes)(1)分析化学的离子检验与测定Fe3++nSCN-==[Fe(SCN)n]3-n(血红色)2Fe3++Sn2+==2Fe2++Sn4+6Fe2++Cr2O2-+14H+==6Fe3+2Cr3++7H2O(紫红色)7(2)物质的分离pH=10的NH4Cl-NH3中,Cu2+生成[Cu(NH3)4]2+而与生成氢氧化物的Fe3,Fe2+,Al3+,Ti4+等离子分离.(3)难溶物的溶解4Au+8KCN+2H2O+O2==4K[Au(CN)2]+4KOH(4)环境保护6NaCN+3FeSO4=Fe2[Fe(CN)6]+3NaSO4\n(5)金属或合金的电镀Cu2++2P2O4-==[Cu(P2O7)2]6-↓7由于[Cu(P2O7)2]6-较难离解,溶液中c(Cu2+)小,使Cu2+在电极上放电速率慢,有利于新晶核的产生,因而可得到光滑、均匀、附着力好的镀层Na2HgS2+H2O+½O2=HgS↓(辰砂)+2NaOH+S↓(6)在成矿中的作用地壳中热液中锡或铁的配合物分解:Na2[Sn(OH)4F2]=SnO2(锡石)+2NaF+2H2ONa2HgS2在空气中被氧化:2Na3[FeCl6]+3H2O=Fe2O3(赤铁矿)+6NaCl+6HCl\n本章学习要求和作业Ⅰ要求了解:多步电离、溶度积规则、配离子的离解平衡理解:Kθ及与T、△rGmθ关系;C、T、P对平衡的影响;缓冲溶液;同离子效应;配位化合物及命名。掌握:Kθ相关计算;pH基本计算;Ⅱ作业P781、4、5、6、8、9、12、16、17、18\n一、沉淀的酸溶解1.难溶金属氢氧化物的溶解M(OH)n(s)⇌Mn+(aq)+nOH-(aq)Ks(M(OH)n)=c(Mn+)c(OH-)n根据上式可以绘出难溶M(OH)n的溶解度与溶液PH的关系图(通常被称为S-pH图);还可以计算氢氧化物开始沉淀和沉淀完全时溶液的c(OH-),从而求出相应条件的pH。\n\n金属氢氧化物沉淀的pH值分子式Ks开始沉淀pH值沉淀完pH值Mg(OH)25.1×10-128.6(8.3)10.1(10.0)Co(OH)26.3×10-317.2(7.5)8.7(10.0)Cr(OH)37.2×10-154.4(5.0)5.4(8.0)Zn(OH)21.2×10-176.5(6.8)8.0(9.0)Pb(OH)21.2×10-157.5(7.2)9.0(8.0)Fe(OH)28.0×10-167.5(5.8)9.0(7.0)Fe(OH)34.0×10-382.2(2.2)3.2(4.0)\n例:在含Fe3+和Ni2+都为0.10mol·L-1的溶液中,欲除掉Fe3+,而Ni2+仍留在溶液中,应控制pH多少?解:Ks(Fe(OH)3)=4.0×10-38,Ks(Ni(OH)2)=5.0×10-16pH终=3.20所以,若控制pH=4~6.85,可保证Fe3+完全沉淀,而Ni2+仍留在溶液中。pH始≥6.85\nJ>KsJKs[Mg(OH)2],所以有Mg(OH)2沉淀析出。②为了不使Mg(OH)2沉淀析出,须J≤Ks[Mg(OH)2]\nNH3(aq)+H2O(l)⇌NH4+(aq)+OH-(aq)平衡cB/(mol·L-1) 0.050-4.5×10-6c0+4.5×10-64.5×10-6≈0.050≈c0c0(NH4+)=0.20mol·L-1要不析出Mg(OH)2沉淀,至少应加入NH4Cl(s)的质量为:m(NH4Cl)=(0.20×0.40 ×53.5)g=4.3g\nPbSBi2S3CuSCdSSb2S3SnS2As2S3HgS常见的金属硫化物2.金属硫化物的溶解\n♦难溶金属硫化物(MS)的多相离子平衡为:MS(s)+H2O(l)⇌M2+(aq)+OH-(aq)+HS-(aq)其平衡常数表示式为:K=c(M2+)c(OH-)c(HS-)♦难溶金属硫化物在酸中的沉淀溶解平衡:MS(s)+2H3O+(aq)⇌M2+(aq)+H2S(aq)+2H2O(l)\n设溶液中M2+的初始浓度为c(M2+),通入H2S气体达饱和时,c(H2S)=0.10mol·L-1,则产生MS沉淀的最高H3O+离子浓度c(H3O+)(或最低pH)为:\n金属硫化物的溶解方法HAc稀HCl浓HClHNO3王水MnS溶ZnSFeS不溶溶CdS不溶不溶溶PbS不溶不溶溶溶CuSAg2S不溶不溶不溶溶HgS不溶不溶不溶不溶溶\n例:25℃下,于0.010mol·L-1FeSO4溶液中通入H2S气体至饱和(c(H2S)=0.10mol·L-1)。用HCl调节pH值,使c(HCl)=0.30mol·L-1。试判断能否有FeS生成。Kspa越大,硫化物越易溶。解:\n例:计算使0.010mol的SnS溶于1.0L盐酸中,所需盐酸的最低浓度。解:SnS全部溶解后,溶液中的c(H3O+)为:0.010mol的S2-消耗掉的H+为0.020mol,故所需的盐酸的起始浓度为:0.96+0.02=0.98mol·L-1\n二、沉淀的配位溶解难溶物在配位剂的作用下生成配离子而溶解♦发生加合反应溶解AgCl(s)+Cl-(aq)⇌AgCl2-(aq)HgI2(s)+2I-(aq)⇌HgI42-(aq)♦发生取代反应溶解:AgCl(s)+2NH3(aq)⇌[Ag(NH3)2]+(aq)+Cl-(aq)AgBr(s)+2S2O32-(aq)⇌[Ag(S2O3)2]3-(aq)+Br-(aq)\n溶液的沉淀平衡与配位平衡的相互影响(1)配合物的生成对难溶盐溶解度的影响金属难溶盐在配体溶液中,由于金属离子与配体生成配合物而使金属难溶盐的溶解度增加。【例】分别计算AgCl沉淀在水中和0.10mol.L-1NH3水中的溶解度。已知Kf([Ag(NH3)2]+)=1.67×107,KSP(AgCl)=1.8×10-10。解:(1)求AgCl沉淀在水中的溶解度S1S1==7.4510-6mol.L-1\n(2)求AgCl沉淀在NH3水中的溶解度S2溶解反应:AgCl+2NH3=[Ag(NH3)2]++Cl-平衡常数:=1.67×1071.8×10-10=3.010-3AgCl+2NH3=[Ag(NH3)2]++Cl-0.1-2XXXS2=X=1.76X10-2mol.L-1AgCl在氨水中的溶解度(1.76X10-2)比在水中(7.4510-6)大得多。\n(2)难溶盐的生成对配合物稳定性的影响[Ag(NH3)2]+2NH3+Ag++I-AgI↓随着金属难溶盐沉淀的产生,导致中心离子的浓度的减小,从而引起配位平衡向解离方向的移动。【例】在NH3浓度为3.0mol.L-1、[Ag(NH3)2]+浓度为0.10mol.L-1的溶液中,加入NaCl的固体(忽略体积变化),使Cl-的浓度为0.010mol.L-1,通过计算判断有无AgCl沉淀生成。已知([Ag(NH3)2]+)=1.67×107,(AgCl)=1.8×10-10。促进解离\n解法1:Ag++2NH3[Ag(NH3)2]+平衡:[Ag+]=x=6.65×10-10mol.L-1J=[Ag+][Cl-]=6.65×10-10×0.010=6.65×10-12已知Ksp(AgCl)=1.8×10-10因为J<Ksp(AgCl)故没有AgCl沉淀生成X3.0+2x≈3.00.10-x≈0.10大[Ag+]太小\n解法2:由生成[Ag(NH3)2]+转化为AgCl沉淀的反应式为:[Ag(NH3)2]++Cl-2NH3+AgCl(s)转化反应平衡常数:==332.7反应商:=9000由于J>K,上述反应逆向进行,故没有AgCl沉淀生成。\n一些两性氢氧化物,如Al(OH)3、Cr(OH)3、Zn(OH)2和Sn(OH)2等,它们既可以溶于酸,又可以溶于强碱,生成羟基配合物:[Al(OH)4]-、[Cr(OH)4]-、[Zn(OH)4]2-和[Sn(OH)3]-等。Al(OH)3在强碱中的配位反应为:Al(OH)3(s)+OH-(aq)⇌[Al(OH)4]-(aq)c([Al(OH)4]-)K=——————————c(OH-)Al(OH)3溶解度:S=c([Al(OH)4]-)=Kc(OH-)\nAl(OH)3的S—pH图Al3+(aq)Al(OH)3沉淀Al(OH)3溶解\n♦氧化还原溶解3CuS(s)+2NO3-(aq)+8H+(aq)=3Cu2+(aq)+2NO(g)+3S(s)+4H2O(l)Ks(CuS)=1.2×10-36♦氧化—配位溶解3HgS(s)+2NO3-(aq)+12Cl-(aq)+8H+=3[HgCl4]2-(aq)+3S(s)+2NO(g)+4H2O(l)Ks(HgS)=6.4×10-53三、沉淀的配位氧化还原溶解\n沉淀溶解的方法♦酸(碱或盐)溶解♦配位溶解♦氧化还原溶解♦氧化—配位(王水)溶解\n四、沉淀与溶解的多重平衡1分步沉淀2沉淀的转化\n1分步沉淀往含I-、Cl-浓度均为0.01mol·L-1的混合溶液中逐滴加入AgNO3溶液,先析出AgI(s)还是AgCl(s)?解:,故AgI先沉淀。AgCl开始沉淀时:\n分步沉淀的次序♦沉淀类型相同,被沉淀离子浓度相同,Ks小者先沉淀,Ks大者后沉淀;与被沉淀离子浓度有关:当c(Cl-)>>c(I-)时,AgCl也可能先析出。当c(Cl-)>2.2×106c(I-)时,AgCl先析出。♦沉淀类型不同,要通过计算确定。原则是:离子积J首先超过溶度积Ks的先沉淀。\n问:有一溶液中含有0.10mol·L-1Li+和0.10mol·L-1Mg2+,滴加F-溶液(忽略体积变化)(1)哪种离子最先被沉淀出来?(2)当第二种沉淀析出时,第一种被沉淀的离子是否沉淀完全?两种离子有无可能分开?\n解:查表Ks(LiF)=1.8×10-3,Ks(MgF2)=7.4×10-11Li+被沉淀为LiF所需F-浓度:c1(F-)=mol·L-1=1.8×10-2mol·L-1Mg2+被沉淀为MgF2所需F-浓度c2(F-)=mol·L-1=2.7×10-5mol·L-1c1(F-)>c2(F-),Mg2+先被沉淀出来。当LiF析出时c1(F-)=1.8×10-2mol·L-1c(Mg2+)=mol·L-1=2.3×10-7mol·L-1Mg2+已沉淀完全,两种离子有可能分离开。\n例:在1.0mol·L-1的ZnSO4溶液中,含有杂质Fe3+,欲使Fe3+以Fe(OH)3形式沉淀除去,而不使Zn2+沉淀,问溶液的pH应控制在什么范围?若溶液中还含有Fe2+,能否同时被除去?如何除去?解:Ks(Zn(OH)2)=1.2×10-17,Ks(Fe(OH)3)=4.0×10-38,Ks(Fe(OH)2)=8.0×10-16,Fe3+完全沉淀时:pH≥3.20\n不使Zn2+生成沉淀的条件是:pH<5.54因此,控制溶液的pH在3.20~5.54之间,便既可除去杂质Fe3+,又不会生成Zn(OH)2沉淀。若溶液中还含有Fe2+,则考虑当溶液的pH为5.54时,Fe2+可以残留在溶液中的浓度:此时Fe2+的浓度很大,所以Fe2+不能同时被除去。\n2沉淀的转化把一种沉淀转化为另一种沉淀的过程,叫做沉淀的转化。Pb(NO3)2NaClPbCl2↓KIPbI2↓(无色溶液)(白色沉淀)(黄色沉淀)Na2CO3PbCO3↓Na2SPbS↓
(白色沉淀)(黑色沉淀)\n例: 将0.010mol的AgCl置于100mL纯水中达到平衡。向此体系中加入0.0050mol的固体KI,达到平衡后,有多少摩尔的AgCl转化为AgI?溶液中Ag+、Cl-、I-的平衡浓度各为多少?(设加入AgCl和KI后,水的体积变化忽略不记,也不考虑Ag+与Cl-、I-形成配离子)解:设每升中有xmol/LAgCl发生转化:AgCl(s)+I-(aq)⇌AgI(s)+Cl-(aq)平衡/(mol·L-1)0.0050×1000/100-xx=0.050-x\nn(AgCl)=c(Cl-)×V总=0.050×0.1=0.005(mol)所加入的AgCl有0.005mol转化成了AgI。\n问:用Na2CO3溶液处理AgI沉淀,使之转化为Ag2CO3沉淀。(1)这一反应的平衡常数是多少?(2)如果在1.0LNa2CO3溶液中要溶解0.010molAgI,Na2CO3的最初浓度应为多少?这种转化能否实现?\n解:Ks(AgI)=8.3×10-17,Ks(Ag2CO3)=8.3×10-122AgI(s)+CO32-(aq)⇌Ag2CO3(s)+2I-(aq)Na2CO3的最初浓度应为:(1.2×1017+1/2×0.010)=1.2×1017mol·L-1由于Na2CO3的饱和浓度远小于1.2×1017mol·L-1,因此这种转化难以实现。