- 2.47 MB
- 2022-08-16 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
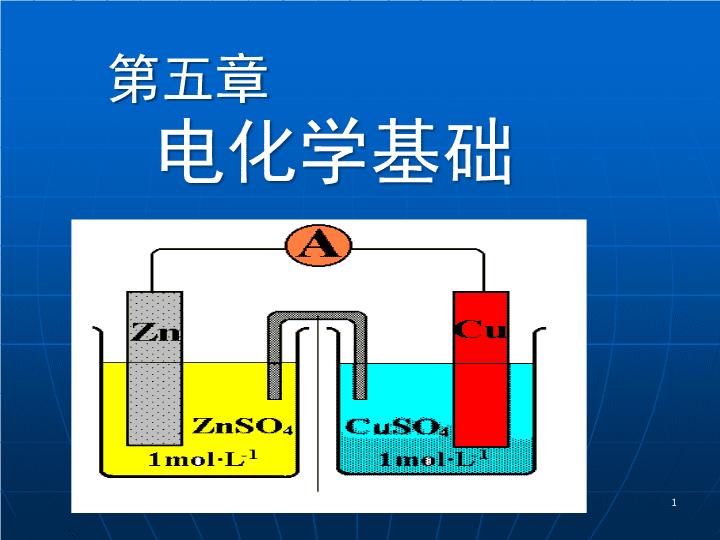
第五章电化学基础1\n电化学电化学是研究化学能和电能相互转化的一门科学.2\n氧化还原过程人类一切生产和生命活动:能量供应问题。煤、石油等燃烧发热营养物质的消化吸收体内的生物化学反应生物电现象(心电、脑电)3\n主要内容5.1氧化还原反应5.2原电池5.3电极电势5.4原电池热力学5.5电解与电化学技术5.6金属的腐蚀与防护4\n5.1氧化还原反应5.1.1氧化还原反应5.1.2氧化还原电对5.1.3氧化还原反应方程式的配平5\n5.1.1氧化还原反应1.定义元素的氧化值发生了变化的化学反应。Sn2++Fe3+→Sn4++Fe2+2.特点(1)存在着氧化剂与还原剂;(2)存在着氧化态与还原态。氧化Ox(氧化态)+neRed(还原态)还原6\n5.1.2氧化还原电对1.电对Ox+ne→Red同种元素的氧化态与还原态构成了氧化还原电对,记作Ox/Red。如Sn4+/Sn2+,Fe3+/Fe2+,一个氧化还原反应由两个氧化还原电对组成。7\n2.电极反应任何氧化还原反应都可拆分为两个氧化还原电对的半反应(半电池反应,电极反应):Fe3++e→Fe2+Sn2+→Sn4++2e氧化-还原反应的实质:两个共轭电对之间的电子转移反应。8\n3.电对拆分:2MnO4-+5H2C2O4+6H+→2Mn2++10CO2+8H2OMnO4-+8H++5e→Mn2++4H2O①H2C2O4→2CO2+2H++2e②MnO4-/Mn2+;CO2/H2C2O49\n5.1.3氧化还原反应方程式的配平离子-电子法1.配平原则:①电荷守恒:反应过程中氧化剂与还原剂得失电子数相等。②质量守恒:反应前后各元素的原子总数相等。10\n2.配平的具体步骤:(1)写出离子方程式:MnO4-+SO32-+H+→Mn2++SO42-+H2O(2)将反应拆分为氧化和还原两个半反应式:还原反应:MnO4-→Mn2+氧化反应:SO32-→SO42-(3)配平:使半反应两边的原子数和电荷数相等MnO4-+8H++5e=Mn2++4H2OSO32-+H2O=SO42-+2H++2e11\n(4)使两个半反应得失电子数为其最小公倍数,合并成一个配平的离子反应式:×2)MnO4-+8H++5e=Mn2++4H2O+×5)SO32-+H2O=SO42-+2H++2e2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2O12\n例1用离子-电子法配平下列氧化还原反应:K2Cr2O7+KI+H2SO4→K2SO4+Cr2(SO4)3+I2+H2O解:先写成离子反应式:Cr2O72-+I-+H+→Cr3++I2+H2O将离子反应式分成两个半反应:I-→I2Cr2O72-+H+→Cr3++H2O分别配平两个半反应:2I-=I2+2eCr2O72-+14H++6e=2Cr3++7H2O13\n使两个半反应得失电子数为其最小公倍数(e=6),合并成一个配平的离子反应式:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O最后写出配平的氧化还原反应方程式:K2Cr2O7+6KI+7H2SO4=Cr2(SO4)3+4K2SO4+3I2+7H2O14\n例2配平下列氧化还原反应:H2S+H2SO3→S+H2OH2S-2e→S+2H+①H2SO3+4H++4e→S+3H2O②①×2+②得:2H2S+H2SO3=3S+3H2O15\n例3:配平Cl2(g)+NaOHNaCl+NaClO3解:Cl2(g)+2e=2Cl-①Cl2(g)+12OH-=2ClO3-+6H2O+10e②①×5+②得:6Cl2(g)+12OH-=10Cl-+2ClO3-+6H2O化简得:3Cl2(g)+6OH-=5Cl-+ClO3-+3H2O3Cl2(g)+6NaOH=5NaCl+NaClO3+3H2O16\n5.2原电池5.2.1原电池的概念5.2.2原电池的符号5.2.3电池电动势5.2.4电极类型17\n5.2.1原电池的概念1.定义原电池是利用氧化还原反应产生电流的装置。2.原电池的构成⑴电势不同的两个电极;⑵盐桥;⑶外电路(检流计)。18\n图1Daniell电池+—e电子由Zn极流向Cu极:Zn极电势低,为负极;Cu极电势高,为正极。3.Daniell电池19\n4.特征正极:氧化剂(Cu2+)被还原,半电池反应为:Cu2++2e→Cu负极:还原剂(Zn)被氧化,半电池反应为:Zn→Zn2++2e电池反应为:Cu2++Zn→Cu+Zn2+20\n5.2.2原电池的符号表示1.书写要求(1)负极写在左边,正极写在右边;(2)正负极之间用盐桥“‖”相接;(3)电极固体标志用一竖线“│”表示;(4)同相之不同物质间用“,”间隔;(5)若为离子时应注明其活度(浓度亦可);(6)若电对不含金属导体,则需加一惰性导体;(7)纯气体、液体或固体与惰性电极名称之间以“,”间隔,并应注明其状态。21\n2.应用示例[例4]将氧化还原反应2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑拆成两个半电池反应,并写出电极组成和电池组成表示式。解(1)根据正极发生还原反应,负极发生氧化反应的原则,拆分此氧化还原反应为两个半电池反应:正极反应:MnO4-+8H++5e→Mn2++4H2O负极反应:H2O2→2H++O2+2e22\n(2)电极组成:正极:Pt│MnO4-(c1),Mn2+(c2),H+(c3)负极:Pt,O2(p)│H2O2(c4),H+(c3)(3)电池符号:(-)Pt,O2(p)│H2O2(c4),H+(c3)‖MnO4-(c1),Mn2+(c2),H+(c3)│Pt(+)23\n5.2.3电池电动势1.定义电池电动势是电池正负极之间的瞬时电势差。(在接近零电流下所测定的电势差)2.表示电池电动势E=E+-E-E+─某时刻正极的电势,E-─某时刻负极的电势。思考:为什么手电筒电光愈用愈暗?因为其电池电动势愈用愈低。24\n5.2.4电极类型1.金属-金属离子电极:Zn|Zn2+(c)电极反应Zn2++2e→Zn2.金属-金属难溶盐-阴离子电极:Ag,AgCl(s)|Cl-(c)电极反应AgCl+e→Ag+Cl-3.双离子电对电极:Pt|Fe2+(c1),Fe3+(c2)电极反应Fe3++e→Fe2+4.气体电极:Pt,Cl2(p)|Cl-(c)电极反应Cl2+2e→2Cl-25\n5.3电极电势5.3.1电极电势的产生5.3.2标准电极电势5.3.3Nernst方程式26\n5.3电极电势5.3.1电极电势的产生1.电极的双电层结构++++++++++----------(a)溶解>沉积++++++++++----------(b)沉积>溶解图-2双电层的形成M(s)Mn+(aq)+ne由于在金属与溶液间的界面处形成双电层结构,电极电势产生了。27\n双电层结构的电极电势为绝对电极电势。2.影响电极电势的因素电极电势的大小与以下因素有关:(1)电极物质的本性;(2)电极物质离子的浓度或气体的分压;(3)温度。28\n5.3.2标准电极电势1.标准氢电极的作用无法直接测出表面电势和相间电势→不能确定电极电势的绝对值。实际中选定一个标准电极,将其电极电势定义为零,即可确定其它电极的电极电势。IUPAC规定,采用标准氢电极作为基准电极。29\n2.标准氢电极的组成StandardHydrogenElectrode,SHE(1)海绵状铂黑作电极导体;(2)H2压力维持100kPa;(3)H+活度为1(1.184mol·L-1);(4)EθH+/H2=0.0000V30\n标准氢电极的组成式可表示为:Pt,H2(100kPa)∣H+(a=1)(5)标准氢电极的组成式(电极符号)铂黑上吸附的H2与溶液中的H+建立如下动态平衡:2H+(aq)+2eH2(g)31\n3.标准电极电势(1)定义处于标准态下的电极的电势称为该电极的标准电极电势(standardelectrodepotential),用符号Eθ表示。(2)标准态溶液活度为1,或气体压力为100kPa,液体和固体为纯净物。32\n4.标准电极电势的测定电池电动势EΘ=E+Θ-E-Θ首先和标准氢电极组成原电池,其次确定被测电极是正极还是负极。若为正极,则其标准电极电势E+Θ=EΘ+EH+/H2Θ=EΘ若为负极,则其标准电极电势E-Θ=EH+/H2Θ-EΘ=-EΘEOx/RedΘ定义为给定电极的标准电极电势(相对值)。33\n标准电极电势的测定例5简述测定Pt|Fe3+(1.0),Fe2+(1.0)的标准电极电势的方法及结果。解将Pt|Fe3+(1.0),Fe2+(1.0)与标准氢电极组成电池。从实验电流的方向确定此待测电极为正极,标准氢电极为负极。测得电动势为0.771V,则EΘ=E+Θ-E-Θ=EΘFe3+/Fe2+-EΘH+/H2式中E的右下角注明了参加电极反应物质的氧化态和还原态,上角的Θ表示标准状态。EΘFe3+/Fe2+=EΘ=0.771V.34\n又:标准锌电极与标准氢电极组成原电池:(-)Zn|Zn2+(1.0)‖H+(1.0)|H2(100kPa),Pt(+)测得此原电池的电动势EΘ=0.7618V,由于EΘ=E+Θ-E-Θ=EΘH+/H2-EΘZn2+/Zn=0-EΘZn2+/Zn∴EΘZn2+/Zn=-0.7618V。35\n5.标准电极电势的物理意义:标准电极电势表中,以标准氢电极为界,氢以上电极的EΘ均为负值,氢以下电极的EΘ均为正值。某电极的EΘ代数值愈小,表示此电对中还原态物质愈易失去电子,即还原能力愈强,是较强的还原剂;若电极的EΘ代数值愈大,表示此电对中氧化态物质愈易得到电子,即氧化能力愈强,是较强的氧化剂。36\n6.标准电极电势表及其应用附录:常见的氧化还原电对的标准电极电势(1)标准电极电势与氧化还原反应的关系1)对比两个氧化还原电对的标准电极电势的大小,便可知道此氧化还原反应在标准态时谁是氧化剂,谁是还原剂。37\n标准电极电势与氧化还原反应的关系2)判断标准态时氧化还原反应自发进行方向:强Ox+强Red→弱Ox+弱Red电极电势愈高,氧化还原电对中的氧化态得到电子变成其还原态的趋势愈强;电极电势愈低,氧化还原电对中的还原态失去电子变成其氧化态的趋势愈强。氧化还原反应的方向:电极电势高的电对的氧化态氧化电极电势低的电对的还原态。38\n例6判断标准状态时下列氧化还原反应自发进行的方向:2Fe2++Br22Fe3++2Br-。解首先,将此氧化还原反应拆成两个半反应,并查出这两个电对的标准电极电势:Fe3++eFe2+EΘFe3+/Fe2+=+0.771VBr2+2e2Br-EΘBr2/Br-=+1.087V其次,找出标准电极电势高的电对中的氧化态(Br2),和标准电极电势低的电对中的还原态(Fe2+),此二者应是该自发反应的反应物。故该反应正向(向右)自发进行。39\n解将此氧化还原反应拆成两个半反应,并查出两个电对的标准电极电势:例7判断标准状态下反应Ag++Fe2+Ag+Fe3+自发进行的方向。Ag++eAgEΘAg+/Ag=+0.7996VFe3++eFe2+EΘFe3+/Fe2+=+0.771V反应系统中较强的氧化剂是Ag+,较强的还原剂是Fe2+,故反应正向(向右)进行。40\n(2)使用标准电极电势表注意事项:1)电极反应均写成:Ox+neRed无论反应物是电对中的氧化态,还是其还原态,氧化还原电对的EΘ的符号不变。2Fe3++Sn2+→2Fe2++Sn4+EΘFe3+/Fe2+=+0.771V2Fe2++Ag+→Fe3++AgEΘFe3+/Fe2+=+0.771V41\n3)EΘ只能判断标准状态下氧化还原反应自发进行的方向。如:Zn2++2eZnEΘ=-0.7618V2Zn2++4e2ZnEΘ≠2×(-0.7618V)2)标准电极电势是强度性质,不具加和性。Ag++eAgEΘAg+/Ag=+0.7996VFe3++eFe2+EΘFe3+/Fe2+=+0.771VAg++Fe2+Ag+Fe3+比较结论:反应正向进行。42\n但如果有Ag+(0.10)+Fe2+(0.10)Ag+Fe3+(1.0)则反应逆向进行。问题:怎样知道在此条件下反应逆向进行?答案:这是比较电极电势的结果。43\n5.3.3Nernst方程式1.电极电势的Nernst方程式2.电池电动势的Nernst方程式3.应用Nernst方程式注意事项44\n5.3.3Nernst方程式—影响电极电势的因素Nernst方程式及浓度对EOx/Red及E的影响标准电极电势:只考虑电极本性的影响,故只能用于标准态下的氧化还原反应。非标准态下,EOx/Red:考虑电极本性、反应物浓度、温度以及溶液的酸度等因素。Nernst方程式:综合了上述影响因素的计算EOx/Red及E的公式。45\n1.电极电势的Nernst方程式对于任一电极反应aOx+nebRed其电极电势的Nernst方程式为:E=EΘ+──ln───RT[Ox]anF[Red]b46\n上式─电极电势的Nernst方程式式中E─电极电势(V)EΘ─标准电极电势(V)R─气体常数(8.314J·K-1·mol-1)F─Faraday常数(96485C·mol-1)T─绝对温度(K)n─电极反应中得(失)电子数(mol)[Ox]a─电极反应中电对氧化态浓度幂的乘积[Red]b─电极反应中电对还原态浓度幂的乘积电极反应中的固体或纯液体,其活度视为1,气体的浓度用其分压表示。47\nE与电极反应物浓度的关系:与电对中氧化态浓度呈正相关;与电对中还原态浓度呈负相关。E=EΘ+──ln───RT[Ox]anF[Red]b当T=298.15K时E=EΘ+────lg───0.05916[Ox]an[Red]b48\n例8已知电极反应Fe3++e=Fe2+,EΘ=0.77V,试分别计算:(1)[Fe3+]/[Fe2+]=10;(2)[Fe3+]/[Fe2+]=1/10时的E值(298K)。解:由Nernst方程可得E=EΘ+0.05916lg([Fe3+]/[Fe2+])(1)当[Fe3+]/[Fe2+]=10时E=0.77+0.05916=0.83VΔE=0.06V(2)当[Fe3+]/[Fe2+]=1/10时E=0.77-0.05916=0.71VΔE=-0.06V当[Fe3+]升高时,E升高,Fe3+的氧化性增强。反之相反。49\n2.电池电动势的Nernst方程式对于任一电池反应aOx1+bRed2cRed1+dOx2其电池电动势的Nernst方程式为:E=EΘ-──lnJRTnF=EΘ-──ln──────RT[Red1]c[Ox2]dnF[Ox1]a[Red2]b=E+Θ–E-Θ+──ln──────RT[Ox1]a[Red2]bnF[Red1]c[Ox2]d50\n在298.15K时,代入有关常数得E=E+Θ–E-Θ+────lg──────0.05916[Ox1]a[Red2]bn[Red1]c[Ox2]d[Ox1]、[Red2]─反应物[Red1]、[Ox2]─产物E与电池反应物浓度的关系:E与电池反应中反应物浓度呈正相关;与电池反应中产物浓度呈负相关。51\n3.应用注意事项(1)除Ox和Red外,若有H+或OH-参加反应,则它们的浓度也应写进Nernst方程式。如MnO4-+8H++5e→Mn2++4H2O298.15K时,E=EΘ+────lg──────0.059165[Mn2+][MnO4-][H+]8(2)无论是计算电极电势,还是计算电池电动势,都必须首先配平反应式。(3)电极的电子转移数往往与电池反应不一致。52\n5.4原电池热力学5.4.1可逆电池5.4.2电池电动势与反应Gibbs函数变5.4.3氧化还原反应中的化学平衡5.4.4电极电势的应用53\n5.4.1可逆电池1.可逆电池2.不可逆电池54\n1.可逆电池(1)热力学上可逆,使电池内部始终无限近于平衡状态;(2)电极反应也是可逆的,即在化学上为可逆反应。如:Dianell电池55\nDianell电池56\nCuH2SO4ZnVolta电池2.不可逆电池不满足可逆电池条件的原电池。57\nVolta电池为不可逆电池:电池符号为Zn|H2SO4|Cu,产生电流时,Zn极溶解,Cu极上有H2气析出。即:Zn+2H+→Zn2++H2若向该电池中施加与其电动势相反外电源,当外电源电动势大于电池电动势时,Cu极上反应是铜极溶解而锌极上有氢气或铜析出:Cu+2H+→Cu2++H2以上两个反应互不相干。58\n5.4.2电池电动势与反应Gibbs函数变对于可逆电池反应:-Gm=We=nFE可得出:Gm=-nFEGѲm=-nFEѲ上式对于电极反应也适应。59\n5.4.3氧化还原反应中的化学平衡标准平衡常数与标准电动势的关系为:ΔrGmΘ=-nFEΘΔrGmΘ=-RTlnKΘ即得-nFEΘ=-RTlnKΘ当T=298.15K时60\n由上式可见,对于一个电池反应,E值越大,K值越大,反应进行越完全;E值越小,K值越小;E<0,K值很小,反应实际不能进行。E可用来判断反应进行的方向和限度。61\n5.4.3电极电势的应用1.设计原电池并计算电池的电动势2.确定氧化剂,还原剂的相对强弱3.判断氧化还原反应进行的方向4.判断氧化还原反应进行的限度62\n例1pH的测定以甘汞电极为参比电极,玻璃电极为指示电极组成原电池1.设计原电池并计算电池的电动势63\n玻璃电极Ag,AgCl(s)|HCl(0.1mol.L-1)|玻璃膜|待测溶液E=Eθ-0.0592pH甘汞电极Hg,Hg2Cl2(s)|KCl(饱和)Hg2Cl2+2e→2Hg+2Cl-E甘汞=Eθ(Hg2Cl2)+0.0592/2lg1/c2(Cl-)=0.2415VE=E甘汞-E玻璃=0.2415-Eθ+0.0592pH64\n[例]计算在298.15K时下列原电池的电动势。(-)Ag|AgNO3(0.01mol·L-1)‖AgNO3(1mol·L-1)|Ag(+)解:这种由不同浓度的同类电极组成的原电池称浓差电池。正极反应:Ag+(1mol·L-1)+eAg(s)负极反应:Ag(s)-eAg+(0.01mol·L-1)电池反应:Ag+(1mol·L-1)Ag+(0.01mol·L-1)∴E+=EΘ(Ag+/Ag)+0.0592lg[Ag+]E-=EΘ(Ag+/Ag)-0.0592lg[Ag+]E=E+-E-=0.0592lg([Ag+]+/[Ag+]-)=0.0592lg(1/0.01)=0.1184V65\n2.确定氧化剂,还原剂的相对强弱标准电极电势值的符号和大小,反映了该电极与氢电极相比较的氧化还原能力的强弱。代数值越小,其还原态越易失去电子,还原性越强;代数值越大,其氧化态越易得到电子,氧化性越强。几种物质可能同时发生氧化还原反应时,则数值相差越大,其相互反应的趋势就越大。66\n例试列出Eθ(MnO4-/Mn2+)=1.5VEθ(Cu2+/Cu)=0.337VEθ(I2/I-)=0.534VEθ(Sn4+/Sn2+)=0.154V各电对氧化型物种的氧化能力和还原型物种的还原能力的强弱顺序。67\n解:比较电对的标准电极电势的代数大小,可知,随着Eθ值的增大,电对中的氧化型物种得电子的能力(即氧化能力)增强,而电对中的还原型物种失电子的能力(即还原能力)减弱。因此:氧化型物种氧化能力由强到弱的顺序是:MnO4->I2>Cu2+>Sn4+还原型物种的还原能力由强到弱的顺序是:Sn2+>Cu>I->Mn2+68\n由EΘ值的相对大小可知,氧化性:F2>Cl2>Br2>I2还原性:I->Br->Cl->F-F2+2e2F-EΘ=2.87VCl2+2e2Cl-EΘ=1.36VBr2+2e2Br-EΘ=1.07VI2+2e2I-EΘ=0.54V如卤族元素之间的置换反应,即可从EΘ值的变化加以解释:69\n例要选择一种氧化剂能使Cl-和Br-的混合溶液中的Br-氧化成Br2,但Cl-不变化,试确定在常用的氧化剂KMnO4和K2Cr2O7中,选择何种为宜?解:查标准电极电势表Cr2O72-+14H++6e2Cr3++7H2OEΘ=1.23VMnO4-+8H++5eMn2++4H2OEΘ=1.51V由EΘ值可知,标准状态下,KMnO4能将Cl-和Br-都氧化;而K2Cr2O7只能氧化Br-,不能氧化Cl-,故选择K2Cr2O7为宜。Br2+2e2Br-EΘ=1.07VCl2+2e2Cl-EΘ=1.36V70\n3.判断氧化还原反应进行的方向任何一个氧化还原反应,原则上都可设计成原电池,利用原电池电动势的正负可以判断氧化还原反应进行的方向。注:只有在标准状态下,才可直接由标准电极电势来判断氧化还原反应的方向。-ΔrGm=W′=nFE若ΔrGm<0,E>0,则反应正向自发进行;ΔrGm>0,E<0,则反应逆向自发进行;ΔrGm=0,E=0,则反应处于平衡状态。71\n例当[Pb2+]=0.010mol·L-1,[Sn2+]=0.50mol·L-1时,金属锡能否从溶液中将Pb2+还原出来?已知E(Pb2+/Pb)=-0.126V,E(Sn2+/Sn)=-0.136V。解:根据电池反应式Pb2++Sn=Pb+Sn2+应用Nernst方程,E=E+Θ–E-Θ+──ln──────RT[Ox1]a[Red2]bnF[Red1]c[Ox2]d=E(Pb2+/Pb)–E(Sn2+/Sn)+───lg──0.0592[Pb2+]2[Sn2+]=-0.126–(-0.136)+───lg──0.05920.01020.50=-0.041V故金属锡不能从溶液中将Pb2+还原出来。72\n例13判断下列反应在298.15K时自发进行的方向:
Fe+Cu2+Fe2++Cu其中[Cu2+]=0.10mol·L-1,[Fe2+]=1.0mol·L-1。解(思路:电极电势比较法)Fe2+/Fe:电极反应式:Fe2++2eFeEFe2+/Fe=EFe2+/FeΘ+────lg[Fe2+]0.059162=-0.4402+────lg1.00.059162=-0.4402V73\nCu2+/Cu:电极反应式Cu2++2eCuECu2+/Cu=ECu2+/CuΘ+────lg[Cu2+]0.059162=+0.337+────lg0.100.059162=+0.307V>EFe2+/Fe故Cu极应为正极,又Cu2+/Cu电对中氧化态(氧化剂)为正向反应物,故此反应在298.15K时正向自发进行。74\n例14根据下列反应组成电池,写出电池组成式,计算在298.15K时电池电动势,并判断反应自发进行的方向:
2Cr3+(0.010mol·L-1)+2Br-(0.10mol·L-1)2Cr2+(1.0mol·L-1)+Br2(l)解(思路:电动势正负法):假设反应按所写方程式正向进行,则电池组成式为:(-)Pt,Br2(l)|Br-(0.10mol·L-1)‖Cr3+(0.010mol·L-1),2Cr2+(1.0mol·L-1)|Pt(+)E=EΘCr3+/Cr2+-EΘBr2/Br-+———lg──────0.059162[Cr2+]2[Cr3+]2[Br-]2=-0.408-1.087+0.05916lg──────0.010×0.101.0=-1.672V<0该反应逆向自发进行。75\n4.确定氧化还原反应进行的限度反应限度通过平衡常数的大小加以判断。平衡常数与标准电动势的关系为:ΔrGmΘ=-nFEΘΔrGmΘ=-RTlnKΘ即得-nFEΘ=-RTlnKΘ当T=298.15K时76\n在一定温度下,平衡常数只与反应物质的本性有关,而与反应物的浓度无关。平衡常数KΘ>105时,反应进行得很完全。计算平衡常数时,必须注意n值的正确选用。因为同一个电池反应,计量系数不同时有不同的电子转移数n。例如Fe+2H+Fe2++H2n=2Fe+H+Fe2++H2n=177\n例15求KMnO4与H2C2O4的反应平衡常数KΘ(298.15K)。解反应方程式为2MnO4-+5H2C2O4+6H+→2Mn2++10CO2+8H2O拆成半反应:MnO4-+8H++5eMn2++4H2OE+Θ=+1.507VH2C2O42CO2+2H++2eE-Θ=-0.49V配平后的氧化还原方程式电子转移数为10,lgKΘ=────=─────0.059160.05916nEΘn(E+Θ-E-Θ)=————————=33810[1.507-(-0.49)]0.05916KΘ=10338>>105。78\n例16测定298.15K时AgCl的KspΘ值。解用Ag|Ag+和Ag,AgCl|Cl-电极组成电池。Ag++eAgEAg+/AgΘ=+0.7996VAgCl+eAg+Cl-EAgCl/AgΘ=+0.2222V电池组成为(-)Ag,AgCl|Cl-(1mol·L-1)‖Ag+(1mol·L-1)|Ag(+)电池反应式为Ag++Cl-AgCl(s)n=1电池电动势E=EΘ=E+Θ-E-Θ=0.7996-0.2222=+0.5774V79\n此电池反应的标准平衡常数:lgKΘ=────=─────0.059160.05916nEΘn(E+Θ-E-Θ)=————=9.7601×0.57740.05916KΘ=5.75×109AgCl的溶度积为KspΘ=1/KΘ=1/(5.75×109)=1.74×10-10。80\n5.5电解与电化学技术5.5.1电解装置与原理5.5.2电解产物的判断5.5.3电化学技术81\n5.5.1电解装置与原理1.电解借助电能使不能自发进行的氧化还原化学反应得以进行的过程。2.电解池电解的装置称为电解池。电解装置82\n3.阴极与外电源负极相连接的电极称为阴极。电解池中正离子移向阴极,在阴极上得到电子,发生还原反应。4.阳极与外电源正极相连接的电极称为阳极。电解池中负离子移向阳极,在阳极上给出电子,发生氧化反应。离子在相应电极上得失电子的过程均称放电。。83\n5.5.2电解产物的判断1.判断依据和一般规律2.分解电压84\n电解熔融电解质很简单,而水溶液中含H+,OH-,则复杂。1.判断依据和一般规律(1)在阴极何种正离子电极电势高,则被还原。Cu2+,Hg2+,Ag+,Pt2+,Au+电极电势>0,析出金属;Sn2+,Pb2+,Fe2+,Ni2+,Zn2+电极电势<0,同样析出金属。(2)在阳极何种负离子电极电势低,则被氧化。S2-,Cl-,Br-,I-。E=EΘ+──ln───RT[Ox]anF[Red]b85\n[例5-14]为什么电解Na2SO4水溶液相当于电解水?解:阴极:H+,Na+→H2;阳极:OH-,SO42-EΘ(O2/OH-)=+0.401VEΘ(S2O82-/SO42-)=+2.010V故阳极:→O2,电解Na2SO4水溶液相当于电解水。86\n2.分解电压(1)理论分解电压克服电解分解产物构成的原电池的电动势所需的电解池外加电压。(2)实际分解电压由于电极极化导致的实际上高于理论值的最低分解电压。87\n(3)超电压:由于极化现象而产生的实际分解电压与理论分解电压之差。
例:用铂做电极,电解NaCl的饱和溶液,试指出两电极上的产物。88\n解:溶液中存在四种离子:Na+、Cl-、H+和OH-等。通电后,正离子Na+、H+移向阴极,标准电极电势分别为:EΘ(Na+/Na)=-2.71V,EΘ(H+/H2)=0.0000V电极电势代数值大的氧化剂容易得到电子,故H+离子在阳极放电,生成氢气逸出;2H++2e-→H2(g)89\n负离子Cl-、OH-移向阳极,EΘ(Cl2/Cl-)=1.35827V,EΘ(O2/OH-)=0.401V电极电势代数值小的还原剂易失电子,本该OH-离子首先放电,有O2(g)析出;但由于①NaCl饱和溶液,c(Cl-)>>c(OH-);②电极材料对析出O2的超电压要比析出Cl2大得多,结果是Cl-离子在阳极放电,生成氯气逸出:2Cl--2e-→Cl2(g)90\n因此,电解NaCl饱和溶液的总反应为2NaCl+2H2O═Cl2+H2+2NaOH即在两极上分别得到氢气和氯气,溶液中产生NaOH(烧碱)。电化学工业氯碱工业的基本化学原理。91\n例工业上精炼铜时,以铜作电极,电解CuSO4水溶液,试指出两电极上的电解产物。92\n解:溶液中存在着四种离子,即Cu2+、SO42-、H+、OH-,通电后,Cu2+和H+移向阴极,EΘ(Cu2+/Cu)=0.3419V,EΘ(H+/H2)=0.0000V所以Cu2+在阴极得电子析出Cu,电极反应为:Cu2++2e-→Cu93\n溶液中移向阳极的SO42-、OH-和铜电极都可能发生氧化反应。EΘ=(Cu2+/Cu)=0.3419VEΘ(S2O82-/SO42-)=2.010VEΘ=(O2/OH-)=0.401V其中EΘ代数值小的还原物质为Cu,首先在阳极失去电子,变为Cu2+,发生阳极溶解,即:Cu-2e-→Cu2+总反应为:Cu(阳极)→Cu(阴极)94\n5.5.3电化学技术-电解原理的应用1.电镀2.电铸3.电抛光4.电解加工5.铝阳极氧化95\n1.电镀(1)定义电镀是应用电解的方法将金属覆盖到一种载体表面上的过程。(2)作用抗腐蚀,装饰(3)种类1)①槽镀;②电刷镀(镀层物质溶液移动)2)①单金属镀;②合金镀:多种金属同时沉积到工件表面(满足E值相近:Co和Ni,Pb和Sn)E值不相近:电镀黄铜96\n电镀黄铜(Cu和Zn合金):EΘ(Zn2+/Zn)=-0.7618V,EΘ(Cu2+/Cu)=0.3419V,EΘ(Cu+/Cu)=0.522V,EΘ相差甚远。[Zn(CN)4]2-Zn2++4CN-K不稳Θ=2.0×10-17[Cu(CN)3]2-Cu++3CN-K不稳Θ=2.6×10-2997\n镀锌将金属制件(被镀件)作阴极,锌板作为阳极。为了使镀层结晶细致,厚薄均匀,与基体结合牢固,电镀液通常用配合物碱性锌酸盐镀锌或氰化物镀锌等。碱性锌酸盐可离解出少量的Zn2+:Na2[Zn(OH)4]——2Na++[Zn(OH)4]2-[Zn(OH)4]2-——Zn2++4OH-98\n由于Zn2+的浓度比较低,故使金属晶体在镀件上析出时晶核生长速率小,有利于新晶核的生长,从而得到致密、均匀的光滑镀层。镀锌丝铁钉99\n2.电铸(1)定义以电化学原理实现铸造的方法。(2)特点①铸层与模体易于分离;②镀层浑厚。3.电抛光(1)定义利用电解作用进行抛光,使金属变得平滑和有光泽的过程。(2)特点①自动化程度高;②耐腐蚀性好;③无微断裂纹。100\n(3)原理阳极金属表面上凸出部分在电解过程中的溶解速率大于凹入部分的溶解速率。黏性薄膜电解液黏性薄膜电解液101\n4.电解加工电解加工是利用金属在电解液中可以发生阳极溶解的原理,将工件加工成型。102\n5.6金属的腐蚀与防护当金属和周围介质接触时,由于发生化学和电化学作用而引起的破坏叫做金属腐蚀。金属腐蚀分类:化学腐蚀,电化学腐蚀。5.6.1金属的腐蚀1.化学腐蚀2.电化学腐蚀5.6.2金属的防蚀103\n1.化学腐蚀1)定义单纯由化学作用而引起的腐蚀称为化学腐蚀。例:金属与空气中的氧、氯、硫化氢等气体的作用;银在碘蒸气中的反应。2)特点腐蚀过程中无电流产生,腐蚀产物直接生成在腐蚀性介质接触的金属表面。104\n3)影响因素金属的本性、腐蚀介质的浓度和温度。铁在800∼1000℃时显著氧化,生成的氧化皮,并发生脱碳现象。Fe3C+O2=3Fe+CO2Fe3C+CO2=3Fe+2COFe3C+H2O=3Fe+CO+H2105\n2.电化学腐蚀1)电化学腐蚀2)腐蚀电池分类(1)宏观电池(2)微观电池106\n1)电化学腐蚀金属的电化学腐蚀的机理与原电池原理相同,称为腐蚀电池。习惯上把腐蚀电池的负极(失电子的电极)称为阳极,把正极(得电子的电极)称为阴极。107\n(1)宏观电池—有独立的两极,可用肉眼分辨出正、负极。例如铝板上铆铜钉就会形成宏观电池。108\n(2)微观电池微观电池无明显分立的两极,肉眼不能分辨。①特点:A.形成的微电池数目,电极多,两极间的距离近;B.腐蚀速率很快,腐蚀程度严重。②分类:根据在阴极上获得电子的物质的不同分成A.析氢腐蚀B.吸氧腐蚀C.差异充气腐蚀。109\nA.析氢腐蚀:
腐蚀过程中的阴极上有氢气析出的腐蚀。阴极2H++2e=H2阳极M-ne=Mn+110\nB.吸氧腐蚀阴极O2+2H2O+4e4OH-阳极M-neMn+111\n③差异充气腐蚀金属吸氧腐蚀的一种形式,它是由于在金属表面氧气分布不均匀而引起的。半浸在海水中的金属,在金属浸入面处,因氧的扩散途径短,故氧的浓度高,而在水的内部,氧的扩散途径长,氧的浓度低。ab112\n根据电极反应:O2+2H2O+4e4OH-氧气的分压对电极电势的影响为在氧气的分压较大处,相应的电极电势值较大,在氧气的分压较小处,相应的电极电势值较小。113\n水边缘处Fe为阴极:O2+2H2O+4e4OH-水内部的Fe为阳极:Fe–2eFe2+Fe2+离子向水滴边缘移动,形成Fe(OH)2,并进一步被空气氧化成Fe(OH)3及其脱水产物Fe2O3是红褐色铁锈的主要成分)。浓差腐蚀是金属腐蚀中常见的现象,如埋在地下的金属管道的腐蚀、海水对船坞的水线腐蚀等。114\n5.6.2金属的防蚀1.改善金属的本质2.形成保护层3.改善腐蚀环境4.电化学保护法5.腐蚀的应用115\n1.改善金属的本质根据不同的用途选择不同的材料组成耐蚀金,或在金属中添加合金元素;提高其耐蚀性,可以防止或减缓金属的腐蚀。如,不锈钢。116\n2.形成保护层工业上普遍应用的保护层有非金属保护层和金属保护层两大类。用化学方法,物理方法和电化学方法实现的。(1)金属的磷化处理(2)金属的氧化处理(3)电化学氧化法(4)非金属涂层(5)金属保护层117\n(1)金属的磷化处理钢铁制品去油、除锈后,放入特定组成的磷酸盐溶液中浸泡,即可在金属表面形成一层不溶于水的磷酸盐薄膜,这种过程叫做磷化处理。118\n(2)金属的氧化处理将钢铁制品加到NaOH和NaNO3的混合溶液中,加热处理,其表面即可形成一层蓝色氧化膜(主要成分为Fe3O4),以达到防蚀目的,此过程称为发蓝处理。特点:较大的弹性和润滑性,不影响零件精度。常用于精密仪器的部件的处理。119\n(4)非金属涂层用非金属物质涂覆在金属表面上形成保护层。120\n(5)金属保护层以一种金属镀在被保护的另一种金属制品表面上形成保护镀层。前一种金属称镀层金属。121\n3.改善腐蚀环境在腐蚀介质中添加能降低腐蚀速率的物质(称缓蚀剂)的防蚀方法叫做缓蚀剂法。(1)无机缓蚀剂(2)有机缓蚀剂122\n(1)无机缓蚀剂在中性介质中使用的无机缓蚀剂有NaNO2、K2Cr2O7、Na3PO4等。在碱性介质中使用的NaNO2、NaOH、Na2CO3、Ca(HCO3)2等。123\n作用原理Ca(HCO3)2在碱性介质中发生如下反应:Ca2+十2HCO3-十2OH-=CaCO3(s)十CO32-十2H2O生成的难溶碳酸盐覆盖于阳极表面,成为具有保护性的薄膜,阻滞了阳极反应,降低了金属的腐蚀速率。124\n(2)有机缓蚀剂在酸性介质中,通常使用有机缓蚀剂。如琼脂、糊精、动物胶、六次甲基四胺以及含氮、硫的有机物等。作用原理:金属将缓蚀剂的离子或分子吸附在表面上,形成一层难溶而腐蚀性介质又难透过的保护膜,阻碍了H+得电子的阴极反应,因而减慢了腐蚀。125\n4.电化学保护法1)牺牲阳极保护法2)外加电流法126\n1)牺牲阳极保护法牺牲阳极保护法是用电极电势比被保护金属更低的金属或合金做阳极,固定在被保护金属上,形成腐蚀电池,被保护金属作为阴极而得到保护。牺牲阳极一般常用的材料有铝、锌及其合金。127\n128\n2)外加电流法将被保护金属与另一附加电极作为电解池的两个极,使被保护的金属作为阴极,在外加的直流电的作用下阴极得到保护。129\n5.腐蚀的应用130\n本章作业P2211.(3)(5)2.(a)(b)4.(1)5.10.11.13.131