- 2.47 MB
- 2022-04-26 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
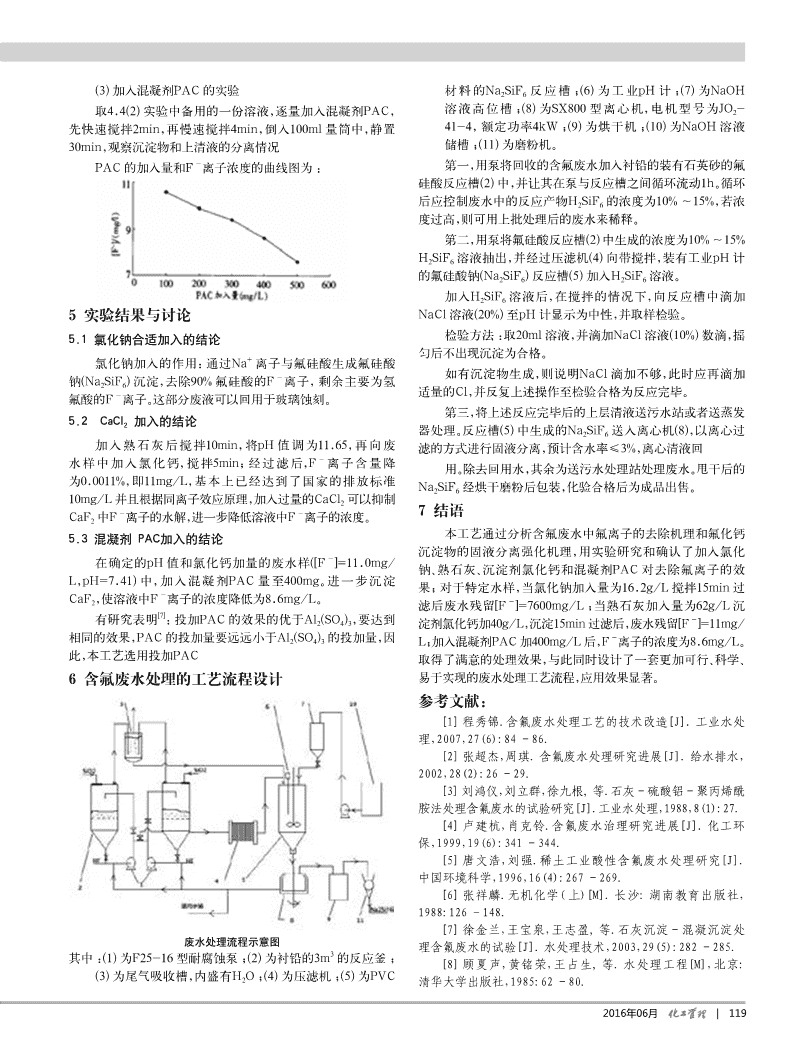
玻璃减薄蚀刻工序产生的含氟废水处理工艺研究招霖济肖俊贤李景超(东莞市和利精细化工有限公司,广东东莞523000)摘要:根据东莞某公司在电子玻璃面板减薄蚀刻工序产生的含氟废水,在分析其成分及含量的基础上,探讨该类含氟废水的处理原理及工艺流程,相应实验表明:该类废水首先用钠盐NaCl为沉淀剂,沉淀出部分的氟离子,然后将沉淀生成物Na2SiF6通过离心和过滤去除,然后滤液用熟石灰调节pH值,加入氯化钙沉淀滤液中的氟离子,最后加入混凝剂PAC处理,废水的氟离子浓度经处理后下降到10mg/L以下,达到国家污水综合排放的一级标准。关键词:含氟废水;原理;工艺;氯化钠;混凝剂;氟离子1研究背景与其他硅基材和多晶硅反应。随着小米、I-PHONE等智能手机的普及,产品日趋轻薄反应方程式如下:SiO2+6HF→H2SiF6+2H2O化,智能手机等便携式设备中广泛应用玻璃显示屏,显示屏的鉴于氢氟酸会对二氧化硅刻蚀速率难以进行控制,一般使厚度越来越低,甚至降低至了0.3mm以下。玻璃基板中的蚀刻用稀释后的氢氟酸溶液,或者可以在其中添加缓冲剂形成混合减薄工艺成了重要的环节,减薄效果直接影响产品的质量,目液,缓冲剂成分为氟化氢氨,可以补充消耗的氟化物离子确保前通常使用以氢氟酸为主要成分的蚀刻液进行玻璃蚀刻减薄刻蚀速率能够更加稳定。处理,随着反应的不断深化,会使腐蚀溶液中的HF浓度降低,3脱除氟离子的反应原理但H2SiF6含量增加,浓度达到10%~15%时,此时蚀刻液粘度3.1氟离子的去除机理会有所增加,导致薄蚀刻效果变差,无法继续蚀刻最终变为了危废液体,需要进行无害化处理。氟离子机理包含的内容有两部分,分别是生成难溶的氟化查阅《污水综合排放标准》(GB8978-1996),规定了废水物质,处理工艺一经开始就会将氟离子浓度降低;使用同离子中氟离子浓度排放限值:一级标准10mg/L。因此,需要对含氟效应,并添加强化电解质,使氟离子浓度进一步降低,确保废水废水进行处理,达标后才能排放。排放更加稳定。当前,处理的含氟废水方法与工艺非常多,化学沉淀法、(1)固化沉淀脱除氟离子-吸附法、离子交换法、混凝沉淀法是非常常见的,但是各有优缺该类废液如果直接采用石灰中和处置,废液中的F、2-点。本论文以上述特定的含氟废水为研究目标,在对相关废液SiF6离子以及pH值等可以达到排放标准,但会产生大量的的成分及含量进行分析基础上,对减薄蚀刻原理及氟离子脱除CaSO4、CaF2的混合固体,属于危险废物,后续处置的成本极原理的进行研究,并经实验证实,初步组合了一套有效的无害高。基于此点,本工艺分成两步沉淀,分别选择使用不同沉淀化处理工艺,保证了处理后的氟离子浓度达到国家规定的一级剂,详细处理机理如下。排放标准要求(10mg/L)。第一步沉淀:使用NaCl或KCl使废液中H2SiF6以2玻璃减薄蚀刻的反应原理与过程Na2SiF6或K2SiF6形成沉淀,Na2SiF6和K2SiF6在酸液中不溶解,分离后酸液可以循环再利用,还可以对固体Na2SiF6、当前,酸蚀刻处理方法较为常用的是玻璃减薄蚀刻法,应K2SiF6进一步处理,生成其他含氟的产品,这样在处理中就基用的原理为:准备HF混酸溶液,与玻璃中二氧化硅和其他金本实现了“零排放”,该工艺具有较好的前景。属氧化物反应,会在玻璃表面进行剥离,这样就实现了对玻璃第二步沉淀:将剩下的游离氟离子形成溶解度低的氟的减薄与强化的效果。化学反应方程式为:化物盐,并对其进行固化,使其形成沉淀从溶液去除,对各种4HF+SiO2→SiF4+2H2O(1)氟化物研究发现,最适宜的选择是CaF2,原因是:溶度积小,SiF4+2HF→H2SiF6(2)Ksp=4.0×10-11(25℃);来源较广、价格较低和具有较低的废玻璃减薄液基本的配比方法为:15%~30%HF、水的处理成本。1%~5%H2SO4、3%~10%HCl以及5%~20%NH4HF2,由(1)、根据纯水中CaF2的溶解平衡反应式:CaF2Ca2++2F-(2)式可以发现,随着减薄溶液中的HF含量度降低,H2SiF6含将25℃作为计算参数,可将CaF2溶解反应的溶度积公式量不断增加,其浓度达到了10%~15%的范围时,将增加蚀刻得出:液粘度,导致减薄处理效果减弱,需更换新的蚀刻液,产生的废2+-223蚀刻液较为常见的组成有:8%~13%HF、10%~15%H2SiF6、Ksp=[Ca]×[F]=[C]×[2C]=4C2+-2+-5%~6%H2SO4、2%~3%HCl以及5%~8%的NH4HF2。式中:[Ca]、[F]分别为:平衡浓度—Ca、F,mol/L;CaF2-蚀刻液加入硫酸和盐酸的原因是在蚀刻反应进行一段时的平衡浓度—C,mol/L。将CaF225℃时的Ksp=4.0×1011-4间后,玻璃表面会生成不溶物氟硅酸盐,阻止蚀刻反应,玻璃表代入公式中得出:C=2.15×10mol/L,此时的CaF2-面会蚀刻不均匀,而硫酸和盐酸可溶解不溶物,蚀刻效果会更溶解反应达到平衡时F的浓度为:--43好。玻璃的蚀刻主要是HF酸溶液能与二氧化硅反应,但不会[F]=2×C=2×2.15×10×19.0×10=8.17mg/L2016年06月|117n理论·实践8.17mg/L为氟离子水中的理论浓度(25℃时),但是实际2~3,氟离子浓度为16784mg/L左右。含氟废水存在复杂性,这就导致了处理以后的废水氟离子浓度4.4实验步骤会超出理论值,需要再次深度处理氟离子。(1)加氯化钠沉淀的实验(2)借助同离子效应,能够使氟离子浓度再次降低,相关理用药匙取6.48g氯化钠,溶于适量水中,并搅拌至全部溶论为:解,后将溶液稀释至32.4g备用。向难溶电解质的饱和溶液添加含有共同离子的强电取400g含氟废水溶液,将32.4g备用的氯化钠溶液加入解质,使平衡向沉淀方向发生移动,降低其体系中难溶电至上述溶液中,并用搅拌15min。解质的离子浓度,以25℃CaF2溶解体系为例:在平衡体将上述溶液经过滤得到清液后,将溶液分成两份,其中一系中加入易溶电解质CaCl2,加入CaCl2的量为1.0mol/2+2+份装入样品瓶中,标签为样品1,另一份备用。(附样品1的检测L且完全电离,则溶液中Ca浓度为:[Ca]=1.0+C,2+-22报告)根据Ksp=[Ca]×[F]=[1.0+C]×[2C],因为Ksp数值很小,导致C的值也很小,因此[1.0+C]≈1.0,可-112-6得:Ksp≈4.0×10=1.0×4C由此C=3.16×10mol/L,此时,进而能够得出平衡体系的溶液中氟离子质量浓--63度:[F]=2×C=2×3.16×10×19.0×10=0.12mg/L依此-类推可得,当加入CaCl2的量为0.1mol/L时,[F]=0.38mg/-L;当加入CaCl2的量为0.01mol/L时,[F]=1.2mg/L;当-加入CaCl2的量为0.001mol/L时,[F]=3.8mg/L。由此,在CaF2溶解反应的平衡体系中,增大共同离子电解质CaCl2的量,就会降低平衡体系溶液氟离子浓度,由此,在深化进行含氟废水处理过程中,适当增加强电解质CaCl2,这对于降低氟离子浓度有着显著作用。3.2氟离子进行两次沉淀和同离子效应加强沉淀后,需要对生成的沉淀物CaF2[7]从溶液中分离出来。从徐金兰的文献中可知,反应生成的CaF2沉淀物是一种细微分散的胶体颗粒,其粒径较小,通常都低于3um,占总颗粒比重的60%左右。由斯托克斯定律可知,(2)加入氯化钙沉淀的实验颗粒的半径与其沉降速率成正相关,其粒径越小,沉降速率越取4.4(1)实验中备用的一份溶液,将12.4g氢氧化钙加入慢。因此,CaF2自然沉降速度缓慢,需要加强固液分离效率与溶液中调节PH值,并搅拌10min,最后取4g氯化钙加入到溶效果,这样才能将处理效率与效果增强。液,并搅拌5min后过滤。增强CaF2沉淀物从溶液中分离效率与效果过程为:在经过过滤得到清液后,将溶液分成两份,其中一份装入样CaF2沉淀物生成后,在废水中添加适量的混凝剂,能够将微粒品瓶中,标签为样品2。(附样品2的检测报告)另一份备用。溶液沉降速度增加,从而更好的去除悬浮物。混凝是水中胶体和细小悬浮物聚集的过程,是凝聚和絮凝的总称。在加入强电解质后产生压缩双层电层作用,导致胶体颗粒失去稳定性产生凝聚作用;胶体脱稳以后,高分子物质在胶体颗粒之间架桥,产生絮凝作用。当使用的是PAC混凝剂时,能跟氟离子生成铝氟络合物,能够将氟离子进一步去除。4实验过程4.1应用的主要仪器设备实验使用的搅拌器为JB-1型磁力搅拌器、配合使用PXS-215型数字型离子计、使用氟化镧单晶膜氟离子电极、222型甘汞参比电极、pHS-25型pH计、天平为T500型的。4.2应用的主要药剂NaCl、CaCl、PAC、Ca(OH)24.3含氟废水水样使用的含氟废水水样来自于广东某公司,其pH值为118|2016年06月n(3)加入混凝剂PAC的实验材料的Na2SiF6反应槽;(6)为工业pH计;(7)为NaOH取4.4(2)实验中备用的一份溶液,逐量加入混凝剂PAC,溶液高位槽;(8)为SX800型离心机,电机型号为JO2-先快速搅拌2min,再慢速搅拌4min,倒入100ml量筒中,静置41-4,额定功率4kW;(9)为烘干机;(10)为NaOH溶液30min,观察沉淀物和上清液的分离情况储槽;(11)为磨粉机。PAC的加入量和F-离子浓度的曲线图为:第一,用泵将回收的含氟废水加入衬铅的装有石英砂的氟硅酸反应槽(2)中,并让其在泵与反应槽之间循环流动1h。循环后应控制废水中的反应产物H2SiF6的浓度为10%~15%,若浓度过高,则可用上批处理后的废水来稀释。第二,用泵将氟硅酸反应槽(2)中生成的浓度为10%~15%H2SiF6溶液抽出,并经过压滤机(4)向带搅拌,装有工业pH计的氟硅酸钠(Na2SiF6)反应槽(5)加入H2SiF6溶液。加入H2SiF6溶液后,在搅拌的情况下,向反应槽中滴加5实验结果与讨论NaCl溶液(20%)至pH计显示为中性,并取样检验。5.1氯化钠合适加入的结论检验方法:取20ml溶液,并滴加NaCl溶液(10%)数滴,摇匀后不出现沉淀为合格。+氯化钠加入的作用:通过Na离子与氟硅酸生成氟硅酸-如有沉淀物生成,则说明NaCl滴加不够,此时应再滴加钠(Na2SiF6)沉淀,去除90%氟硅酸的F离子,剩余主要为氢-适量的Cl,并反复上述操作至检验合格为反应完毕。氟酸的F离子。这部分废液可以回用于玻璃蚀刻。第三,将上述反应完毕后的上层清液送污水站或者送蒸发5.2CaCl2加入的结论器处理。反应槽(5)中生成的Na2SiF6送入离心机(8),以离心过加入熟石灰后搅拌10min,将pH值调为11.65,再向废滤的方式进行固液分离,预计含水率≤3%,离心清液回-水样中加入氯化钙,搅拌5min;经过滤后,F离子含量降用。除去回用水,其余为送污水处理站处理废水。甩干后的为0.0011%,即11mg/L,基本上已经达到了国家的排放标准Na2SiF6经烘干磨粉后包装,化验合格后为成品出售。10mg/L并且根据同离子效应原理,加入过量的CaCl2可以抑制--7结语CaF2中F离子的水解,进一步降低溶液中F离子的浓度。本工艺通过分析含氟废水中氟离子的去除机理和氟化钙5.3混凝剂PAC加入的结论沉淀物的固液分离强化机理,用实验研究和确认了加入氯化-在确定的pH值和氯化钙加量的废水样([F]=11.0mg/钠、熟石灰、沉淀剂氯化钙和混凝剂PAC对去除氟离子的效L,pH=7.41)中,加入混凝剂PAC量至400mg。进一步沉淀果;对于特定水样,当氯化钠加入量为16.2g/L搅拌15min过-CaF2,使溶液中F离子的浓度降低为8.6mg/L。-滤后废水残留[F]=7600mg/L;当熟石灰加入量为62g/L沉[7]有研究表明:投加PAC的效果的优于Al2(SO4)3,要达到淀剂氯化钙加40g/L,沉淀15min过滤后,废水残留[F-]=11mg/相同的效果,PAC的投加量要远远小于Al2(SO4)3的投加量,因L;加入混凝剂PAC加400mg/L后,F-离子的浓度为8.6mg/L。此,本工艺选用投加PAC取得了满意的处理效果,与此同时设计了一套更加可行、科学、6含氟废水处理的工艺流程设计易于实现的废水处理工艺流程,应用效果显著。参考文献:[1]程秀锦.含氟废水处理工艺的技术改造[J].工业水处理,2007,27(6):84-86.[2]张超杰,周琪.含氟废水处理研究进展[J].给水排水,2002,28(2):26-29.[3]刘鸿仪,刘立群,徐九根,等.石灰-硫酸铝-聚丙烯酰胺法处理含氟废水的试验研究[J].工业水处理,1988,8(1):27.[4]卢建杭,肖克铃.含氟废水治理研究进展[J].化工环保,1999,19(6):341-344.[5]唐文浩,刘强.稀土工业酸性含氟废水处理研究[J].中国环境科学,1996,16(4):267-269.[6]张祥麟.无机化学(上)[M].长沙:湖南教育出版社,1988:126-148.[7]徐金兰,王宝泉,王志盈,等.石灰沉淀-混凝沉淀处废水处理流程示意图理含氟废水的试验[J].水处理技术,2003,29(5):282-285.3其中:(1)为F25-16型耐腐蚀泵;(2)为衬铅的3m的反应釜;[8]顾夏声,黄铭荣,王占生,等.水处理工程[M],北京:(3)为尾气吸收槽,内盛有H2O;(4)为压滤机;(5)为PVC清华大学出版社,1985:62-80.2016年06月|119