- 238.50 KB
- 2021-04-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
高三化学二轮复习小专题——实验方案的设计与评价
化学实验方案的设计与评价是高考压轴大题,也是学生最头痛的题目,要很好地解答此类题目,必须先明确实验目的,再根据已学知识,设想探究、验证所需原理,最后根据所涉及原理,从题干中获取有效信息,进一步确定实验方案,再将方案代入题目,进行复合验证。
题组1 化学实验方案的设计
把握制备实验方案设计的思维流程,明确物质制备实验设计的注意事项及“四防”安全问题。
例1. 甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。
(1)为了探究现象II的原因,甲同学进行如下实验:①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在 。②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液。甲同学的实验证明产生现象II的原因是SCN-与Cl2发生反应。
(2)甲同学猜想SCN-可能被Cl2氧化了,他又进行如下研究。
资料显示:SCN-的电子式为 。
① 甲同学认为SCN-中碳元素没有被氧化,理由是 。
② 取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,此证明SCN-中被氧化的元素是 。
③ 通过实验证明了SCN-中氮元素转化为NO3-,他的实验方案是 。
破题
思路
分析实验目的→明确实验原理→选择试剂和反应条件→避免干扰和副反应→注意环境污染→完成方案
[答案] (1) ①Fe3+ (2) ①SCN-中的碳元素是最高价态+4价 ② 硫元素
③ 取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,证明SCN-中氮元素转化为NO3-;
题组2 化学实验方案的评价
评价实验方案要从原理、药品、安全、操作、绿色化等几个方面着手,比较分析,得出结论。
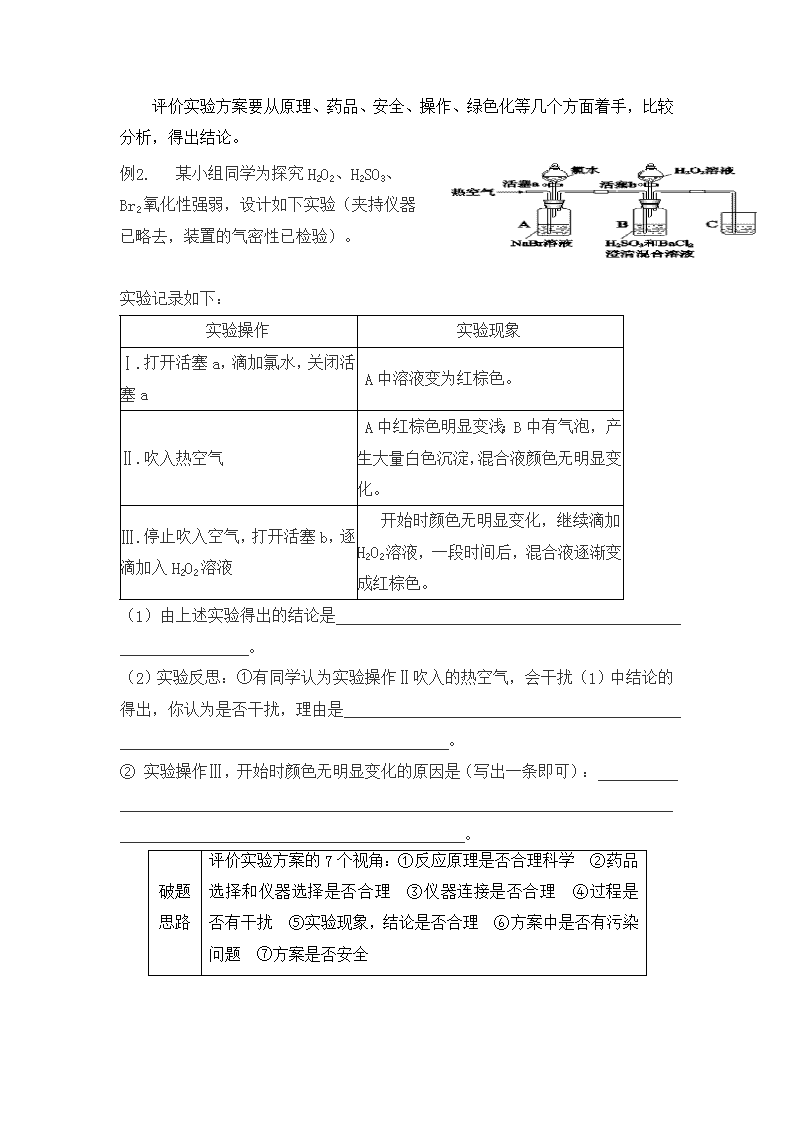
例1. 某小组同学为探究H2O2、H2SO3、
Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
实验记录如下:
实验操作
实验现象
Ⅰ.打开活塞a,滴加氯水,关闭活塞a
A中溶液变为红棕色。
Ⅱ.吹入热空气
A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化。
Ⅲ.停止吹入空气,打开活塞b,逐滴加入H2O2溶液
开始时颜色无明显变化,继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色。
(1)由上述实验得出的结论是 。
(2)实验反思:①有同学认为实验操作Ⅱ吹入的热空气,会干扰(1)中结论的得出,你认为是否干扰,理由是 。
② 实验操作Ⅲ,开始时颜色无明显变化的原因是(写出一条即可): 。
破题
思路
评价实验方案的7个视角:①反应原理是否合理科学 ②药品选择和仪器选择是否合理 ③仪器连接是否合理 ④过程是否有干扰 ⑤实验现象,结论是否合理 ⑥方案中是否有污染问题 ⑦方案是否安全
[答案] (1)氧化性:H2O2>Br2>H2SO3;(2) ① 不干扰,无论热空气是否参加氧化H2SO3,只要观察到产生白色沉淀的同时无明显颜色变化,即能证明Br2氧化了H2SO3;
② H2SO3有剩余(H2O2浓度小或Br-与H2O2反应慢等因素都可)。
例3. 【16年江苏卷】铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物。(1)铁炭混合物在水溶液中可形成许多微电池。将含有Cr2O72-的酸性废水通过铁炭混合物,在微电池正极上Cr2O72-转化为Cr3+,其电极反应式为_________ ____。
(2)在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图所示。
当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,其原因是__________。
②当铁炭混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是_____ __ ______。
(3)纳米铁粉可用于处理地下水中的污染物。
①纳米铁粉与水中NO3-反应的离子方程式为4Fe+NO3-+10H+=4Fe2++NH4++3H2O
研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是 。
②相同条件下,纳米铁粉去除不同水样中NO3-的速率有较大差异(见上图),产生该差异的可能原因是 。
【答案】(1)Cr2O72-+6e-+14H+=2Cr3++7H2O;
(2)①活性炭对Cu2+和Pb2+有吸附作用 ② 铁的质量分数增加,铁炭混合物中微电池数目减少;
(3)① 纳米铁粉与H+反应生成H2;② Cu或Cu2+催化纳米铁粉去除NO3-
的反应(或形成的Fe-Cu原电池增大纳米铁粉去除NO3-的反应速率)。
【练习】
1.设计下列方案,画出流程图
(1)Fe3O4固体含有+2价铁离子和+3价铁离子。
(2)检验Na2SO3是否氧化变质的实验方案。
2.硫酰氯(SO2Cl2)是一种重要的化工试剂,已知:① SO2(g) + Cl2(g) 催化剂
SO2Cl2(l) △H = -97.3 kJmol;
在无活性炭存在的条件下SO2与Cl2也可发生反应,现将SO2、Cl2按照一定比例通入水中,请设计一个简单实验验证二者是否恰好完全反应:
(简要描述实验步骤、现象和结论)。
[仪器自选,供选择试剂:滴加酚酞的氢氧化钠溶液、碘化钾溶液、淀粉溶液、品红溶液。]
3 .氢化钙固体是登山运动员常用的能源提供剂。某兴趣小组长选用H2和Ca加热制备氢化钙。
(1)实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此判断,上述实验确有CaH2生成。
①写出CaH2与水反应的化学方程式________________________________ _____
②该同学的判断不正确,原因是______________________________________ __________
(2)请你设计一个实验,用化学方法区分钙与氢化钙,写出实验简要步骤及观察到的现象_______________________________________________________________________________________________________________________________________________________ __ ____。
(3)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是____________________。
4. 氯气与碱溶液反应,在低温和稀碱溶液中主要产物是ClO—和Cl—,在75℃以上和浓碱溶液中主要产物是ClO3—和Cl—。研究小组用如下实验装置制取氯酸钾(KClO3),并测定其纯度。
已知碱性条件下,ClO—有强氧化性,而ClO3—氧化性很弱。设计实验证明:碱性条件下,H2O2能被ClO—氧化,而不能被ClO3—氧化______ __。
5.高纯MnCO3是制备高性能磁性材料的主要原料。实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
(1)制备MnSO4溶液:在烧瓶中(装置见下图)加入一定量MnO2和水,搅拌,
通入SO2和N2混合气体,反应3h。停止通入SO2,继续反应片刻,过滤(已知MnO2 + H2SO3 = MnSO4 + H2O)。
① 反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有 、 。
② 若实验中将N2换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如右上图。导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是 。
(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀时pH=7.7。请补充由(1)制得的MnSO4溶液制备高纯MnCO3的操作步骤[实验中可选用的试剂:Ca(OH)2、NaHCO3、Na2CO3、C2H5OH]。
① ;② ;③ ;④ ;⑤
低于100℃干燥。
6 . 氯酸钾与碘化钾反应的探究:在不同条件下KClO3可将KI氧化为I2或KIO3 。该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
①系列a实验的实验目的是___ ____。
②设计1号试管实验的作用是____ _______。
7 .某小组利用苯与溴在FeBr3催化作用下制备溴苯:
+ Br2
FeBr3
+ HBr↑
—Br
已知苯与溴发生的是取代反应,推测反应后锥形瓶中液
体含有的两种大量离子,并设计实验方案验证你的推测。 (限选试剂:镁条、四氯化碳、氯水、溴水、蒸馏水)
序号
实验步骤
预期现象
结论
1
2
锥形瓶中液体含大量______
3
锥形瓶中液体含大量______
8.中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25gL。某兴趣
小组用题右图装置(夹持装置略)收集某葡萄酒中SO2,并对含量碱性测定。
(1)B中加入300.00ml葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,除去C中过量的H2O2,然后用0.0900molLNaOH标准溶液进行滴定,滴定至终点时,消耗NaOH溶液25.00ml,该葡萄酒中SO2含量为:_ _gL。
(2)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施_____ __
__ 。
9.高氯酸铵(NH4ClO4)可用作火箭推进剂,已知NH4ClO4对热不稳定,400 ℃时发生分解反应:2NH4ClO4N2↑+2O2↑+Cl2↑+4H2O。某化学兴趣小组利用实验室常用试剂,设计下图装置(已略去夹持装置)对NH4ClO4热分解产生的气体进行分步吸收或收集。
其中B吸收的是NH4ClO4分解产生的Cl2,装置C中的试剂为浓硫酸。
装置D中加入铜粉,吸收NH4ClO4分解产生的O2,实验结束后,某同学取少量装置D中的固体物质倒入洁净的试管中,加入蒸馏水,振荡、静置,观察到上层溶液为蓝色,产生该现象的可能原因是_________________试设计实验进行验证:______ _。
【实验方案的设计与评价答案】
1.
(2)固体溶液沉淀沉淀部分溶解―→固体已部分变质
2. 取少量反应后的溶液于试管中,滴加品红溶液振荡,若溶液褪色, 则二者未恰好完全反应;若不褪色,则二者恰好完全反应。
3.(1)①CaH2+2H2O=Ca(OH)2+2H2↑ ②金属钙与水反应也有类似现象
(2)取适量的氢化钙,在加热的条件下与干燥氧气反应,将反应后生成的气态产物通过装有白色的无水硫酸铜的干燥管,观察到白色变蓝色,而取钙做相同的实验则观察不到白色变蓝色。
(3)氢化钙是固体携带方便
4.分别取少量NaClO和NaClO3溶液于试管A、B中,均滴加少量NaOH溶液,再分别滴加H2O2溶液,A中有气泡产生并能使带火星的木条复燃,B中无明显现象。(也可以分别检验产物 Cl-,则在加入硝酸银之前一定要煮沸除去双氧水,再加硝酸酸化)
5.(1)①控制适当的温度 缓慢通入混合气体 ② Mn2+催化O2与H2SO3,反应生成H2SO4
(2)① 边搅拌边加入NaHCO3(或Na2CO3),并控制溶液pH<7.7 ② 过滤,用少量水洗涤2~3次。 ③ 检验SO42-是否被洗涤除去 ④ 用少量C2H5OH洗涤(凡合理答案均可)
6.① 研究反应体系中硫酸浓度对反应产物的影响;② 硫酸浓度为0的对照实验;
7.方案一:
序号
实验步骤
预期现象
结论
1
将锥形瓶中的液体转入分液漏斗中,加入适量四氯化碳,振荡后分液。(1分)分液后取少量上层
无色溶液于试管A、B中。(1分)
2
向试管A中加入少量氯水
溶液由无色变黄色
(步骤+现象共1分)
Br—(1分)
3
向试管B中加入镁条
有大量气泡产生
(步骤+现象共1分)
H+(1分)
方案二:
序号
实验步骤
预期现象
结论
1
用烧杯取适量溴水,加入蒸馏水使其与锥形瓶中液体的颜色一致
2
取等体积的锥形瓶中液体和步骤1所得溴水,分别加入试管A、B中,再分别滴加等体积的氯水
试管A中溶液颜色比试管B深
Br—(1分)
3
取等体积的锥形瓶中液体和步骤1所得溴水,分别加入试管C、D中,再分别加入等量的镁条
试管C中有大量气泡生成,试管D中气泡不明显
H+(1分)
8. (1) 0.24
(2)原因:盐酸的挥发;改进措施:用不挥发的强酸例如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响。
9.D中有少量CuCl2生成 取上层蓝色溶液,滴加NaOH溶液,出现蓝色沉淀,过滤,在滤液中加入稀硝酸,再滴加AgNO3溶液,观察是否出现白色沉淀。