- 846.50 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2017-2018学年江苏省宿迁市沭阳县高二下学期期中考试
化学试题
可能用到的相对原子质量:H-1 C-12 O-16 Al-27 K-39 Cu-64 Zn-65
第Ⅰ卷 (选择题 共50分)
单项选择题(本题包括10小题,每题3分,共30分)
1.能源是所有人类文明赖以建立的基础,并推动着人类文明的繁荣与发展。下列图片中属于利用热能的是
A B C D
2.关于能源,以下说法中不正确的是
A.煤、石油、天然气均为化石能源
B.化石燃料直接燃烧会产生污染空气的有害物质
C.直接燃烧煤不如将煤深加工后再燃烧好
D.化石能源可再生
3.下列说法正确的是
A.可燃冰、太阳能、氢能、风能等属于新能源
B.任何化学反应中的能量变化都表现为热量变化
C.化学键的断裂和形成是化学反应中能量变化的主要原因
D.吸热反应只有加热才能发生
4.下列属于放热反应的是
A.镁条溶于盐酸 B.氨气液化 C.碳酸钙分解 D.硝酸铵溶于水
5.关于热化学方程式:2H2(g) + O 2(g)=2H2O(1),ΔH=-571.6 kJ·mol-1,下列叙述不正确的是
A.2mol H2完全燃烧生成液态水时放出571.6 kJ的热
B.1mol H2完全燃烧生成液态水时放出285.8kJ的热
C.2个氢分子完全燃烧生成液态水时放出571.6 kJ的热
D.可推出热化学方程式:H2O(1) =H2(g)+ O2(g) ;ΔH=285.8 kJ·mol-1
6.N2H4是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程式中正确的是
A.N2H4(g)+O2(g)===N2(g)+H2O(g) ΔH=-133.5kJ·mol-1
B.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
C.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=534 kJ·mol-1
D.N2H4(g)+O2(g)===N2(g)+2H2O(l) ΔH=-534kJ·mol-1
7.某原电池总反应的离子方程式为:2Fe3++Fe == 3Fe2+,能实现该反应的原电池组成是
A.正极为铜,负极为铁,电解质溶液为FeCl3溶液
B.正极为铁,负极为铁,电解质溶液为Fe(NO3)3溶液
C.正极为铁,负极为锌,电解质溶液为Fe2(SO4)3溶液
D.正极为银,负极为铁,电解质溶液为CuSO4溶液
8.人造地球卫星使用一种高能电池—银锌电池,其电池的电极反应为:
Zn + 2OH--2e-= ZnO + H2O;Ag2O + H2O + 2e-= 2Ag + 2OH-,根据此判断氧化银是
A.负极,被氧化 B.正极,被还原 C.负极,被还原 D. 正极,被氧化
9.把a、b两块金属浸泡在稀硫酸中,用导线相连可以组成原电池。若a为负极,则这两种金属的活动性顺序为
A.无法比较 B.a=b C.b>a D.a>b
10.如下图所示装置中,属于电解池的是( )
二、不定项选择题(每小题4分,有一个或两个选项符合题意。少选2分;错选0分。)
11.有如下三个热化学方程式:
H2(g)+1/2O2(g)=H2O(g);ΔH1=aKJ·mol-1,
H2(g)+1/2O2(g)=H2O(l);ΔH2== bkJ·mol-1,
2H2(g)+O2(g)=2H2O(l);ΔH3== ckJ·mol-1,
关于它们的表述,下列正确的是
A.ΔH1>ΔH2 B.a、b和c均为正值 C.a== b D.2b== c
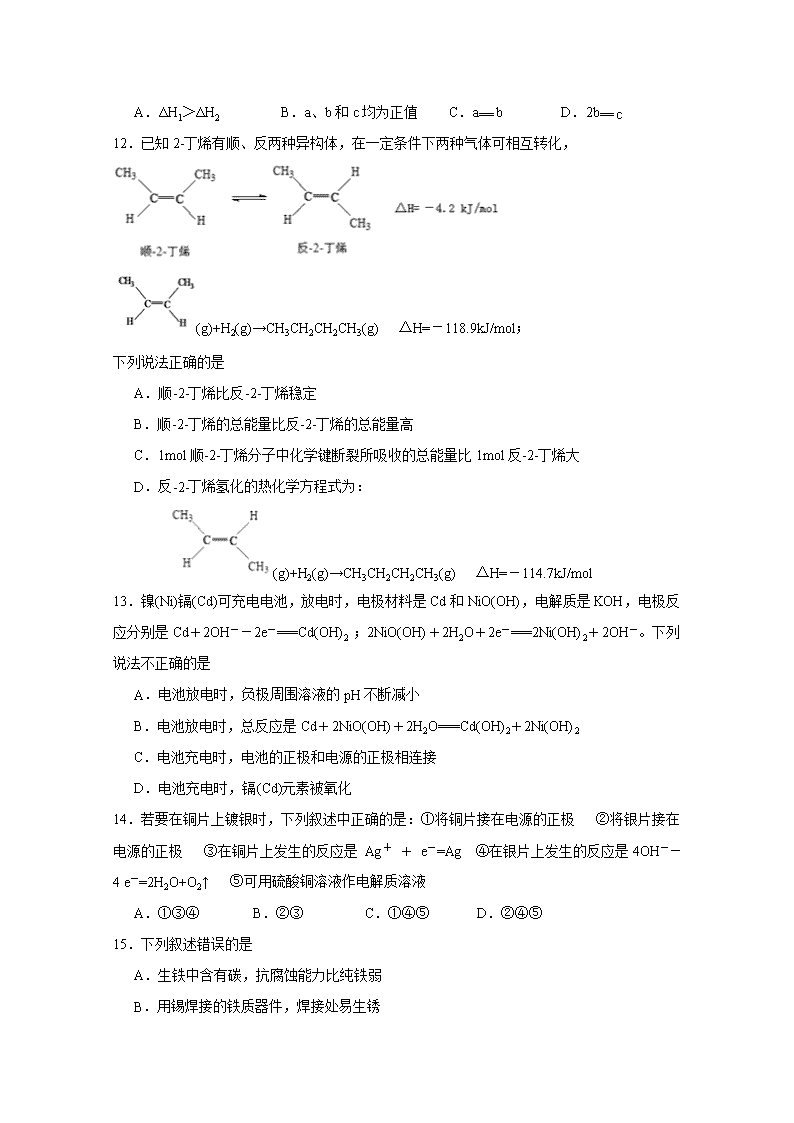
12.已知2-丁烯有顺、反两种异构体,在一定条件下两种气体可相互转化,
(g)+H2(g)→CH3CH2CH2CH3(g) △H=-118.9kJ/mol;
下列说法正确的是
A.顺-2-丁烯比反-2-丁烯稳定
B.顺-2-丁烯的总能量比反-2-丁烯的总能量高
C.1mol顺-2-丁烯分子中化学键断裂所吸收的总能量比1mol反-2-丁烯大
D.反-2-丁烯氢化的热化学方程式为:
(g)+H2(g)→CH3CH2CH2CH3(g) △H=-114.7kJ/mol
13.镍(Ni)镉(Cd)可充电电池,放电时,电极材料是Cd和NiO(OH),电解质是KOH,电极反应分别是Cd+2OH--2e-===Cd(OH)2 ;2NiO(OH)+2H2O+2e-===2Ni(OH)2+2OH-。下列说法不正确的是
A.电池放电时,负极周围溶液的pH不断减小
B.电池放电时,总反应是Cd+2NiO(OH)+2H2O===Cd(OH)2+2Ni(OH)2
C.电池充电时,电池的正极和电源的正极相连接
D.电池充电时,镉(Cd)元素被氧化
14.若要在铜片上镀银时,下列叙述中正确的是:①将铜片接在电源的正极 ②将银片接在电源的正极 ③在铜片上发生的反应是 Ag+ + e-=Ag ④在银片上发生的反应是4OH--4 e-=2H2O+O2↑ ⑤可用硫酸铜溶液作电解质溶液
A.①③④ B.②③ C.①④⑤ D.②④⑤
15.下列叙述错误的是
A.生铁中含有碳,抗腐蚀能力比纯铁弱
B.用锡焊接的铁质器件,焊接处易生锈
C.在铁制钥匙上镀铜时,钥匙为阳极,铜盐为电镀液
D.铁管上镶嵌锌块,铁管不易被腐蚀,这叫牺牲阳极的阴极保护法
第Ⅱ卷 (非选择题 共70分)
16.热能是使用广泛的能源,下列物质燃烧可以为我们提供热能。
(1)已知氢气(H2)、一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)燃烧的热化学方程式分别为
H2(g)+O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
CO(g)+O2(g)===CO2(g) ΔH=-282.9 kJ·mol-1
C8H18(l)+O2(g)===8CO2(g)+9H2O(l) ΔH=-5518 kJ·mol-1
CH4(g)+2O2 (g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
相同物质的量的H2、CO、C8H18、CH4分别完全燃烧时,放出热量最多的是
相同质量的H2、CO、C8H18、CH4分别完全燃烧时,放出热量最多的是
(2)0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,其热化学反应方程式为 ;又知H2O(l)=H2O(g);△H=+44kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时,放出的热量是 kJ.
(3)如图所示,该反应的热化学方程式是____(填字母)。
A.N2(g)+3H2(g)===2NH3(l) ΔH=2(a-b-c)kJ·mol-1
B.N2(g)+3H2(g)===2NH3(g) ΔH=2(b-a)kJ·mol-1
C.N2(g)+H2(g)===NH3(l) ΔH=(b+c-a)kJ·mol-1
D.N2(g)+H2(g)===NH3(g) ΔH=(a+b)kJ·mol-1
(4)已知 ,CO(g)与H2O(g)反应的能量变化如图所示,有关说法正确的是
A.该反应为吸热反应
B.1mol CO(g)和1mol H2O(g)具有的总能量大于1mol CO2(g) 和1mol H2(g)具有的总能量
C.反应的热化学方程式是:CO (g) + H2O (l) = CO2(g) + H2(g);△H=+41kJ/mol
D.1mol CO2(g)和1 mol H2(g)反应放出41 kJ热量
(5)意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4
分子结构如图所示,已知断裂1 mol N—N键吸收167 kJ热量,生成1 mol N≡N键放出942 kJ热量。根据以上信息和数据,则1 mol N4生成N2的ΔH=______ kJ·mol-1
17.不同的化学反应具有不同的热量,人们可以通过多种方法获得反应热的数据。
(1)实验测定中和热
50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
①从实验装置上看,图中尚缺少的一种玻璃仪器是 ,烧杯间如不填满碎泡沫塑料,则求得的中和热数值 (填“偏大”、“偏小”或“无影响”,下同);大烧杯上如不盖硬纸板,则求得的中和热数值 。
②含有11.2 g KOH的稀溶液与1 L 0.1 mol·L-1的H2SO4溶液反应,放出11.46 kJ的热量,表示该反应的中和热的热化学方程式为
A.KOH(aq)+H2SO4(aq)===K2SO4(aq)+H2O(l) ΔH=-11.46 kJ·mol-1
B.2KOH(aq)+H2SO4(aq)===K2SO4(aq)+2H2O(l) ΔH=-11.46 kJ·mol-1
C.2KOH(aq)+H2SO4(aq)===K2SO4(aq)+2H2O(l) ΔH=-1146 kJ·mol-1
D.KOH(aq)+H2SO4(aq)===K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
(2)通过盖斯定律计算
已知在298K时的热化学反应方程式:C(s,石墨)+O2(g)=CO2(g); △H1=-393.5kJ/mol,
2CO(g)+O2(g)=2CO2(g); △H2=-566.0kJ/mol。
则298K时,反应 C(s,石墨)+ 1/2 O2(g) = CO(g)的△H是______
18.原电池就是将化学能转换成电能的装置。
(1)右图构成的原电池中,下列描述错误的是
A.铜片上有大量气泡产生
B.H+ 向铜电极移动
C.电子从锌电极通过硫酸溶液流向铜电极
D.当导线中有1mol电子通时,锌片溶解0.5mol
(2)单池电池做成的电源,时间稍长电流就很快减弱,效率比较低,不适合实际应用。盐桥电池(双池电池)
有更稳定电流,更高能量转化率。把氧化反应和还原反应分开在不同容器进行,半池中电解质溶液含电极材料对应阳离子,相互间不反应。关于如图所示的原电池,下列说法正确的是
A.电流从锌电极通过电流计流向铜电极
B.铜电极在反应前后质量不变
C.盐桥中的阴离子向硫酸锌溶液中迁移
D.锌电极发生氧化反应;铜电极发生还原反应,其电极反应是2H++2e-===H2↑
(3)燃料电池的基本组成为电极、电解液、燃料和氧化剂。此种电池的能量利用率可高达80%(一般柴油发电机只有40% 左右),产物污染也少。如下图所示,可形成氢氧燃料电池。通常氢氧燃料电池有酸式[当电解质溶液为硫酸时]和碱式[当电解质溶液为NaOH(aq)或KOH(aq)时]两种。试回答下列问题:
①酸式电池的电极反应:负极:________________;
②碱式电池的电极反应:负极: ;
③两种电池工作一段时间后,电解质溶液pH变大的是 (填“酸式”或“碱式”)。
(4)燃料电池的燃料不仅是H2 ,CO、CH4、CH3OH、NH3等都能与O2反应从而将化学能转化为电能。
①甲烷燃料电池(NaOH作电解质溶液)的负极的电极反应式为 ,
②瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图,有关说法正确的是 (填字母)。
A.电池工作时,Na+向负极移动
B.电子由电极2经外电路流向电极1
C.电池总反应为4NH3+3O2===2N2+6H2O
D.电极2发生的电极反应为O2+4H++4e-===2H2O
(5)世界各国每年均有不少人因CO中毒而失去生命。一种CO分析仪的工作原理如图所示,该装置中电解质为氧化钇—氧化钠,其中O2-可以在固体介质NASICON中自由移动。传感器中通过的电流越大,尾气中CO的含量越高,请回答下列问题:
工作时,O2-向电极 (填“a”或“b”)移动
(6)随着人们生活质量的不断提高,
碱性锌锰电池、锌银电池、铅蓄电池、氢镍电池、锂离子电池等,广泛应用于通讯、高科技、军事、生产生活等各行各业。废电池必须进行集中处理的问题被提到议事日程,其首要原因是 (填字母)
A.利用电池外壳的金属材料
B.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
C.不使电池中渗漏的电解液腐蚀其他物品
D.回收其中石墨电极
19. 电解的应用比较广泛,回答下列问题:
(1)采用电解法冶炼相应金属的是________(填字母,下同)。
A.Fe2O3 B.AgCl C. Cu2S D.Al2O3
(2)CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是________。
A.粗铜接电源正极,发生还原反应
B.溶液中Cu2+向阳极移动
C.若阳极质量减少64 g,则转移电子数为2NA个
D.利用阳极泥可回收Ag、Pt、Au等金属
(3)用石墨作电极电解CuCl2和KCl的混合溶液,电解初期阴极析出的物质是
(4)①氯碱工业主要建立在电解电解饱和食盐水基础上的。请写出电解饱和食盐水的化学方程式:
②如图为电解饱和食盐水的简单装置,下列有关说法正确的是
A.电解一段时间后,向蛋壳内的溶液中滴加几滴酚酞,呈红色
B.蛋壳表面缠绕的铁丝上发生氧化反应
C.铁丝表面生成的气体能使湿润的淀粉碘化钾试纸变蓝
D.蛋壳可阻止生成的氯气与氢气、氢氧化钠溶液接触
20.(1)某同学组装了如图所示的电化学装置。
A B C
① 电极Ⅰ为Fe,其他均为Cu。
Ⅰ为________极;Ⅲ为________极(填“正”、“负”、“ 阴”或“ 阳”);Ⅳ的电极反应: 。
② 电极Ⅰ为Fe,其他均为石墨,Ⅲ极上产物为______,Ⅳ极上产物为_____ ,反应结束后添加氢氧化铜_____(填“能”或“不能”)使C池溶液复原。
(2)市售“热敷袋”主要成分是:铁屑、炭粉、木屑与少量NaCl、水等。它在使用之前与空气隔绝,使用时开启塑料袋上的小孔,轻轻揉搓就会有热量放出,当使用完后还会发现有铁锈生成。请写出“热敷袋”中形成原电池的电极反应式。正极:
负极: 。
(3)如下图所示,装置中都盛有0.1 mol·L-1的NaCl溶液,放置一段时间后,装置中的四块相同的锌片腐蚀速率最快是 。
A B C D
2017~2018学年度第二学期期中调研测试
高二化学参考答案
1、A 2、D 3、C 4、A 5、C 6、B 7、A 8、B 9、D 10、C
11、AD 12、BD 13、D 14、B 15、C
16 (共14分,每空2分)
(1) C8H18 H2
(2) B2H6(g)+3O2(g)=B2H3(s)+3H2O(l) △H=-2165kJmol-1;1016.5
(3)A (4) B (5)-882
17、(共10分,每空2分)
(1)环形玻璃搅拌棒 偏小 偏小 D
(2) -110.5 kJmol-1
18(共18分,每空2分)
(1)C (2) C
(3)① H2-2e-===2H+
②H2-2e-+2OH-===2H2O
③酸式
(4)CH4+10OH--8e-===CO+7H2O C
(5)a (6) B
19(共10分,每空2分)
(1)D
(2)D
电解
(3) Cu
(4) 总反应:2NaCl+2H2O===Cl2 +H2 +2NaOH D
20(共10分,每空2分)
(1)负、阳 Cu2++2e-=== Cu
(2)O2 ,Cu 不能
(3) O2+2H2O+4e-===4OH- 2Fe-4e-===2 Fe2+
(4) B