- 131.92 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
化学反应速率和化学平衡
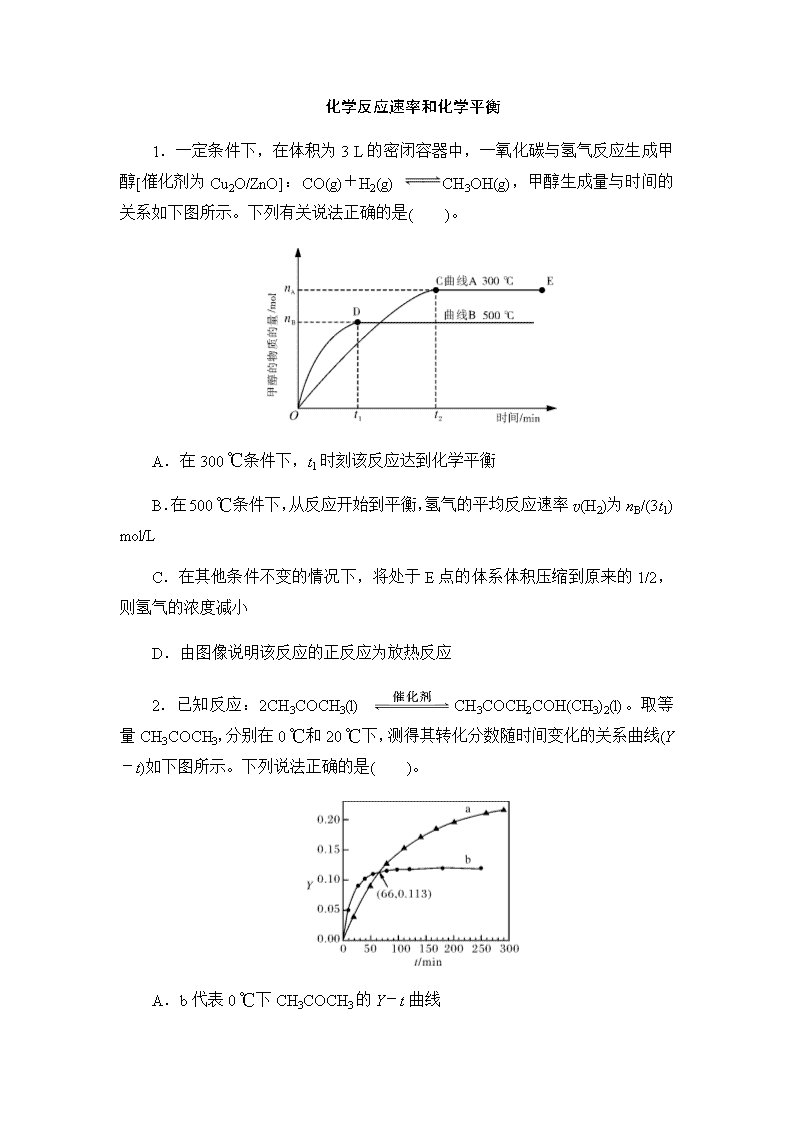
1.一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇[催化剂为Cu2O/ZnO]:CO(g)+H2(g) CH3OH(g),甲醇生成量与时间的关系如下图所示。下列有关说法正确的是( )。
A.在300 ℃条件下,t1时刻该反应达到化学平衡
B.在500 ℃条件下,从反应开始到平衡,氢气的平均反应速率v(H2)为nB/(3t1) mol/L
C.在其他条件不变的情况下,将处于E点的体系体积压缩到原来的1/2,则氢气的浓度减小
D.由图像说明该反应的正反应为放热反应
2.已知反应:2CH3COCH3(l) CH3COCH2COH(CH3)2(l)。取等量CH3COCH3,分别在0 ℃和20 ℃下,测得其转化分数随时间变化的关系曲线(Y-t)如下图所示。下列说法正确的是( )。
A.b代表0 ℃下CH3COCH3的Y-t曲线
B.反应进行到20 min末,CH3COCH3的>1
C.升高温度可缩短反应达平衡的时间并能提高平衡转化率
D.从Y=0到Y=0.113,CH3COCH2COH(CH3)2的=1
3. 25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+ Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。下列判断正确的是( )。
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0
D.25 ℃时,该反应的平衡常数K=2.2
4.用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是( )。
A.加入浓盐酸
B.将稀硫酸改为98%的浓硫酸
C.滴加少量硫酸铜溶液
D.将铁片改为铁粉
5.下图是温度和压强对反应X+Y2Z影响的示意图。图中纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )。
A.X、Y、Z均为气态
B.恒容时,混合气体的密度可作为此反应是否达到化学平衡的判断依据
C.升高温度时v正增大,v逆减小,平衡向右移动
D.使用催化剂时Z的产率增加
6.低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g) ΔH<0
在恒容的密闭容器中,下列有关说法正确的是( )。
A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B.平衡时,其他条件不变,增大NH3的浓度,废气中氮氧化物的转化率减小
C.单位时间内消耗NO和N2的物质的量之比为1∶2时,反应达到平衡
D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
7.工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)===Si(s)+4HCl(g) ΔH=+Q kJ/mol(Q>0)
某温度、压强下,将一定量的反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是( )。
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达到平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L·min)
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液中恰好反应
8.在密闭容器中,反应X2(g)+Y2(g) 2XY(g) ΔH<0达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是( )。
A.图Ⅰ是加入适当催化剂的变化情况
B.图Ⅱ是扩大容器体积的变化情况
C.图Ⅲ是增大压强的变化情况
D.图Ⅲ是升高温度的变化情况
9.苯乙烯(C6H5CH===CH2)是生产各种塑料的重要单体,其制备原理为:
C6H5C2H5(g) C6H5CH===CH2(g)+H2 (g) ΔH=+125 kJ·mol-1
(1)该反应的平衡常数表达式为K=________________________。随着温度的升高,K值________(填“增大”、“减小”或“不变”)。
(2)实际生产中常以高温水蒸气作为反应体系的稀释剂(稀释剂不参加反应)。C6H5C2H5的平衡转化率与水蒸气的用量、体系总压强关系如下图所示。
①由上图可得出:
结论一:其他条件不变,水蒸气的用量越大,平衡转化率越______;
结论二: __________________________________________。
②加入稀释剂能影响C6H5C2H5平衡转化率的原因是
________________________________________________________________________
________________________________________________________________________。
(3)某些工艺中,在反应的中途加入O2和特定的催化剂,有利于提高C6H5C2H5的平衡转化率。试解释其原因:
________________________________________________________________________
________________________________________________________________________。
10.黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其燃烧产物为SO2和Fe2O3。
(1)已知1 g FeS2完全燃烧放出7.1 kJ热量,FeS2完全燃烧反应的热化学方程式为:_____________________________________________________________________
___
________________________________________________________________________。
(2)将0.050 mol SO2(g)和0.030 mol O2(g)放入容积为1 L的密闭容器中,反应2SO2(g)+O2(g) 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。
计算该条件下反应的平衡常数K和SO2的平衡转化率。
(3)当该反应处于平衡状态时,欲使平衡向正反应方向移动且反应速率加快,下列措施可行的是______(填字母)。
A.向平衡混合物中充入Ar
B.向平衡混合物中充入O2
C.改变反应的催化剂
D.降低反应的温度
(4)反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0,SO2的转化率在起始温度T1=673 K下随反应时间(t)的变化如下图,其他条件不变,仅改变起始温度为T2=723 K,在图中画出温度T2下SO2的转化率随反应时间变化的预期结果示意图。
化学反应速率和化学平衡参考答案
1.D 解析:在300 ℃条件下,t2时刻时该反应达到平衡;在500 ℃条件下,t1时刻该反应达到平衡,此时甲醇的物质的量为nB,反应消耗氢气的物质的量为2nB,氢气的平均反应速率为 mol/(L·min);体积缩小,反应物和生成物浓度均增大,虽压强增大,平衡右移,但根据勒夏特列原理可知,它只能减弱这种改变而不能抵消这种改变,C错;从图像可知温度高时平衡体系中甲醇含量减少,可以推出正反应为放热反应。
2.D 解析:温度越高反应速率越快,达到平衡越早,b先达到平衡,表示b为20 ℃下的曲线,A项错误;从图像易知,20 min时b曲线斜率大,即20 ℃下反应速率快,B项错误;由图示可知温度越高反应物的转化分数越小,即平衡转化率越低,C项错误;66 min时两个温度下转化分数相同,则生成的CH3COCH2COH(CH3)2物质的量相同,D项正确。
3.D 解析:由于加入的固体Pb,对反应物和生成物的浓度都不会产生影响,平衡不会发生移动,A项错误;加入Sn(NO3)2后Sn2+浓度增大,平衡向左移动,c(Pb2+)应增大,B项错误;升高温度,平衡体系中c(Pb2+)增大说明平衡
逆向移动,即逆向为吸热反应、正向为放热反应,该反应ΔH<0,C项错误。
4.B 解析:铁遇浓硫酸发生钝化,不会产生氢气。
5.B 解析:据图可知,Z的体积分数与压强有关,判断X、Y两者中必有一种物质不是气体,则恒容条件下,混合气体的密度变化与否,可作为判断平衡是否达到的判据,B正确,A错误;温度升高,正、逆反应速率都增大,只是增大值不相等,C错误;使用催化剂不影响Z的产率,D错误。
6.C 解析:A错,该反应是放热反应,升高温度该反应的平衡常数减小;B错,增大NH3的浓度,废气中氮氧化物的转化率增大;D错,氮氧化物的转化率不变。
7.D 解析:因为是气体体积增大的反应,所以加压会减小SiCl4的转化率,A错;因反应为可逆反应,1 mol SiCl4不可能完全反应,故达平衡时吸收热量应小于Q kJ,B错;列式计算v(HCl)==0.03 mol/(L·min),v(H2)=v(HCl)=0.015 mol/(L·min),C错误;据热化学方程式比例关系计算,吸收0.025Q kJ能量,则有0.1 mol HCl生成,可中和0.1 mol NaOH,D正确。
8.D 解析:根据该反应的特点,结合图像得出,Ⅰ由于v正、v逆均增大,可能是升高温度也可能是增大压强,但升高温度甲平衡逆向移动,此时应是v逆′>v正′,而增大压强对反应前后分子总数不变的反应的平衡不发生移动,A错;Ⅱ为加入了适当的催化剂的变化情况,B错;Ⅲ为升高温度,乙的反应速率快,先达到平衡,并且XY%比甲小,符合题意,C错误,D正确。
9.(1) 增大
(2)①高 其他条件不变,体系总压强越大,平衡转化率越小
②总压不变时,加入稀释剂,参与反应的各物质浓度同等程度减小,相当于反应体系减压,故平衡向气体物质的量增大的方向移动,C6H5C2H5的平衡转化率增大
(或总压不变时,加入稀释剂,参与反应的各物质浓度同等程度减小,浓度
商的计算结果小于平衡常数K,故平衡向正反应方向移动,C6H5C2H5的平衡转化率增大)
(3)O2将反应生成的H2消耗掉,减小了H2的浓度,同时该反应放热使体系升温,两种因素均使平衡向正反应方向移动
解析:由于制备反应为吸热反应,温度升高平衡正向移动,所以K值增大。
10.(1)4FeS2(s)+11O2(g)2Fe2O3(s)+8SO2(g) ΔH=-3 408 kJ·mol-1
(2)解:
2SO2(g) + O2(g) 2SO3(g)
起/mol·L-1 0.050 0.030 0
平/mol·L-1 0.050-0.040 0.030-0.040/2 0.040
K=
=
=1.6×103 L ·mol-1
SO2的平衡转化率=×100%=80%
(3)B
(4)