- 6.67 MB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
www.ks5u.com
2019-2020学年度上期期末高一年级调研考试
化 学
本试卷分选择题和非选择题两部分。第I卷(选择题)1至4页,第II卷(非选择题)4至6页,共6页,满分100分,考试时间90分钟。
注意事项:
1.答题前,务必将自己的姓名、考籍号填写在答题卡规定的位置上。
2.答选择题时,必须使用2B铅笔将答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦擦干净后,再选涂其它答案标号。
3.答非选择题时,必须使用0.5毫米黑色签字笔,将答案书写在答题卡规定的位置上。
4.所有题目必须在答题卡上作答,在试题卷上答题无效。
5.考试结束后,只将答题卡交回。
可能用到的相对原子质益:0-16 Na-23 Cl-35.5
第I卷(选择题,共40分)
本卷共20题,每题2分,共40分。每题只有一个选项符合题意。
1.下列物质的应用中,利用了该物质氧化性的是
A.氨——作制冷剂 B.漂粉精——作游泳池消毒剂
C.硅——太阳能电池板 D.SO2——漂白草帽
2.铝是生活中常见的金属材料,下列说法错误的是
A.铝是地壳中含量最多的元素 B.铝可用于制作易拉罐
C.铝箔可用于药品包装 D.将铝质饮料罐等回收利用有利于节能减排保护环境
3.如图将充满二氧化氮的试管倒扣在水槽中,下列叙述错误的是
A.试管内液面上升
B.试管内气体颜色逐渐变浅,直至消失
C.堵住管口将试管取出,管口向上松开手指,观察到试管口有红棕色出现
D.取少量试管内液体,滴加石蕊试液后褪色
4.下列物质的分类正确的是
A.Al2O3——碱性氧化物 B.Na2SiO3——硅酸盐
C.浓硫酸——电解质 D.氢氧化铁胶体——悬浊液
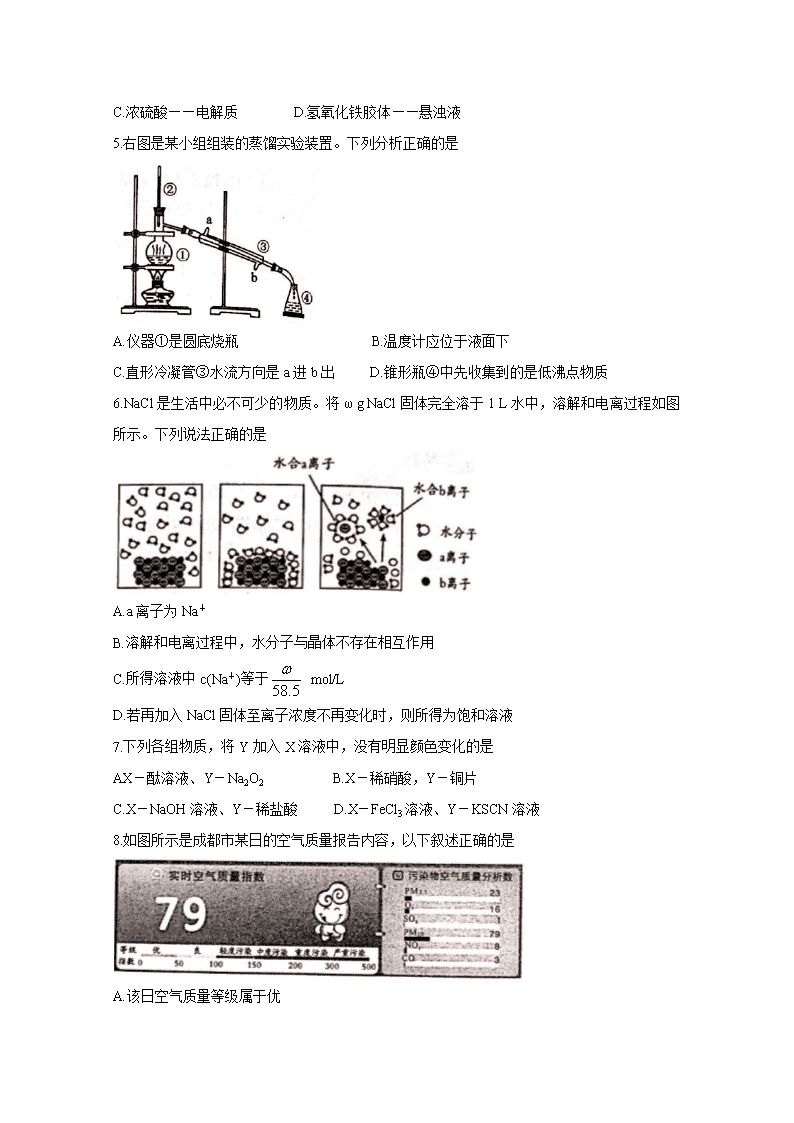
5.右图是某小组组装的蒸馏实验装置。下列分析正确的是
A.仪器①是圆底烧瓶 B.温度计应位于液面下
C.直形冷凝管③水流方向是a进b出 D.锥形瓶④中先收集到的是低沸点物质
6.NaCl是生活中必不可少的物质。将ω g NaCl固体完全溶于1 L水中,溶解和电离过程如图所示。下列说法正确的是
A.a离子为Na+
B.溶解和电离过程中,水分子与晶体不存在相互作用
C.所得溶液中c(Na+)等于 mol/L
D.若再加入NaCl固体至离子浓度不再变化时,则所得为饱和溶液
7.下列各组物质,将Y加入X溶液中,没有明显颜色变化的是
AX-酞溶液、Y-Na2O2 B.X-稀硝酸,Y-铜片
C.X-NaOH溶液、Y-稀盐酸 D.X-FeCl3溶液、Y-KSCN溶液
8.如图所示是成都市某日的空气质量报告内容,以下叙述正确的是
A.该日空气质量等级属于优
B.该日空气首要污染物是PM2.5
C.PM2.5,PM10指的是悬浮颗粒物,不会影响人体健康
D.污染物NO2、CO可能来源于机动车尾气
9.设NA为阿伏加德罗常数的值,下列说法正确的是
A.22.4 L氧气所含的分子总数为NA
B.标准状况下,NA个CO2分子与NA个H2SO4分子所占的体积之比为1:1
C.1 mol Na2O2与足量CO2充分反应后转移电子数为NA
D.0.5 mol/L的MgCl2溶液中Cl-个数为NA
10.我国长征二号F运载火箭使用偏二甲肼(C2H8N2)和四氧化二氮(N2O4)作推进剂,生成N2、CO2和H2O(g)。则该反应中N2O4
A.只是氧化剂 B.只是还原剂 C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
11.下列除杂和检验方案中,可行的是
12.下列反应的离子方程式正确的是
A.Cl2通入水中:Cl2+H2O=Cl-+ClO-+2H+
B.向Al2(SO4)3溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
C.用食醋除水垢:2H++CaCO3=Ca2++H2O+CO2↑
D.向水玻璃中滴加稀盐酸:SiO32-+2H+=H2SiO3(胶体)
13.分别将食盐分散到①水、②乙醇中形成分散系。当光束通过时,只有②中可观察到光亮的“通路”,下列说法正确的是
A.①所得分散系为纯净物 B.②所得分散系为胶体
C.①②所得分散系均很稳定 D.两个分散系中分散质粒子直径相同
14.某小组设计如右图装置,模拟化学家舍勒用软锰矿制备和收集干燥纯净的氯气。下列判断错误的是
A.圆底烧瓶中固体为软锰矿(主要成分为MnO2)
B.B中试剂为饱和食盐水
C.若要得到干燥氯气,可在D、E间再添加一个C装置
D.E中发生的离子反应方程式为:Cl2+OH-=Cl-+HClO
15.下列实验现象描述正确的是
16.“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用,下列有关该捕捉过程的叙述正确的是
A.该技术可避免碳排放且不消耗能量
B.整个过程中,只有CO2可循环利用
C.“捕捉”过程中,与CO2有关的反应均为分解反应
D.捕捉到的CO2可制备其它化工产品,减少温室气体排放
17.某小组设计除去粗盐中的杂质CaCl2,MgCl2和Na2SO4的方案如下:
下列说法正确的是
A.除去Mg2+的主要反应:Mg2++CO32-=MgCO3↓
B.试剂①②③可以分别是Na2CO3溶液、NaOH溶液、BaCl2溶液
C.检验SO42-是否除净:取少量滤液,加稀盐酸酸化,再加BaCl2溶液
D.滤液加稀盐酸时只发生反应:H++OH-=H2O
18.利用如图装置进行铜与浓硫酸反应产物及其性质的验证实验。下列实验操作、现象、结论均正确的是
19.X、Y、Z、M均为中学化学中常见物质,一定条件下有如下转化关系(其它产物已略去)。下列说法错误的是
A.若M是单质碳,则Z可能导致人体中毒
B.若Y是氮气,则Z一定为红棕色气体
C.若M是氢氧化钠,则Y可能是两性氢氧化物
D.若X是硫,则X、Z的相对分子质量可能相差48
20.实验室欲用如图流程从碘水中获得碘单质(已知碘单质易升华)。下列说法错误的是
A.溶剂X可以是四氯化碳或者无水乙醇
B.操作2和3均需使用分液漏斗
C.试剂Y的作用是将有机溶液中的碘单质“反萃取”进入水溶液2
D.固体碘宜在低温下干燥
第II卷(非选择题,共60分)
21.(13分)
I、某实验小组欲用18.0 mol/L的浓硫酸配制1.5 mol/L稀硫酸480 mL。
(1)所用玻璃仪器除量筒、烧杯外,需用到 mL (填仪器名称)。
(2)需要用量筒量取18.0 mol/L的浓硫酸 mL。
(3)简述在烧杯中稀释浓硫酸的操作: 。
(4)用量筒量取浓硫酸时,仰视量筒进行量液,导致所配溶液浓度 (填“偏大”、“偏小”或“无影响”);烧杯中稀释液体转移前应注意温度要 。
II、汽车安全气囊的药剂含有NaN3、Fe2O3、KClO4、NaHCO3等。当汽车发生碰撞时,NaN3迅速分解产生N2和Na,同时放出大量的热,N2使气囊迅速膨胀,从而起到保护作用。
(5)KClO4中氯元素的化合价是 ,因此具有 (填“还原性”或“氧化性”)。
(6)Fe2O3可处理产生的Na,反应为:6Na+Fe2O3=3Na2O+2Fe,请用单线桥表示电子转移。
(7)NaHCO3具有 的性质,可用于吸收产气过程中释放的热量。
22.(12分)利用“价类二维图”研究物质的性质,是一种有效的学习方法。以下是铁元素及其化合物的二维图的部分信息。
(1)X、Y的化学式分别为 。 、
(2)图中只具有还原性的物质是 (写化学式)。
(3)可以证明FeCl2既具有氧化性又具有还原性的试剂分别为 、 。
(4)某实验小组设计如下实验探究亚铁盐的性质。
①实验I中最后生成红褐色沉淀的化学方程式是 。
②对实验II所得白色沉淀展开研究:(已知Fe(HCO3)2常温常压下在水中不能大量存在)
i.取II中少量白色沉淀,充分洗涤,向其中加入稀硫酸,沉淀完全溶解,产生无色气泡;
ii.向i所得溶液中滴入KSCN试剂,溶液几乎不变红;
iii.向ii溶液中再滴入少量H2O2,溶液立即变为红色。
根据以上现象,实验II中生成的白色沉淀的化学式为 。
③研究过程中发现实验II中白色沉淀在空气中久置最终也变为红褐色。则该沉淀比实验I中所得的Fe(OH)2的还原性 (填“强”或“弱”)。
23.(6分)将3.0 L 2.0 mol/L CuSO4溶液和2.0 L 1.0 mol/L H2SO4溶液混合。计算:
(1)混合液中CuSO4的物质的量;
(2)向混合液中最少加入多少升1.0 mol·L-1 NaOH溶液,才能使Cu2+完全沉淀?
24.(9分)氨氮废水是造成水体富营养化的原因之一。其中氮元素多以NH4+和NH3·H2O的形式存在。某工厂设计如下流程处理氨氮废水:
(1)过程①的目的是将NH4+转化为NH3,并通过鼓入大量空气将氨吹出。生成NH3的离子方程式为 。
(2)过程②加入NaClO可将废水中的NH4+和NH3·H2O转化为无毒气体,该反应是 (“氧化还原反应”或“非氧化还原反应”),反应后含氮元素、氯元素的物质分别为 、
(写化学式)。
(3)余氯废水中主要含NaClO以及HClO,过程③中去除余氯的溶液X可能是 (填序号)。a.KOH溶液 b.Na2SO3溶液 C.Na2S溶液
写出用Na2SO3溶液除去HClO的离子方程式 。
25.(11分)硫酸和硝酸都是重要的化工原料,具有广泛的用途。
(1)蔗糖中加入浓硫酸后,蔗糖变黑并体积膨胀,同时有刺激性气味的气体产生。该变化过程中体现了浓硫酸的 性质,产生气体的化学方程式为 。
(2)某同学进行有关铜的化学性质的实验,如图所示:
实验①可观察到的现象为 (尽可能描叙完整);实验③中铜片逐渐溶解至消失,该同学认为铜与稀硫酸和稀硝酸均能反应,这种看法 (“合理”或“不合理”);试剂药品不变,请补充一个实验加以证明: (画出图示并写出预期现象)。根据补充实验的结论,写出③中铜片溶解的离子方程式 。
26.(9分)我国科学家研究雾霾形成机理发现,空气中若存在硫酸盐会加剧雾霾的形成。某小组将SO2和NO2按一定比例混合,其他条件相同,以N2或空气为载气通入洗气瓶,检测吸收液中SO42-的含量。
I.以氮气为载气,吸收液分别为蒸馏水和3%氨水,测得反应后吸收液中SO42-的含量分别为a和b;
II.以空气为载气,吸收液分别为蒸馏水和3%氨水,测得反应后吸收液中SO42-的含量分别为c和d;
测得:b≈d>a≈c
III.若只通入SO2,载气和吸收液不变,最终均检测不到SO42-。
(1)大气中SO2和NO2易形成酸雨,造成危害,酸雨的pH小于 。
(2)该实验表明, (“酸性”、“碱性”或“,中性”)环境下,更有利于硫酸盐的形成。
(3)通过上述实验可知,SO42-的形成与空气中的O2 (“有关”或“无关”),主要与 有关。
(4)NO2在反应中主要体现 性。
(5)请根据以上实验原理,提出一条有利于减轻雾霾形成的措施 。