- 582.00 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
一、单选题
1.化学与生产、生活、社会密切相关。下列说法中正确的是( )
A.铅笔芯的原材料为铅,儿童使用铅笔时如果用嘴吮吸能够引起铅中毒
B.“轻轨电车”是一种交通工具,当电车启动时,电车电刷与导线的接触点上由于摩擦会产生高温,因此接触点上的材料应该选用耐高温、能导电的物质,石墨恰好合适
C.为防止中秋月饼等富含脂质食品氧化变质,常在包装袋中放入生石灰
D.双氧水是绿色氧化剂,可作医疗消毒剂,说明H2O2对人体无害
【答案】B
【解析】A、铅笔芯的主要材料是石墨,错误;B、石墨导电且耐高温、耐腐蚀,正确;C、生石灰可以用作干燥剂,无抗氧化功能,错误;D、双氧水有致癌性,可加速人体衰老,错误。答案选B。
2.下列物质与其用途完全符合的有几项( )
①SiO2——太阳能电池 ②NH3——制硝酸 ③NaCl——制纯碱 ④Al2O3——焊接钢轨
⑤NaClO——消毒剂 ⑥MgO——耐火材料 ⑦H2SO4——制炸药 ⑧Na2CO3——制水泥
A.4 B.5 C.6 D .7
【答案】B
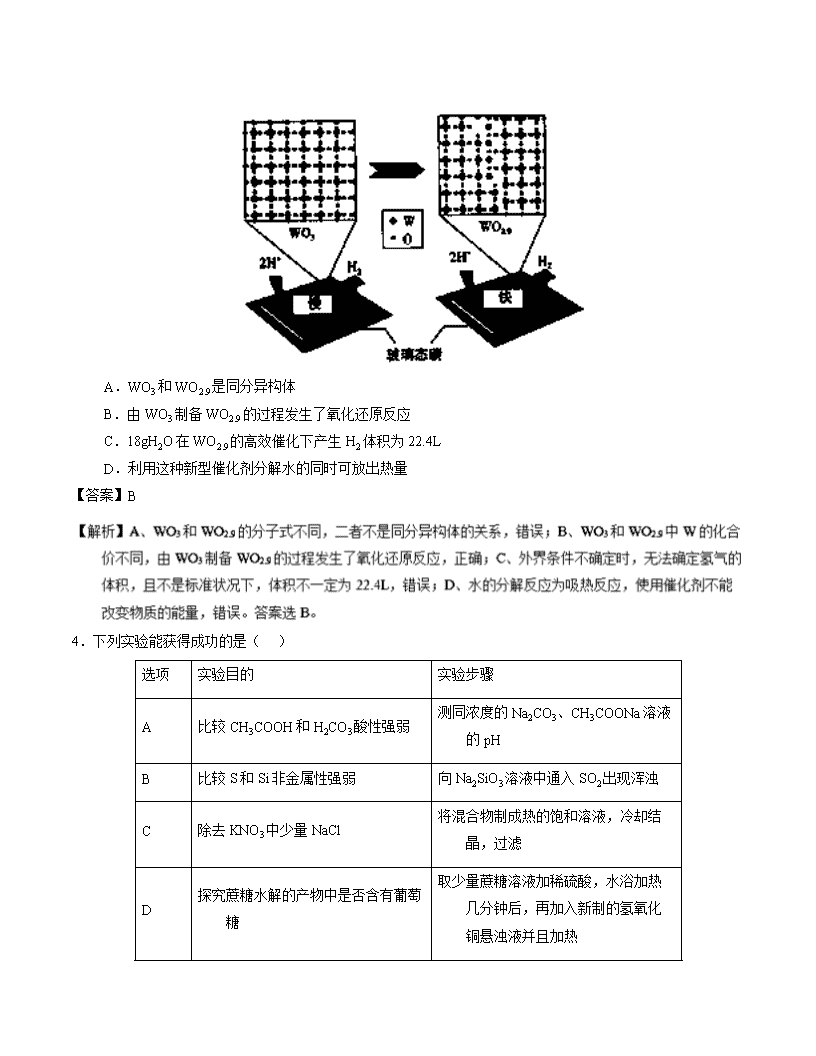
3.我国学者成功发现了新一类水分解产氢催化剂:通过调控三氧化钨(WO3)局部原子结构,制备出深蓝色钨氧化物(WO2.9),该种钨的氧化物能高效而快速地催化水分解产生H2。下列有关说法正确的是( )
A.WO3和WO2.9是同分异构体
B.由WO3制备WO2.9的过程发生了氧化还原反应
C.18gH2O在WO2.9的高效催化下产生H2体积为22.4L
D.利用这种新型催化剂分解水的同时可放出热量
【答案】B
4.下列实验能获得成功的是( )
选项
实验目的
实验步骤
A
比较CH3COOH和H2CO3酸性强弱
测同浓度的Na2CO3、CH3COONa溶液的pH
B
比较S和Si非金属性强弱
向Na2SiO3溶液中通入SO2出现浑浊
C
除去KNO3中少量NaCl
将混合物制成热的饱和溶液,冷却结晶,过滤
D
探究蔗糖水解的产物中是否含有葡萄糖
取少量蔗糖溶液加稀硫酸,水浴加热几分钟后,再加入新制的氢氧化铜悬浊液并且加热
A.A B.B C.C D.D
【答案】C
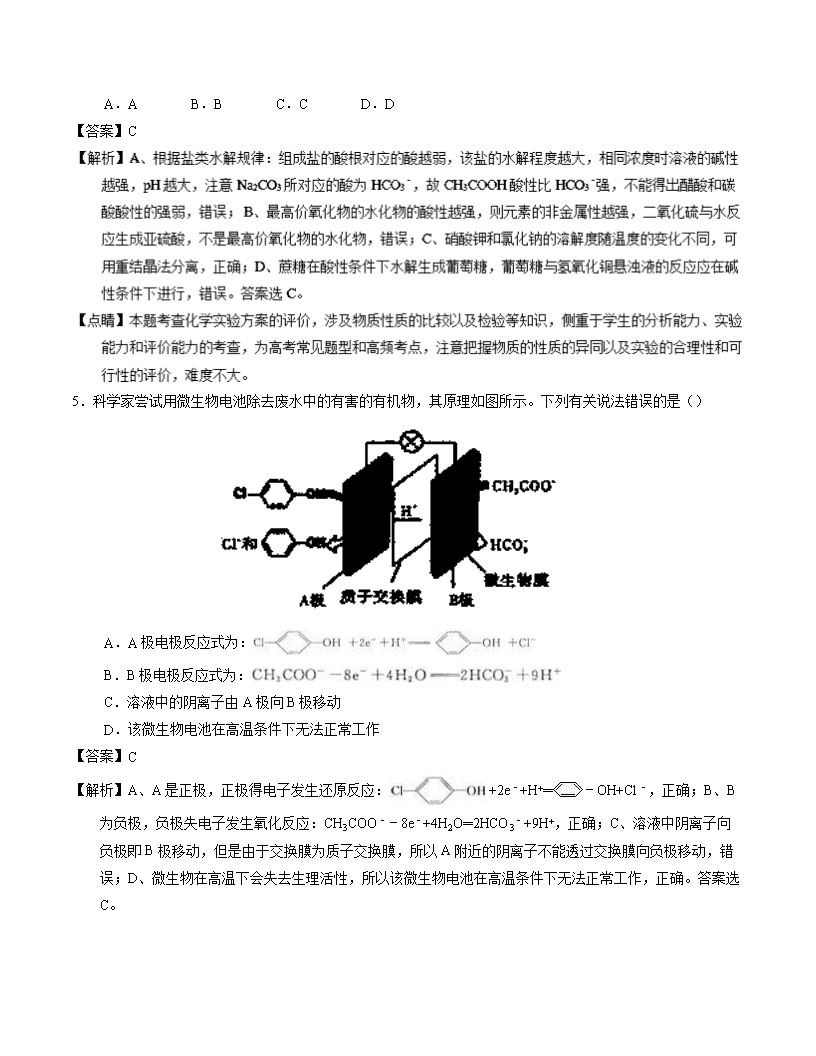
5.科学家尝试用微生物电池除去废水中的有害的有机物,其原理如图所示。下列有关说法错误的是()
A.A极电极反应式为:
B.B极电极反应式为:
C.溶液中的阴离子由A极向B极移动
D.该微生物电池在高温条件下无法正常工作
【答案】C
【解析】A、A是正极,正极得电子发生还原反应: +2e﹣+H+═﹣OH+Cl﹣,正确;B、B为负极,负极失电子发生氧化反应:CH3COO﹣﹣8e﹣+4H2O═2HCO3﹣+9H+,正确;C、溶液中阴离子向负极即B极移动,但是由于交换膜为质子交换膜,所以A附近的阴离子不能透过交换膜向负极移动,错误;D、微生物在高温下会失去生理活性,所以该微生物电池在高温条件下无法正常工作,正确。答案选C。
【点睛】本题考查新型电池,为高频考点,题目难度不大,注意把握原电池的工作原理以及电极反应式的书写,解答本题的关键是根据物质的性质判断原电池的正负极。
6.对下列实验装置图,有关说法不正确的是( )
A.图甲根据实验现象证明酸性强弱:硝酸>碳酸>硅酸
B.图乙制备金属锰
C.图丙滴定管中溶液的液面读数为22.40mL
D.图丁检验乙醇与浓硫酸加热至170℃产生的气体,必须有除杂装置X
【答案】A
7.已知丁基(—C4H9)有四种结构,某烃的结构简式为,该烃可能的结构有( )
A.16种 B.14种 C.12种 D.10种
【答案】D
【解析】由于丁基有四种结构,设这四种结构的基团为a、b、c、d,则在邻位上连接基团的组合可以为: aa、bb、cc、dd、ab(或ba,是相同的,下同)、ac(或ca)、ad(或da)、bc(或cb)、bd(或db)、cd(或dc)共10种同分异构体,答案选D。
8.用石墨作电极电解0.1molL-1的NaCl溶液,通电一段时间后发现两极收集的气体体积之比为4:3,下列说法正确的是( )
A.在电解后的溶液中注入一定量的盐酸可以使溶液恢复到原始状态
B.在电解质溶液中通入标准状况下4.48L的氯化氢气体并注入0.1mol的水可以使溶液恢复到原始状态
C.阴极产生的气体的物质的量是阳极产生气体的物质的量的0.75倍
D.阳极产生的气体的平均摩尔质量为58g/mol
【答案】D
9.下列反应在一定条件下可以实现的是( )
①酸性氧化物与碱反应 ②有单质参加的非氧化还原反应
③没有水生成,也没有沉淀和气体生成的复分解反应
④两种酸溶液充分反应后的溶液呈中性
A.1个 B.2个 C.3个 D.4个
【答案】D
【解析】①酸性氧化物与碱反应生成盐和水,可实现; ②同素异形体的转化是有单质参加的非氧化还原反应,如氧气转化为臭氧的转化等,可实现;③没有水生成,也没有沉淀和气体生成,但产生弱电解质的复分解反应是存在的,如盐酸与醋酸钠反应生成醋酸和氯化钠,故可实现;④氧化性酸与还原性酸可发生反应,充分反应后溶液呈中性,如氢硫酸与硝酸反应,可实现。答案选D。
10.阿伏加德罗常数用NA表示,下列叙述中正确的是( )
①标准状况下,22.4L乙醇中含有的氧原子数目为NA
②6.4g的34S2和34S8混合物中,含硫原子总数为0.2NA
③12g金刚石含有的共价键数为2NA
④10mL质量分数为98%的H2SO4,加水至100mL,H2SO4的质量分数大于9.8%
⑤含0.2NA个阴离子的Na2O2和水反应时,转移0.2mol电子
⑥11.2LCl2通入足量氢氧化钠溶液中充分反应,转移的电子数等于0.5NA
⑦1L含NA个NH3H2O的氨水,其浓度为1molL-1
A.②③④ B.③④⑤ C.④⑥⑦ D.①②⑤
【答案】B
11.根据键能数据估算CH4(g)+4F2(g)═CF4(g)+4HF(g)的反应热△H为( )
化学键
C—H
C—F
H—F
F—F
键能/(kJmol-1)
414
489
565
155
A.-485 kJmol-1 B.+485 kJmol-1 C.+1940 kJmol-1 D.-1940 kJmol-1
【答案】D
【解析】△H=反应物总键能—生成物总键能,结合图表中键能数据和反应中化学键的判断进行计算,△H=414kJ/mol4+155kJ4-(489 kJ/mol4+565 kJ/mol4)=-1940 kJ/mol,故答案选D。
12.原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。下列叙述错误的是()
A.元素的非金属性次序为c>b>a
B.a和其他3种元素均能形成共价化合物
C.d和其他3种元素均能形成离子化合物
D.元素a 、b、c各自最高和最低化合价的代数和分别为0、4、6
【答案】B
【解析】原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a-的电子层结构与氦相同,则a是H元素;b和c的次外层有8个电子,b是元素,c元素是Cl元素,由于c-和d+的电子层结构相同,所以d是K元素。A、同一周期的元素的非金属性随原子序数的增大而增大,所以元素的非金属性次序为c>b>a,正确;B、H元素与S、Cl元素可以形成共价化合物H2S、HCl,与K元素可形成离子化合物KH,错误;C、K和H、S、Cl可以形成离子化合物KH、K2S、KCl,正确;D、元素H的最高化合价是+1价,最低化合价是-1价,最高和最低化合价的代数和为0,S元素最高化合价是+6价,最低化合价是-2价,最高和最低化合价的代数和为4,Cl元素最高化合价是+7价,最低化合价是-1价,最高和最低化合价的代数和为6,正确。答案选B。
13.下列解释物质用途或现象的方程式不正确的是( )
A.铝热反应用于焊接钢轨:2Al+Fe2O3Al2O3+2Fe
B.汽车尾气中发生的催化转化反应:2NO+2CON2+2CO2
C.燃煤时加入石灰石减少SO2的排放:2CaCO3+2SO2+O22CaSO3+2CO2
D.用Na2CO3溶液处理水垢中的不溶物CaSO4:CaSO4+CaCO3+
【答案】C
14.一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是()
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
【答案】C
【解析】A、温度升高,水的离子积增大,c(H+)、c(OH-)都增大,表示的点就不在曲线上,错误;B、水的离子积常数K=c(H+)·c(OH-),从图可知离子积是1.0×10-11,不是1.0×10-13,错误;C、加入FeCl3,水解使得溶液酸性增强,c(H+)增大,则c(OH-)减小,故可能引起由b向a的变化,正确;D、温度不变水的离子积不变,稀释溶液后所表示的点还在曲线上,不可能引起由c向d的变化,错误。答案选C。
15.下列各项内容中排列顺序正确的是
A.相同物质的量浓度的下列溶液中NH4+的浓度: (NH4)2SO4> NH4Cl > NH4HCO3
B.微粒半径: K+> S2-> F-
C.给出质子的能力:CH3COOH >C2H5OH > H2O
D.氢化物的沸点: HF > HCl > HBr
【答案】A
16.在某温度T℃时,将N2O4、NO2分别充入两个各为1L的密闭容器中,反应过程中浓度变化如下:
容器
物质
起始浓度/(molL-1)
平衡浓度/(molL-1)
Ⅰ
N2O4
0.100
0.040
NO2
0
0.120
Ⅱ
N2O4
0
0.0142
NO2
0.100
0.0716
下列说法不正确的是( )
A.平衡时,Ⅰ、Ⅱ中反应的转化率(N2O4)>(NO2)
B.平衡后,升高相同温度,以N2O4表示的反应速率(Ⅰ)<(Ⅱ)
C.平衡时,Ⅰ、Ⅱ中正反应的平衡常数K(Ⅰ)=
D.平衡后,升高温度,Ⅰ、Ⅱ中气体颜色都将变深
【答案】B
二、非选择题
17.肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4H2O):
NaClO过量时,易发生反应:
实验一:制备NaClO溶液(实验装置如图甲所示)
锥形瓶中发生反应的离子方程式是________________________________________。
实验二:制取水合肼(实验装置如图乙所示)
控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108-114℃馏分。
分液漏斗中的溶液是_____________(填序号);
CO(NH2)2溶液 B、NaOH溶液 C、NaOH和CO(NH2)2混合溶液 D、NaOH和NaClO混合溶液
选择的理由是__________________________________________________________。
实验三:测定馏分中肼含量
称取馏分5.000g加入适量NaHCO3固体,加入配成250mL溶液,移出25.00mL,用0.1000mol/L的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右(已知:N2H4H2O+2I2═N2↑+4HI+H2O)。
配制250mL溶液所需仪器除分析天平、烧杯、玻璃棒外,还需_________________________________。
滴定过程中,NaHCO3能控制溶液的pH在6.5左右,用离子方程式解释其原因:__________。
实验测得消耗I2溶液的平均值为20.00mL,馏分中水合肼(N2H4H2O)的质量分数为____________。
【答案】(1).Cl2+2OH-=Cl-+ClO-+H2O(2).D(3).如果次氯酸钠装在烧瓶中,因过量而使N2H4H2O氯化(4).250mol容量瓶,胶头滴管(5).Hl+H+═H2O+CO2↑(6).0%
量是0.001mol×50g/mol=0.05g,则馏分中水合肼(N2H4·H2O)的质量分数为:。
18.Ⅰ.已知A、B、C为中学化学中常见的单质。室温下,A为固体,B和C均为气体。在适宜的条件下,它们可以按如下框图进行反应。
回答下列问题:
组成单质A、B、C的三种元素中的任意两种元素形成的化合物所属物质类别一定不是_____________。
①氢化物 ②酸 ③碱 ④盐 ⑤氧化物
如果E溶液是一种强酸,则E的化学式为_________________。
Ⅱ.下图是一些常见元素的单质或化合物之间的转化关系。溶液中的水以及部分反应物或生成物未标出。A、E是空气中的两种主要成分,C是由两种元素组成的新型材料,并且C的原子数、最外层电子数之和与SiC相同,J是一种能引起温室效应的气体,K是两性化合物。反应③、④、⑤用于工业中生产H。
回答下列问题:
写出A的电子式:________________,G的化学式:________________;
写出D和H反应的化学方程式:_____________________________________________;
写出反应⑥的离子方程式:_________________________________________;
B和SiC的纳米级复合粉末是新一代大规模集成电路理想的散热材料。反应①是科学家研究开发制备该纳米级复合粉末的最新途径。已知B由Si及另外两种元素组成,且Si与另外两种元素的物质的量之比均为1:4,写出反应①的化学方程式:____________________________。
【答案】(1).③⑤(2).HCl(3).(4).NO(5).C+4HNO3CO2↑+4NO2↑+2H2O(6).CO2+2Al+3H2O═2A(COH)3↓+C(7).Al4SiC4+2N24AlN+SiC+3C
19.锰的化合物种类较多,大多具有广泛的用途。
Ⅰ.MnO2是H2O2分解的良好的催化剂,它也具有较强的氧化性。某化学兴趣小组通过实验探究MnO2的性质。
该小组设计了如下4个方案以验证MnO2的氧化性,可行的是__________(填序号)。
把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
把MnO2固体加入到H2O2溶液中,观察是否有气泡产生
Na2SO3溶液中,加入MnO2固体,再滴加BaCl2溶液,观察是否有白色沉淀生成
FeSO4溶液中滴加几滴KSCN溶液,再加入MnO2固体,观察溶液是否变红
为研究溶液中MnO2的氧化能力与溶液酸碱性的关系,该小组同学设计了如下的对比实验:在室温下,取A、B、C三支试管,用同浓度同体积的KI溶液和质量、颗粒大小相同的MnO2固体反应,然后分别加入1mL0.2mol/L NaOH溶液、1mL水、1mL0.1mol/L稀硫酸。现象记录如表所示:
试管编号
实验现象
A
溶液不变色
B
溶液缓慢变浅棕褐色
C
溶液迅速变棕褐色
①从以上实验中,我们可以得出的结论是________________________________________________________。
②写出C试管中发生反应的离子方程式:________________________________________________________。
Ⅱ.铁酸锰(MnFe2O4)可用于热化学循环分解水制氢,可有效缓解能源危机。MnFe2O4的制备工艺流程如图:
已知:Fe3+、Mn2+沉淀的pH如表格所示。
开始沉淀
完全沉淀
Fe3+
2.7
4.2
Mn2+
8.3
10.4
步骤一中投入原料Fe(NO3)3和Mn(NO3)2的物质的量之比理论上应为_________________。
步骤二中需控制pH的范围是___________________。
步骤三中是否洗涤干净的判断方法是__________________________________________________。
(二选一,考生请在两道题中选做一道)
【答案】(1).D(2).酸性越强,MnO2的氧化能力越强(3).MnO2+4H++2I-═Mn2++I2+2H2O(4).2:1(5).PH10.4(6).最后的洗涤液量中性
20.氧化锌、氮化镓及新型多相催化剂组成的纳米材料能利用可见光分解水,生成氢气和氧气。
Zn2+基态核外电子排布式为______________,其核外存在______________对自旋相反的电子。
写出两个与水分子具有相同空间构型的分子和阴离子:__________,____________。
水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是
______________(填序号)。
氧原子的杂化类型发生了改变 B、微粒的空间构型发生了改变
C、微粒的化学性质发生了改变 D、微粒中的键角发生了改变
在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图甲),已知冰的升华热是+51kJmol-1,除氢键外,水分子间还存在范德华力(11kJmol-1),则冰晶体中氢键的键能是______________kJmol-1。
氮化镓的晶体结构如图乙所示,其中氮原子的杂化轨道类型是______________;N、Ga原子之间存在配位键,该配位键中提供电子对的原子是______________;该晶体的化学式为______________。金刚砂(SiC)和氮化镓并称为第三代半导体材料的双雄,它与金刚石具有相似的晶体结构,试比较金刚石和金刚砂的熔点高低,并说明理由:___________________________________________________________________________________________________________________________________。
某种ZnO晶体的晶胞如图丙所示,Zn2+的配位数为_______________,其晶胞中Zn2+和O2-之间的距离为apm,列式表示该晶体的密度:____________________________________gcm-3(不必计算结果)。
【答案】(1).3Cl10(2).14(3).H2S(4).NH(5).A(6).20(7).SP3(8).N (9).GaN (10).金刚石的熔点高于金刚砂的熔点,因为碳原子半径小于硅原子半径,所以C-C键的键长小于C-Si键 (11).8 (12).
21.石油的裂解是石油化工的重要方法之王,石油的裂解产物是合成材料的重要的基础原料。例如工业上以丙烯为原料可制得一种重要合成橡胶IR和一种合成树脂X。
B的分子式是C6H6O,可与NaOH溶液反应。
已知以下信息:
(—R、—R’、—R’’表示可能相同或可能不同的原子或原子团。)
Ⅲ.同一碳原子上有两个碳碳双键时,分子不稳定。
请回答下列问题。
在一定条件下,丙烯可与下列物质反应的是__________。
A、H2O B、NaOH溶液 C、Br2的CCl4溶液 D、酸性KMnO4溶液
(2)A与C2H2合成D的化学方程式是_____________________________________________________,反应类型是_______________________________________________________________________________。
(3)E、F中均含有碳碳双键,则E的结构简式是_____________。
(4)H的结构简式是_____________。
(5)B与C在一定条件下反应生成合成树脂X的化学方程式是_____________。
(6)有多种同分异构体,符合下列要求的有___________种,其中在核磁共振氢谱中只出现四组峰的有_________种。
能与FeCl3溶液反应显紫色 ②只能发生银镜反应,不能发生水解反应
【答案】(1).acd(2).(3).加成反应(4).(5).
(6).(7).6(8).2
(1)丙烯含有碳碳双键,能与水、溴发生加成反应,能被酸性高锰酸钾氧化,不能与氢氧化钠发生反应,故选acd;
(2)A与C2H2合成D的化学方程式是:,属于加成反应;
(3)由上述分析可知,E的结构简式是;
(4)由上述分析可知,H的结构简式是;
(5)B与G在一定条件下反应生成合成树脂X的化学方程式是:;