- 469.50 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
跟踪检测(二十) 电解池 金属的电化学腐蚀与防护
1.下列有关金属腐蚀与防护的说法不正确的是( )
A.钢铁在弱碱性条件下发生电化学腐蚀的正极反应是O2+2H2O+4e-===4OH-
B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D.可将地下输油钢管与外加直流电源的负极相连以保护它不受腐蚀
解析:选B 弱碱性条件下,钢铁发生吸氧腐蚀,A正确;当镀层破损时,Sn、Fe可形成原电池,Fe作负极,加快了Fe的腐蚀,B错误;Fe、Zn、海水形成原电池,Zn失去电子作负极,从而保护了Fe,C正确;采用外加电流的阴极保护法时,被保护金属与直流电源的负极相连,D正确。
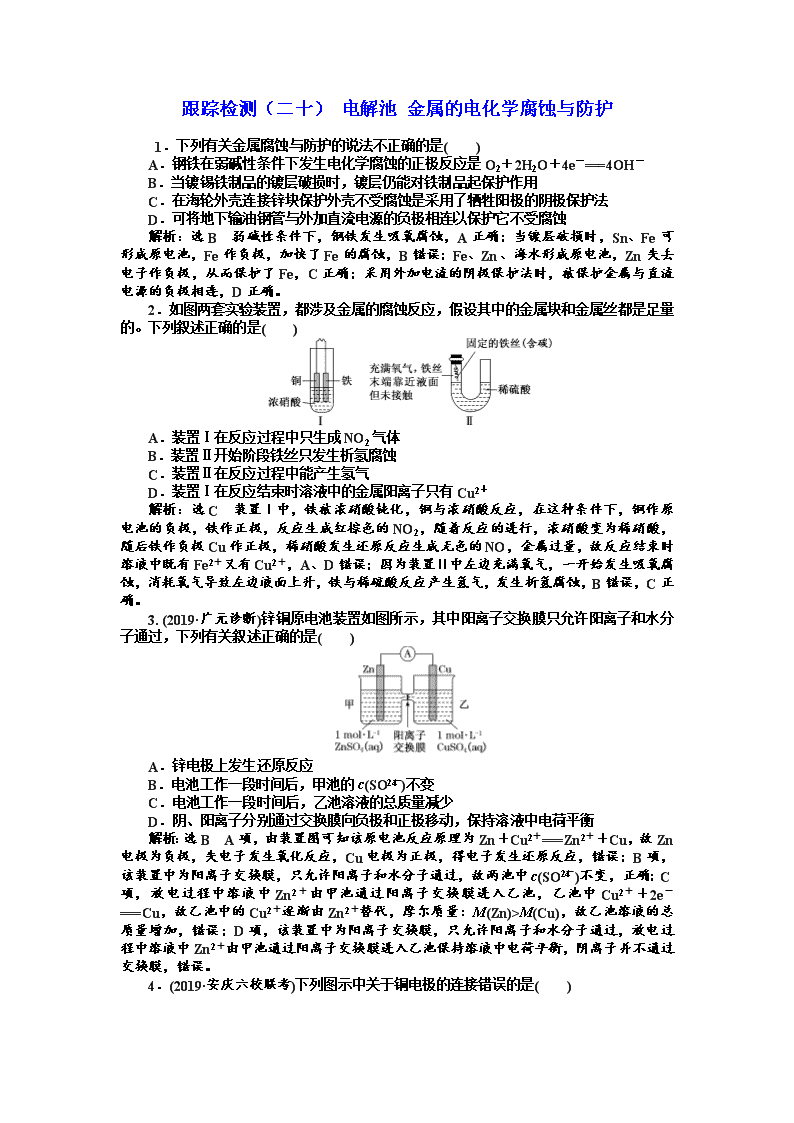
2.如图两套实验装置,都涉及金属的腐蚀反应,假设其中的金属块和金属丝都是足量的。下列叙述正确的是( )
A.装置Ⅰ在反应过程中只生成NO2气体
B.装置Ⅱ开始阶段铁丝只发生析氢腐蚀
C.装置Ⅱ在反应过程中能产生氢气
D.装置Ⅰ在反应结束时溶液中的金属阳离子只有Cu2+
解析:选C 装置Ⅰ中,铁被浓硝酸钝化,铜与浓硝酸反应,在这种条件下,铜作原电池的负极,铁作正极,反应生成红棕色的NO2,随着反应的进行,浓硝酸变为稀硝酸,随后铁作负极Cu作正极,稀硝酸发生还原反应生成无色的NO,金属过量,故反应结束时溶液中既有Fe2+又有Cu2+,A、D错误;因为装置Ⅱ中左边充满氧气,一开始发生吸氧腐蚀,消耗氧气导致左边液面上升,铁与稀硫酸反应产生氢气,发生析氢腐蚀,B错误,C正确。
3. (2019·广元诊断)锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )
A.锌电极上发生还原反应
B.电池工作一段时间后,甲池的c(SO)不变
C.电池工作一段时间后,乙池溶液的总质量减少
D.阴、阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
解析:选B A项,由装置图可知该原电池反应原理为Zn+Cu2+===Zn2++Cu,故Zn电极为负极,失电子发生氧化反应,Cu电极为正极,得电子发生还原反应,错误;B项,该装置中为阳离子交换膜,只允许阳离子和水分子通过,故两池中c(SO)不变,正确;C项,放电过程中溶液中Zn2+由甲池通过阳离子交换膜进入乙池,乙池中Cu2++2e-===Cu,故乙池中的Cu2+逐渐由Zn2+替代,摩尔质量:M(Zn)>M(Cu),故乙池溶液的总质量增加,错误;D项,该装置中为阳离子交换膜,只允许阳离子和水分子通过,放电过程中溶液中Zn2+由甲池通过阳离子交换膜进入乙池保持溶液中电荷平衡,阴离子并不通过交换膜,错误。
4.(2019·安庆六校联考)下列图示中关于铜电极的连接错误的是( )
解析:选C A项,锌比铜活泼,锌作负极,铜作正极,连接正确;B项,电解精炼铜,粗铜作阳极,纯铜作阴极,连接正确;C项,电镀时,镀件作阴极,镀层金属作阳极,连接错误;D项,电解氯化铜溶液,铜作阴极,石墨作阳极,连接正确。
5.下列关于电化学知识的说法正确的是( )
A.电解饱和食盐水在阳极得到氯气,阴极得到金属钠
B.电解精炼铜时,阳极质量的减少不一定等于阴极质量的增加
C.电解AlCl3、FeCl3、CuCl2的混合溶液,在阴极上依次析出Al、Fe、Cu
D.电解CuSO4溶液一段时间后(Cu2+未反应完),加入适量Cu(OH)2可以使溶液恢复至原状态
解析:选B A项,电解饱和食盐水在阳极Cl-失电子得到Cl2,阴极H+得电子得到H2和NaOH,错误;B项,阳极除铜放电外,比铜活泼的金属如Zn、Fe也放电,但阴极上只有Cu2+放电,正确;C项,根据金属活动性顺序可知,阴极上离子的放电顺序是Fe3+>Cu2+>H+>Fe2+>Al3+,Fe2+和Al3+不放电,Fe3+得电子生成Fe2+,不会析出Fe和Al,错误;D项,电解 CuSO4 溶液,阴极析出Cu,阳极生成O2,应加入CuO。
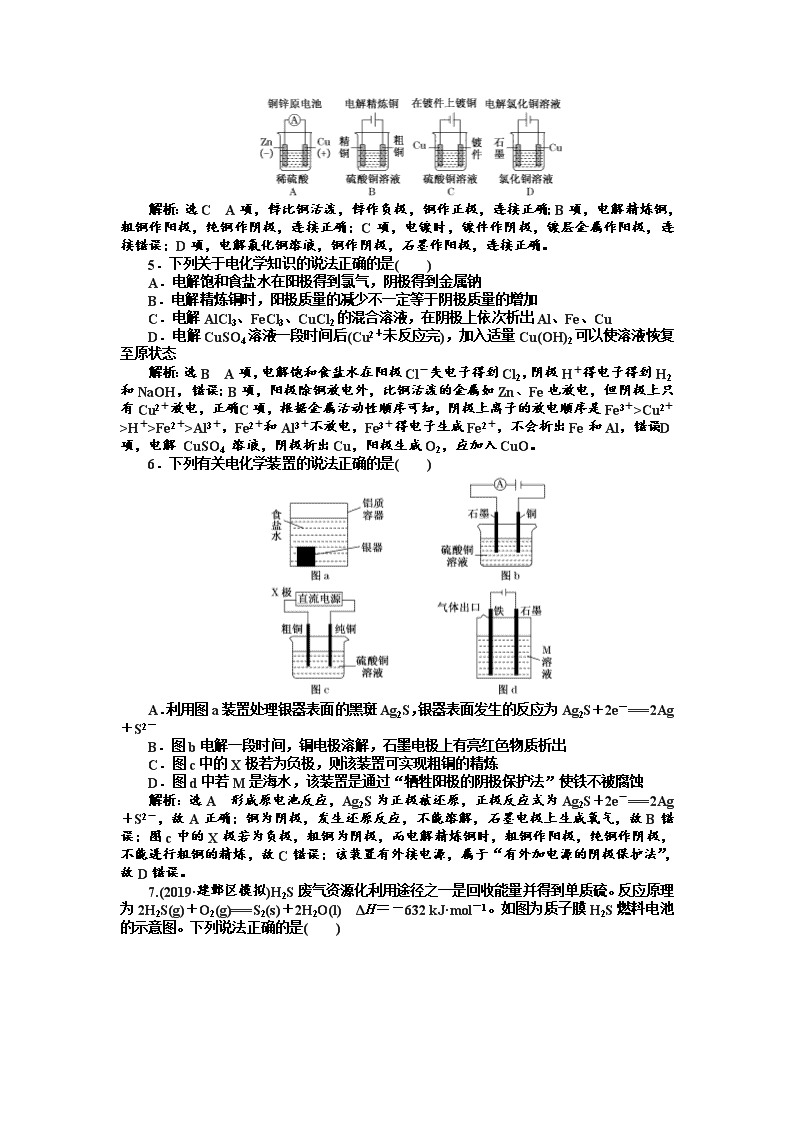
6.下列有关电化学装置的说法正确的是( )
A.利用图a装置处理银器表面的黑斑Ag2S,银器表面发生的反应为Ag2S+2e-===2Ag+S2-
B.图b电解一段时间,铜电极溶解,石墨电极上有亮红色物质析出
C.图c中的X极若为负极,则该装置可实现粗铜的精炼
D.图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
解析:选A 形成原电池反应,Ag2S为正极被还原,正极反应式为Ag2S+2e-===2Ag+S2-,故A正确;铜为阴极,发生还原反应,不能溶解,石墨电极上生成氧气,故B错误;图c中的X极若为负极,粗铜为阴极,而电解精炼铜时,粗铜作阳极,纯铜作阴极,不能进行粗铜的精炼,故C错误;该装置有外接电源,属于“有外加电源的阴极保护法”,故D错误。
7.(2019·建邺区模拟)H2S废气资源化利用途径之一是回收能量并得到单质硫。反应原理为2H2S(g)+O2(g)===S2(s)+2H2O(l) ΔH=-632 kJ·mol-1。如图为质子膜H2S燃料电池的示意图。下列说法正确的是( )
A.电极a为电池的正极
B.电极b上发生的电极反应为O2+2H2O+4e-===4OH-
C.电路中每流过4 mol电子,电池内部释放632 kJ热能
D.每17 g H2S参与反应,有1 mol H+经质子膜进入正极区
解析:选D 由2H2S+O2===S2+2H2O得出负极H2S失电子发生氧化反应,则a为电池的负极,故A错误;正极O2得电子发生还原反应,所以电极b上发生的电极反应为O2+4H++4e-===2H2O,故B错误;电路中每流过4 mol电子,则消耗1 mol氧气,但该装置将化学能转化为电能,所以电池内部几乎不放出热能,故C错误;每17 g即=0.5 molH2S 参与反应,则消耗0.25 mol氧气,则根据O2+4H++4e-===2H2O可知,有1 mol H+经质子膜进入正极区,故D正确。
8.按如图所示装置进行下列不同的操作,其中不正确的是( )
A.铁腐蚀的速率由快到慢的顺序:只闭合K3>只闭合K1>都断开>只闭合K2
B.只闭合K3,正极的电极反应式:2H2O+O2+4e-===4OH-
C.先只闭合K1,一段时间后,漏斗内液面上升,然后只闭合K2,漏斗内液面上升
D.只闭合K2,U形管左、右两端液面均下降
解析:选A 金属腐蚀速率:电解池的阳极>原电池的负极>化学腐蚀>原电池的正极>电解池的阴极,闭合K3,是原电池,铁作负极;闭合K2,是电解池,铁作阴极;闭合K1,铁作阳极,因此腐蚀速率由快到慢的顺序:只闭合K1>只闭合K3>都断开>只闭合K2,故A错误;只闭合K3,构成原电池,铁棒发生吸氧腐蚀,正极反应式:O2+2H2O+4e-===4OH-,故B正确;先只闭合K1,铁作阳极,阳极反应式为Fe-2e-===Fe2+,阴极反应式为2H++2e-===H2↑,U形管中气体压强增大,因此漏斗中液面上升;然后只闭合K2,铁作阴极,阴极反应式为2H++2e-===H2↑,阳极反应式为2Cl--2e-===Cl2↑,U形管中气体压强增大,漏斗中液面上升,故C正确;根据选项C的分析,只闭合K2,两极均有气体放出,气体压强增大,左、右两端液面均下降,故D正确。
9.(2019·合肥模拟)如图所示,甲池的总反应式为N2H4+O2===N2+2H2O。下列说法正确的是( )
A.甲池中负极上的电极反应式为N2H4-4e-===N2+4H+
B.乙池中石墨电极上发生的反应为4OH--4e-===2H2O+O2↑
C.甲池溶液pH增大,乙池溶液pH减小
D.甲池中每消耗0.1 mol N2H4,乙池理论上最多产生 6.4 g 固体
解析:选B 由图知甲池是燃料电池,乙池是电解池,甲池的电解质溶液是KOH溶液,则负极不可能生成H+,应为N2H4-4e-+4OH-===N2+4H2O,A错误;乙池的石墨电极是阳极,发生氧化反应,B正确;甲池总反应中生成了水,则KOH溶液浓度变小,pH
减小,乙池生成Cu、O2、H2SO4,溶液pH减小,C错误;根据各个电极流过的电量相等知,N2H4~2Cu,甲池每消耗0.1 mol N2H4,乙池理论上会析出12.8 g铜,D错误。
10.如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。下列有关说法正确的是( )
A.反应一段时间后,乙装置中在铁电极区生成氢氧化钠
B.乙装置中铁电极为阴极,电极反应式为Fe-2e-===Fe2+
C.通入氧气的一极为正极,发生的电极反应为O2-4e-+2H2O===4OH-
D.反应一段时间后,丙装置中硫酸铜溶液浓度保持不变
解析:选A 甲装置为甲醚燃料电池,充入氧气的一极发生还原反应,为电极的正极,充入甲醚的一极为电极的负极;乙装置为电解饱和氯化钠溶液的装置,根据串联电池中电子的转移,可知Fe电极为阴极,C极为阳极;丙装置为电解精炼铜的装置,精铜为阴极,粗铜为阳极。乙装置中铁电极发生的反应为2H++2e-===H2↑,根据电荷守恒知Na+移向阴极,在铁电极处生成氢氧化钠,A正确,B错误;正极发生还原反应,反应式为O2+4e-+2H2O===4OH-,C错误;粗铜极除了铜发生氧化反应外,活动性在铜前面的杂质金属也会反应,但在精铜极,只有Cu2+被还原,根据电荷守恒,硫酸铜溶液浓度减小,D错误。
11.四甲基氢氧化铵[(CH3)4NOH]常用作电子工业清洗剂,以四甲基氯化铵[(CH3)4NCl]为原料,采用电渗析法合成(CH3)4NOH,其工作原理如图所示(a、b为石墨电极,c、d、e为离子交换膜),下列说法不正确的是( )
A.N为正极
B.标准状况下制备0.75NA (CH3)4NOH,a、b两极共产生16.8 L 气体
C.c、e均为阳离子交换膜
D.b极电极反应式:4OH--4e-===O2↑+2H2O
解析:选B 电解后左侧(CH3)4NOH溶液由稀变浓,说明a极发生还原反应,2H2O+2e-===H2↑+2OH-,据此判断a为阴极,b为阳极,所以N为正极,故A正确;b极为OH-放电生成O2:4OH--4e-===O2↑+2H2O,标准状况下制备0.75NA(CH3)4NOH,需要阴极提供0.75 mol OH-,转移电子0.75 mol,a、b两极共产生+mol×22.4 L·mol-1=12.6 L气体,故B错误,D正确;(CH3)4NOH溶液由稀变浓,说明(CH3)4N+穿过c膜,c膜是阳离子交换膜,NaCl溶液由稀变浓,说明Na+穿过e膜,e膜是阳离子交换膜,故C正确。
12.如图A为碱性硼化钒(VB2)—空气电池示意图,两极用离子交换膜隔开,VB2放电时生成两种氧化物。若用该电池为电源,用惰性电极电解硫酸铜溶液,实验装置如图B所示。则下列说法错误的是( )
A.碱性硼化钒(VB2)—空气电池中使用阴离子交换膜
B.外电路中电子由VB2电极流向c电极
C.电解过程中,b电极表面产生的气体可以收集后充入A池中的电极循环利用
D.VB2电极发生的电极反应为2VB2-22e-+11H2O===V2O5+2B2O3+22H+
解析:选D 硼化钒—空气燃料电池中,VB2在负极失电子,氧气在正极得电子,电池总反应为4VB2+11O2===4B2O3+2V2O5,VB2放电时生成两种氧化物,氧化物会和酸反应,所以电池中使用阴离子交换膜,故A正确;VB2极是负极,外电路中电子由VB2电极流向阴极c电极,故B正确;电解过程中,b电极是阳极,该电极表面产生的气体是氧气,可以收集后充入A池中的电极循环利用,故C正确;负极上是VB2失电子发生氧化反应,因在碱性环境中,VB2极发生的电极反应为2VB2+22OH--22e-===V2O5+2B2O3+11H2O,故D错误。
13.Ⅰ.某实验小组同学对电化学原理进行了一系列探究活动。
(1)如图1所示为某实验小组设计的原电池装置,反应前电极质量相等,一段时间后两电极质量相差12 g,导线中通过________mol电子。
(2)如图1,其他条件不变,若将乙烧杯中的CuCl2溶液换为NH4Cl溶液,则石墨电极的电极反应方程式为____________________________________。
(3)如图2,其他条件不变,若将盐桥换成弯铜导线与石墨相连成n形,乙装置中与铜丝相连的石墨电极上发生的反应方程式为____________________________。
Ⅱ.氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(4)与汽油等燃料相比,氢气作为燃料的两个明显的优点是_______________________________________(写两点)。
(5)化工生产的副产品也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气。总反应方程式为Fe+2H2O+2OH-FeO+3H2↑,工作原理如图3所示。装置通电后,铁电极附近生成紫红色的FeO,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
①电解一段时间后,c(OH-)降低的区域在__________(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是_________________________________________________。
③c(Na2FeO4)随初始c(NaOH)的变化如图4所示,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:__________________________________________________。
解析:(1)图1为原电池反应,Fe为负极,发生反应Fe-2e-===Fe2+,石墨为正极,发生反应Cu2++2e-===Cu,总反应式为Fe+Cu2+===Fe2++Cu。一段时间后,两电极质量相差12 g,则
Fe+Cu2+===Fe2++Cu 质量差Δm 转移电子
56 g 64 g (56+64)g=120 g 2 mol
12 g n
则n=0.2 mol。(2)若将CuCl2溶液换为NH4Cl溶液,溶液呈酸性,NH在正极放电,电极反应式为2NH+2e-===2NH3↑+H2↑。(3)若将盐桥换成弯铜导线与石墨相连成n形,甲装置发生铁的吸氧腐蚀,铁为负极,铜为正极,则乙装置石墨为阳极,石墨(Ⅰ)为阴极,乙为电解池装置,阳极反应式为2Cl--2e-===Cl2↑。(5)①根据题意镍电极有气泡产生是H+放电生成氢气,铁电极发生氧化反应,溶液中的OH-减少,因此电解一段时间后,c(OH-)降低的区域在阳极室。②氢气具有还原性,根据题意Na2FeO4只在强碱性条件下稳定,易被H2还原,故电解过程中须将阴极产生的气体及时排出,防止Na2FeO4与H2反应使产率降低。③根据题意Na2FeO4只在强碱性条件下稳定,在M点,c(OH-)低,Na2FeO4稳定性差,且反应慢,在N点:c(OH-)过高,铁电极上有Fe(OH)3生成,使Na2FeO4产率降低。
答案:(1)0.2 (2)2NH+2e-===2NH3↑+H2↑
(3)2Cl--2e-===Cl2↑
(4)燃烧热值高、燃烧无污染、是可再生能源(任写两点)
(5)①阳极室 ②防止生成的H2与高铁酸钠反应,使高铁酸钠的产率降低 ③M点:氢氧根浓度偏低,高铁酸钠的稳定性差,且反应较慢(或N点:氢氧根浓度较高,铁电极上容易生成氢氧化铁,使高铁酸钠的产率降低)
14.Ⅰ.用图1所示装置实验,U形管中a为25 mL CuSO4溶液,X、Y为电极。
(1)若X为铁,Y为纯铜,则该装置所示意的是工业上常见的________池,阳极反应式为________________________________________________________________________。
(2)若X为纯铜,Y为含有Zn、Ag、C等杂质的粗铜,则该图所示意的是工业上常见的____________装置。反应过程中,a溶液的浓度________发生变化(填“会”或“不会”)。
Ⅱ.现代氯碱工业常用阳离子交换膜将电解槽隔成两部分,以避免电解产物之间发生二次反应。图2为电解槽示意图。
(3)阳离子交换膜,只允许溶液中的______通过(填标号)。
①H2 ②Cl2 ③H+ ④Cl- ⑤Na+ ⑥OH-
(4)写出阳极的电极反应式:__________________________________________。
(5)已知电解槽每小时加入10%的氢氧化钠溶液10 kg,每小时能收集到标准状况下氢气896 L,而且两边的水不能自由流通。则理论上:
①电解后流出的氢氧化钠溶液中溶质的质量分数为__________________。
②通过导线的电量为________________。(已知NA = 6.02×1023 mol-1,电子电荷为1.60×10-19 C)
解析:(3)阳离子交换膜,只允许阳离子通过,所以H+、Na+可以通过。(5)m(NaOH)原=10 kg×10%=1 kg。在阴极区,H+放出,但又有Na+移来,引起阴极区增重,所以有2H2O→H2~2NaOH~增重2[M(Na)-M(H)]~转移2e-
===
解得m(NaOH)生成=3 200 g=3.2 kg,m(溶液)增=1 760 g=1.76 kg,Q≈7.71×106 C
,故w(NaOH) =×100%=×100%≈35.7%。
答案:(1)电镀 Cu-2e-===Cu2+
(2)铜的电解精炼 会 (3)③⑤
(4)2Cl--2e-===Cl2↑ (5)①35.7% ②7.71×106 C