- 1.20 MB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
永州市2020年高考第三次模拟考试试卷
理科综合能力测试 化学部分
可能用到的相对原子质量:H1 Li7 O16 F19 Na23 P31 Cl35.5 Cu64
第I卷
一、选择题:本题共13小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。
7.化学在2020年抗击COVID-19疫情中发挥了重要作用,下列说法中不正确的是
A.在医疗消毒时,无水酒精比75%的酒精溶液效果更好
B.“84消毒液”常用于公共场所消毒,其有效成分为次氯酸钠
C.一次性口罩中的熔喷布是以聚丙烯为主要成分的高分子材料
D.中医药在此次疫情防治中发挥了不可替代的作用,中药有效成分的提取常采用萃取的方法
8.下列对于有机化合物的说法中,正确的是
A.(a)、(b)、(c)都能使酸性高锰酸钾溶液褪色
B.(a)、(b)、(c)的二氯代物都有3种不同结构
C.(a)与CH≡C-CH=CH2互为同分异构体
D.1 mol(c)生成1 mol C8H18至少需要消耗4 mol H2
9.下列有关实验操作、现象及结论都正确的是
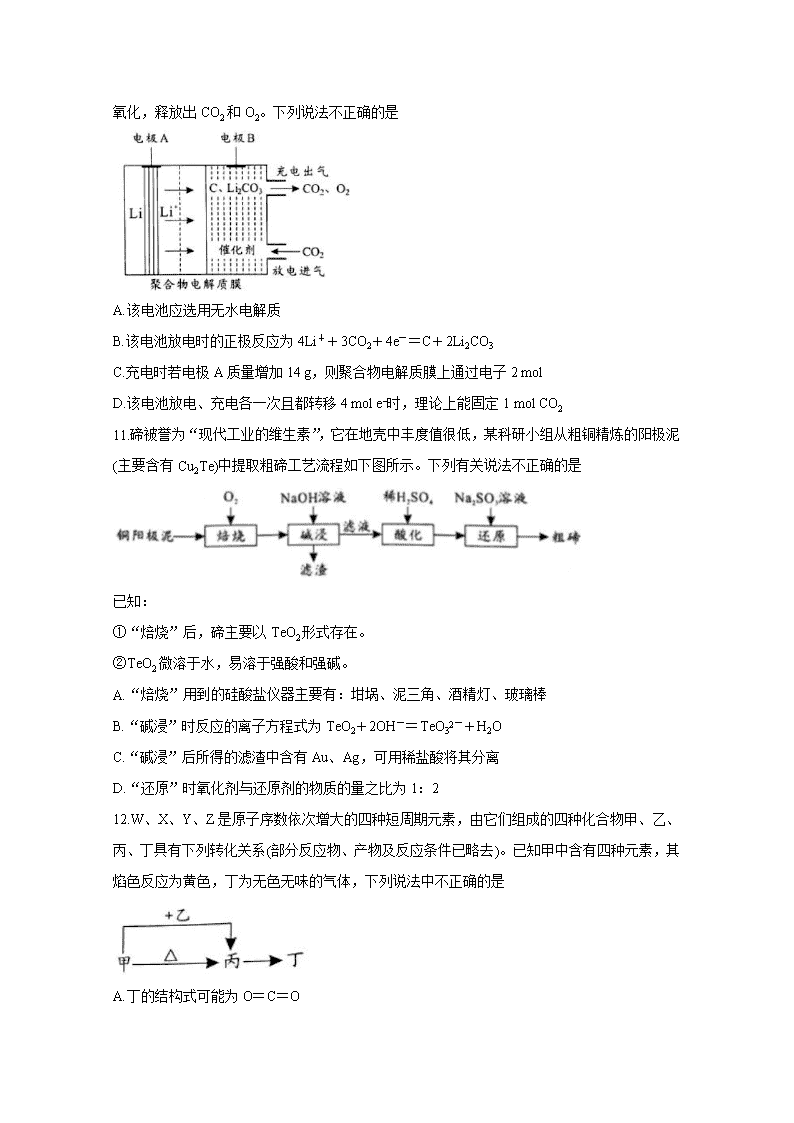
10.2019年诺贝尔化学奖授予对锂离子电池研究有突出贡献的科学家。一种“大气固碳”的锂离子电池工作原理如下图所示,该电池在充电时,通过催化剂的选择性控制,只有Li2CO3
被氧化,释放出CO2和O2。下列说法不正确的是
A.该电池应选用无水电解质
B.该电池放电时的正极反应为4Li++3CO2+4e-=C+2Li2CO3
C.充电时若电极A质量增加14 g,则聚合物电解质膜上通过电子2 mol
D.该电池放电、充电各一次且都转移4 mol e−时,理论上能固定1 mol CO2
11.碲被誉为“现代工业的维生素”,它在地壳中丰度值很低,某科研小组从粗铜精炼的阳极泥(主要含有Cu2Te)中提取粗碲工艺流程如下图所示。下列有关说法不正确的是
已知:
①“焙烧”后,碲主要以TeO2形式存在。
②TeO2微溶于水,易溶于强酸和强碱。
A.“焙烧”用到的硅酸盐仪器主要有:坩埚、泥三角、酒精灯、玻璃棒
B.“碱浸”时反应的离子方程式为TeO2+2OH-=TeO32-+H2O
C.“碱浸”后所得的滤渣中含有Au、Ag,可用稀盐酸将其分离
D.“还原”时氧化剂与还原剂的物质的量之比为1:2
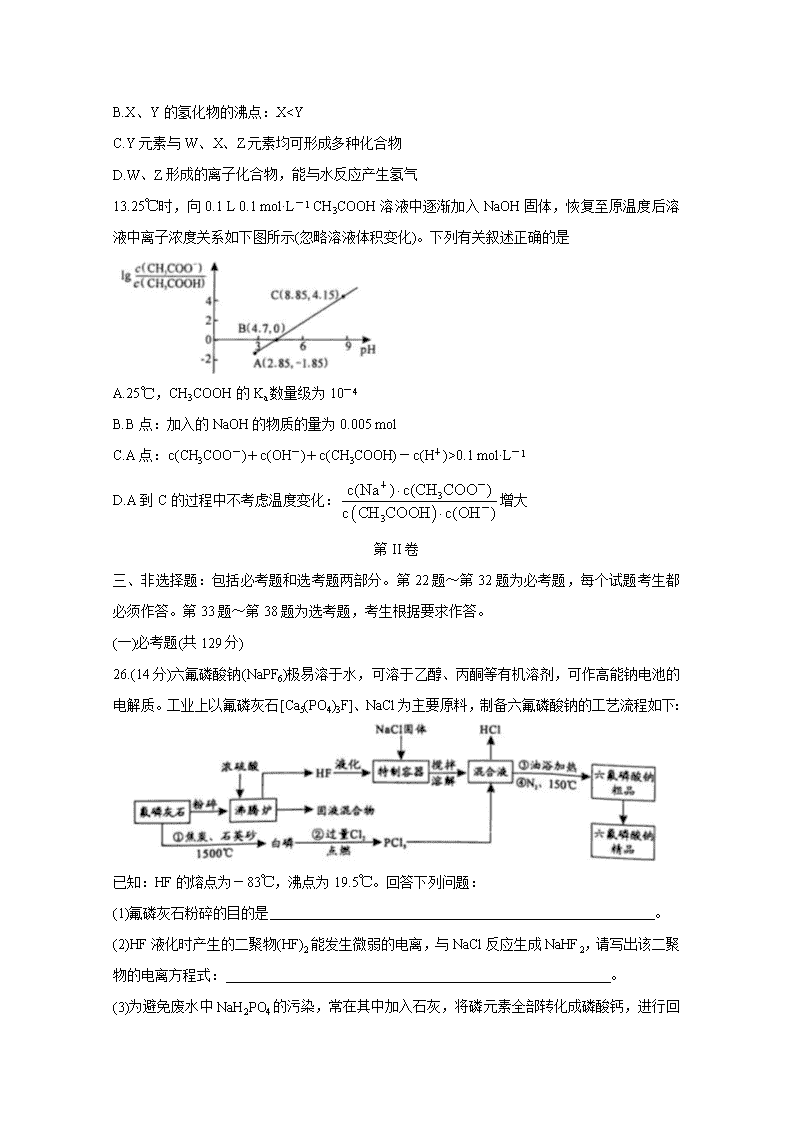
12.W、X、Y、Z是原子序数依次增大的四种短周期元素,由它们组成的四种化合物甲、乙、丙、丁具有下列转化关系(部分反应物、产物及反应条件已略去)。已知甲中含有四种元素,其焰色反应为黄色,丁为无色无味的气体,下列说法中不正确的是
A.丁的结构式可能为O=C=O
B.X、Y的氢化物的沸点:X0.1 mol·L-1
D.A到C的过程中不考虑温度变化:增大
第II卷
三、非选择题:包括必考题和选考题两部分。第22题~第32题为必考题,每个试题考生都必须作答。第33题~第38题为选考题,考生根据要求作答。
(一)必考题(共129分)
26.(14分)六氟磷酸钠(NaPF6)极易溶于水,可溶于乙醇、丙酮等有机溶剂,可作高能钠电池的电解质。工业上以氟磷灰石[Ca5(PO4)3F]、NaCl为主要原料,制备六氟磷酸钠的工艺流程如下:
已知:HF的熔点为-83℃,沸点为19.5℃。回答下列问题:
(1)氟磷灰石粉碎的目的是 。
(2)HF液化时产生的二聚物(HF)2能发生微弱的电离,与NaCl反应生成NaHF2,请写出该二聚物的电离方程式: 。
(3)为避免废水中NaH2PO4
的污染,常在其中加入石灰,将磷元素全部转化成磷酸钙,进行回收利用。已知常温下Ksp[Ca3(PO4)2]=1.96×10-29,当处理后的废水中c(Ca2+)=1.0×10-3 mol·L-1时,则溶液中c(PO43-)= mol·L-1。
(4)操作③油浴加热目的是 。
(5)反应①中除生成白磷(P4)外,还产生SiF4和一种还原性气体,写出该反应的化学方程式: 。
(6)六氟磷酸钠粗品的提纯:将六氟磷酸钠粗品(杂质主要是微量铁盐)溶于一定量乙醇中,加入适量5%的NaOH甲醇溶液,使溶液保持碱性,离心将不溶杂质除去。通过 (填操作方法)将溶剂回收,减压条件下结晶,得到NaPF6·H2O,干燥得到无水盐。当加入NaCl的质量为117.0 g时,实验中得到六氟磷酸钠精品283.0 g,则产率为 (结果保留3位有效数字)。
27.(14分)二氧化氯(ClO2)与亚氯酸钠(NaClO2)都具有强氧化性。两者作漂白剂时,不伤害织物;作饮用水消毒剂时,不残留异味。某研究性学习小组利用如下装置由二氧化氯制备NaClO2·3H2O,并探究其性质。
查阅资料:
①ClO2易与碱反应生成亚氯酸盐和氯酸盐。
②NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
回答下列问题:
(1)仪器a的名称 。
(2)装置A中发生反应的化学方程式: 。
(3)如果撤去C装置中的冷水浴,导致产品中可能混有的杂质是 。
(4)若要从装置C反应后的溶液获得无水NaClO2晶体的操作步骤如下,请完成下列操作步骤③的内容。
①减压,55℃蒸发结晶; ②趁热过滤;
③ ; ④低于60℃干燥,得到成品。
(5)写出装置C反应的离子方程式 。
(6)实验结束后,继续通入一段时间N2的目的是 。
(7)利用题中原理制备出NaClO2·3H2O晶体的试样,可以用“间接碘量法”测定试样(杂质与I-不发生反应)的纯度,过程如下:(已知:I2+2S2O32-=S2O62-+2I-)取样品0.6000 g于锥形瓶中,加入足量KI固体和适量稀H2SO4,再滴加几滴淀粉溶液,然后用0.5000 mol·L-1 Na2S2O3标准溶液滴定,当出现 (填实验现象),达到滴定终点,共消耗该标准溶液25.00 mL,经计算该试样中NaClO2·3H2O的百分含量为 (结果保留3位有效数字)。
28.(15分)大气中NOx、SO2等污染物的有效去除和资源的充分利用是当今社会的重要研究课题,目前采用的方法如下:
I.直接转化法:利用高效催化剂将汽车尾气直接转化为无毒物质。
已知:N2(g)+O2(g)=2NO(g) △H1=+180 kJ·mol-1
(1)利用固体表面催化工艺将NO分解为N2、O2而消除污染。
用分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如下图所示。从吸附到解吸的过程中,能量状态最低的是 (填字母序号)。
(2)利用稀土等催化剂能将汽车尾气中的CO、NO直接转化成无毒物质N2、CO2。
①已知:C(s)、CO(g)的燃烧热分别为393 kJ·mol-1、283 kJ·mol-1,写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式 。
②为研究上述反应,某学习小组在密闭容器中充入10 mol CO和10 mol NO,发生上述①所写反应,实验测得平衡时NO的体积分数随温度、压强的关系如下图。
a.某温度下的平衡状态D点,若同时采取缩小容器体积和降低温度,重新达到平衡状态时,可能到达图中A~G点中的 点。
b.当压强为10MPa、温度为T时的平衡常数Kp= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;保留3位有效数字)。
II.催化还原法:利用还原剂在催化剂的作用下将氮氧化物转为无毒物质N2、CO2。
(3)用活性炭还原法可以处理汽车尾气中的氮氧化物。
某研究小组在2L的恒容密闭容器中加入一定量的NO和足量的固体活性炭,发生反应:C(s)+2NO(g)N2(g)+CO2(g)。在不同温度下测得平衡体系中各物质的物质的量如下表:
①该反应的正反应为 (填“吸热”或“放热”)反应。
②350℃时,反应达到平衡后向恒容容器中再充入0.100 mol NO,再次达到平衡后,N2的体积分数应为 。
A.0.5 B.0.25 C.介于0.25和0.5之间 D.无法确定
III.电解法:利用电解的方法将氨氧化物转化为有用物质,从而达到资源的回收利用。
(4)如下图所示的电解装置,可将雾霾中的NO2、SO2转化为硫酸铵,从而实现废气的回收再利用,回答下列问题:
①阴极的电极反应式为 。②上图中A物质是 。
(二)选考题:共45分,请考生从给出的2道物理题、2道化学题、2道生物题中每科任选一题作答,并用2B铅笔在答题卡上把所选题目的题号涂黑。注意所做题目的题号必须与所涂题目的题号一致,在答题卡上选答区域指定位置答题。如果多做,则每学科按所做的第一题计分。
35.[化学——选修3:物质结构与性质](15分)
N、P、As、Ga、Cr、Cu等元素化合物种类繁多,具有重要的研究价值和应用价值。
请回答下列问题:
(1)Cu原子的价电子排布式为 。
(2)PCl5是磷元素的重要化合物,在固态时的结构单元可以写成PCl4+、PCl6-,根据价电子互斥理论推测这两种阳离子的空间构型分别为 、 。
(3)As的核外电子排布式中不同类型(s、p、d)的电子比是 。
(4)N、P氢化物的沸点较高的是 (填化学式),其理由是 。
(5)已知N2F2分子中每个原子的最外层都达到8电子稳定结构,则氮原子的杂化轨道类型为 ,画出N2F2可能的结构式 。
(6)砷化镓以第三代半导体著称,熔点为1230℃,具有空间网状结构,性能比硅更优良,广泛用于雷达、电子计算机、人造卫星、宇宙飞船等尖端技术中,据此可知砷化镓属于 晶体。已知氮化硼与砷化镓属于同种晶体类型。则两种晶体熔点较高的是 (填化学式),其理由是 。
(7)铜的化合物种类很多,下图是氧化亚铜的晶胞结构,若最近的Cu与O的核间距离为a nm,用NA表示阿佛加德罗常数,则氧化亚铜晶体的密度是 g/cm3(列式即可)。
36.[化学——选修5:有机化学基础](15分)
3,4-二羟基肉桂酸乙酯(I)具有抗炎作用和治疗自身免疫性疾病的潜力。由化合物A制备该物质的合成路线如下:
回答下列问题:
(1)A的结构简式为 ,I中含氧官能团的名称是 。
(2)E生成F的反应类型为 。
(3)下列有关H的说法中,不正确的是 。
a.能使酸性高锰酸钾溶液褪色
b.1 mol H最多能和3 mol Br2反应
c.H分子中最多有9个碳原子共平面
d.l mol H分别与足量NaOH、NaHCO3反应时,消耗的NaOH、NaHCO3的物质的量之比为1:1
(4)写出C+D→E的化学方程式 。
(5)已知W是H的同分异构体,符合下列条件的W结构共有 种。
①属于芳香族化合物。
②1 mol W与足量NaHCO3溶液反应生成气体44.8 L(标准状况)。
其中,核磁共振氢谱有4组吸收峰,且峰面积比为1:2:2:3的结构简式为: 。
(6)季戊四醇()是合成高效润滑剂、增塑剂、表面活性剂等的原料。设计由甲醛和乙醇为原料制备季戊四醇的合成路线(无机试剂任选)。
合成路线的表示方法为:AB……目标产物 。
永州市2020年高考第三次模拟考试试卷
化学参考答案及评分标准
7.A 8.C 9.B 10.C 11.C 12.B 13.D
26.(14分)
(1) 增大反应物的接触面积,加快反应速率 (2分)
(2) (HF)2H++HF2- 或 2HFH++HF2-(2分)
(3)1.4×10-10 (2分)
高温
(4)除去残留的氟化氢(2分)
(5)4Ca5(PO4)3F+21SiO2+30C 20CaSiO3+3P4+SiF4↑+30CO↑ (2分)
(6) 蒸馏 (2分) 84.2%(2分)
27.(14分)
(1)分液漏斗 (1分)
(2) 2NaClO3 + H2SO4 + Na2SO3=== 2Na2SO4 + 2ClO2 ↑ + H2O (2分)
(3) NaClO3 、 NaCl (2分)
(4)用38℃~60℃热水洗涤 (2分)
(5) 2ClO2+H2O2+2OH-===2ClO2- +2H2O+O2( 2分)
(6)将装置内残留的ClO2全部排出,提高产率 (2分)
(7)溶液由蓝色褪为无色,且30秒内不复原 (1分) 75.3% (2分)
28.(15分)
(1) C(2分)
(2) ①2NO(g)+2CO(g)===N2(g)+2CO2(g) ΔH=-746kJ·mol-1 (2分)
②G (2分) 0.474MPa-1 (2分,不写单位也给分)
(3) ① 放热 (1分) ② B(2分)
(4)①NO2+8H++7e-=== NH4++2H2O(2分) ②H2SO4或硫酸(2分)
35.(15分)
(1)3d104s1(1分)(2)正四面体、八面体型(2分)(3)8﹕15﹕10(1分)
(4)NH3(1分)分子间存在氢键(1分)
(5)sp2(1分) 、 (2分)
(6)原子晶体(1分)BN(1分)二者均为原子晶体,BN间的键长比GaAs
的键长短,键能大(2分)
(7) 或 (2分)
36.(15分)
(1)CH2=CH2(1分) (酚)羟基、酯基(2分,漏写给1分,错写不给分)
(2)消去反应(1分) (3)bd(2分,漏选给1分,错选不给分)
(4)(2分)
(5)10(2分)(2分)
(6)
(3分,每步流程1分)