- 465.29 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
我为高考命题县(区):
学校:
姓名:
准考号:
签名:
……………………………………密…………………………………封…………………………………线……………………………………
模拟测试卷
化学部分
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号 涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。回答非选择题时, 将答案写在答题卡上,写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Fe 56 I 127 Ce 140 As 75 Ga 70
一、选择题:本题共 7 个小题,每小题 6 分,共 42 分。在每小题给出的四个选 项中,只有一项是符合题目要求的。
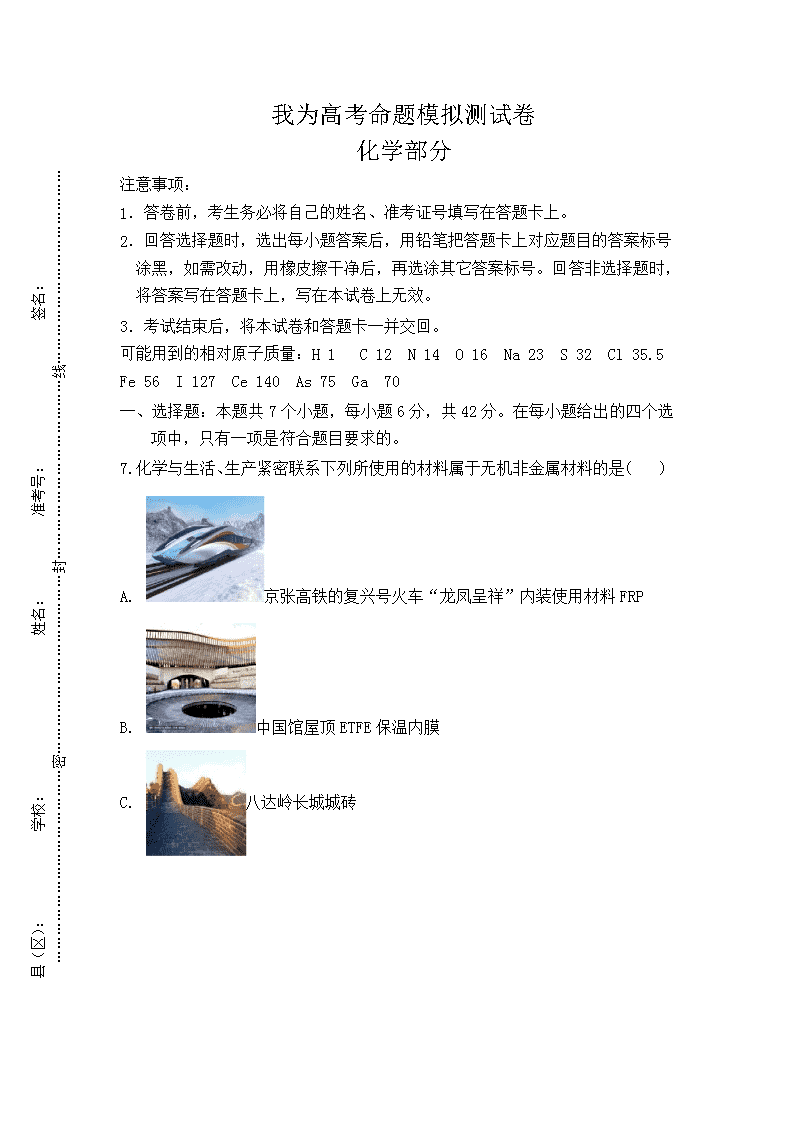
7.化学与生活、生产紧密联系下列所使用的材料属于无机非金属材料的是( )
A. 京张高铁的复兴号火车“龙凤呈祥”内装使用材料 FRP
B. 中国馆屋顶 ETFE 保温内膜
C. 八达岭长城城砖
D. N95 医用口罩中的熔喷布的主要成分
8.茚地那韦被用于新型冠状病毒肺炎的治疗,其结构简式如图所示(未画出其空 间结构)。
下列说法正确的是( ) A.茚地那韦属于芳香族化合物,难溶于水 B.虚线框内的所有碳、氧原子均处于同一平面 C.茚地那韦可与氯化铁溶液发生显色反应 D.茚地那韦在碱性条件下完全水解,最终可生成两种有机物
9.第 26 届国际计量大会修订了阿伏加德罗常数的定义,并于 2019 年 5 月 20
日正式生效。已知 NA 表示阿伏伽德罗常数的值,下列说法不.正.确.的是( )
-1
A.反应 3H2(g)+N2(g)2NH3(g) Δ H=-92kJ·mol
电子 0.6NA
,当放出 9.2kJ 热量时,转移
B.常温下电解饱和食盐水,当溶液 pH 由 7 变为 13 时,电路中转移的电子数为
0.1NA
C.1 mol HI 被氧化为 I2 时转移的电子数为 NA
-
D.将 0.1 mol CH3COONa 溶于稀醋酸中使溶液呈中性,溶液中 CH3COO 数目等于
0.1NA
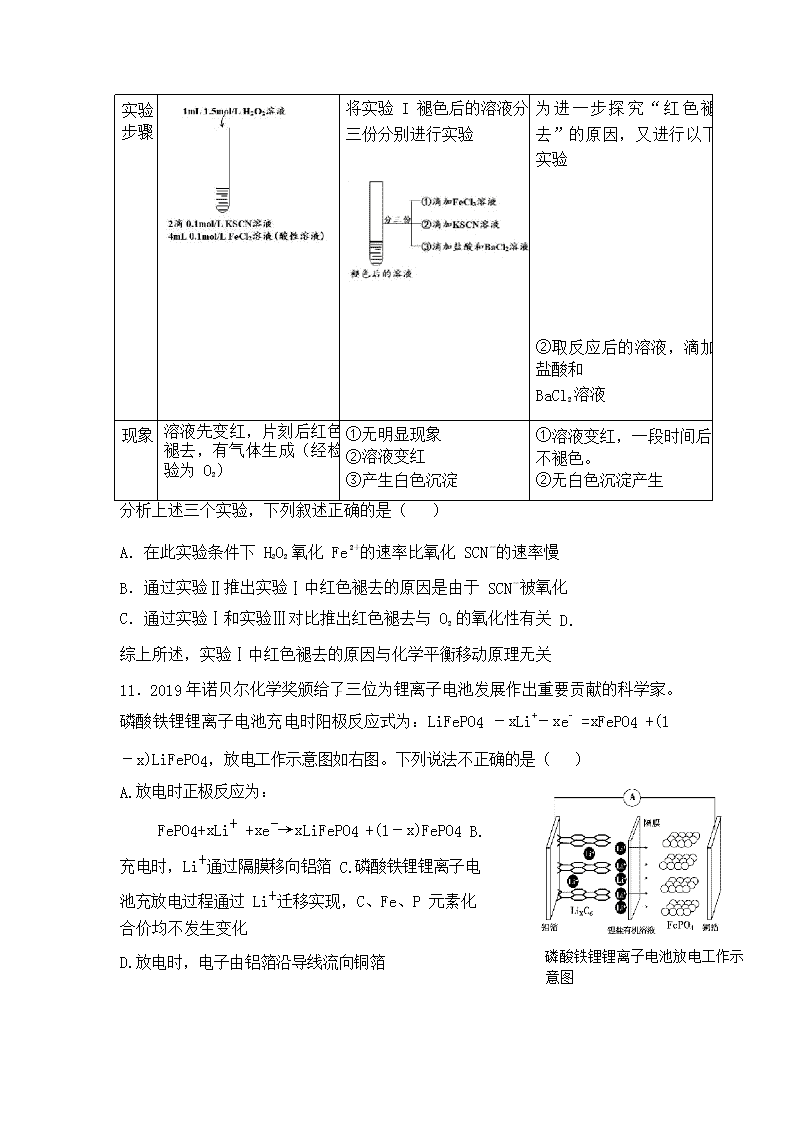
10.贫血患者在日常生活中多食用含铁丰富的食物,某小组在 Fe2+检验实验中观 察到异常现象,为探究“红色褪去”的原因,进行如下实验:
编号 实验 I 实验 II 实验 III
实验 步骤
将实验 I 褪色后的溶液分 三份分别进行实验
为进一步探究“红色褪 去”的原因,又进行以下 实验
②取反应后的溶液,滴加 盐酸和
BaCl2 溶液
现象
溶液先变红,片刻后红色 褪去,有气体生成(经检 验为 O2)
①无明显现象
②溶液变红
③产生白色沉淀
①溶液变红,一段时间后 不褪色。
②无白色沉淀产生
分析上述三个实验,下列叙述正确的是( )
2+ -
A.在此实验条件下 H2O2 氧化 Fe
的速率比氧化 SCN
的速率慢
B.通过实验Ⅱ推出实验Ⅰ中红色褪去的原因是由于 SCN-被氧化
C.通过实验Ⅰ和实验Ⅲ对比推出红色褪去与 O2 的氧化性有关 D.综上所述,实验Ⅰ中红色褪去的原因与化学平衡移动原理无关
11.2019 年诺贝尔化学奖颁给了- 三位为锂离子电池发展作出重要贡献的科学家。
磷酸铁锂锂离子电池充电时阳极反应式为:LiFePO4 -xLi+-xe- =xFePO4 +(1
-x)LiFePO4,放电工作示意图如右图。下列说法不正确的是( ) A.放电时正极反应为:
FePO4+xLi+ +xe-→xLiFePO4 +(1-x)FePO4 B.充电时,Li+通过隔膜移向铝箔 C.磷酸铁锂锂离子电池充放电过程通过 Li+迁移实现,C、Fe、P 元素化合价均不发生变化
D.放电时,电子由铝箔沿导线流向铜箔 磷酸铁锂锂离子电池放电工作示 意图
12.室温下,向 100mL.饱和的 H2S 溶液中通入 SO2 气体(气 体体积换算成标准状况),发生反应:2H2S+SO2=3S↓+2H2O, 测得溶液 pH 与通入 SO2 关系如右图所示。有关说法错误的 是( )
A. a 点水的电离程度最大
B.该温度下 H2S 的 K al
» 10
-7.2
C.曲线 y 代表继续通入 SO3 气体后溶液 pH 的变化
c(HSO - )
D. a 点之后,随 SO2 气体的通入,
3
c(H 2 SO3 )
值始终减小
13.短周期主族元素 W、X、Y、Z 的原子序数依次增大,X 的原子半径是所有短 周期主族元素中最大的,W 的核外电子数与 X、Z 的最外层电子数之和相等,Y 的原子序数是 Z 的最外层电子数的 2 倍,由 W、X、Y 三种元素形成的化合物 M 的结构如图所示。下列叙述正确的是( )
A.W 的氢化物的沸点低于 Z 的氢化物的沸点 B.元素非金属性强弱的顺序为 Z>Y>W
C.W 分别与 X、Y、Z 形成的二元化合物均只有一种 D.化合物 M 中 W 都满足 8 电子稳定结构
二、非选择题:共 58 分。第 26~28 题为必考题,每个试题考生都必须作答。 第 35~36 题为选考题,考生根据要求作答。
(一)必考题:共 43 分。
26.(14 分)过氧乙酸(CH3COOOH)是一种常用的消毒剂,易溶于水、易挥发、见 光或受热易分解。其制备原理为: △H<0,
同时利用乙酸丁酯与水形成共沸物(沸点 90.7℃)及时分离出水,以提高产率。
实验装置如下图。
(1)过氧乙酸保存时应注意 (填标号)。
A.避光 B.低温 C.密闭 D.隔绝空气
(2)仪器 a 的名称为 ,其中盛放的试剂为 (填“乙酸”或“双氧水”)。 (3)为减少反应瓶中乙酸丁酯的损耗,反应开始前在油水分离器中应进行的操作
是 。 (4)反应体系采用减压的目的是 。 (5)过氧乙酸(含有少量 H2O2 杂质)的含量测定流程如下图。
①判断 H2O2 恰好除尽的实验现象是 。
②过氧乙酸被 Fe2+还原,还原产物之一为乙酸,其离子方程式为
-1 -1
③若样品体积为 Vo mL,加入 c1mol.L
FeSO4 溶液 V1mL,消耗 c2mol.L
K2Cr2O7 溶液
2
V mL。则过氧乙酸含量为 g.L-l。
27.(14 分)2019 年 6 月 5 日美国商务部表示,美方将采取“空前行动”,确
保对科技业和军方极其关键的战略性矿物及稀土供应无虞。我国稀土出口量世界 第一。以氟碳铈矿(主要含 CeFCO3,少量其他稀土盐 LnFCO3、非稀土元素 Fe2O3、 Al2O3、MgO 和 SiO2 等)为原料制备 CeO2 的一种工艺流程如下:
( 1 ) “ 氧 化 焙 烧 ” 前 需 将 矿 石 粉 碎 成 细 颗 粒 , 其 目 的 是
。
“氧化焙烧”时,CeFCO3 和其他稀土盐 LnFCO3 分别转化为 CeO2 和 Ln2O3,请
写出生成的 CeO2 化学方程式为: 。
(2)“氯化”过程的目的是将 CeO2 和 Ln2O3 分别转化为可溶性的 CeCl3 和 LnCl3,
3+
除去 Fe2O3、Al2O3、MgO、SiO2 等杂质。若溶液中 c(Ce
)=0.01mol/L,为确
保不析出 Ce(OH)3 沉淀,则溶液的 pH (填 pH 的范围)。(已知
-20
Ksp[Ce(OH)3=1.0×10
])
(3)CeO2 和 Ln2O3 混合物中加入稀盐酸,Ln2O3 溶解生成 LnOCl 的化学方程式为:
。
(4)化工生产条件的选择:
①“氯化”条件的选择
将氧化焙烧后氟碳铈矿和氯化铵按 1:3、1:4、1:5、1:6、1:7 质量比混合, 在 325℃下真空焙烧 60min。稀土矿氧化物转化成稀土氯化物的氯化率如下 图所示:
氧化焙烧后氟碳铈矿和氯化铵的最佳质量比为 。
②“氧化”条件的选择氧化过程中,反应温度、反应时间对混合稀土氯化物 氧化率的关系如下图所示:
最 佳 温 度 和 时 间 是
, 原 因 是
。
(5)取上述流程中得到的 CeO2 产品 0.4500g,加硫酸溶解后,用 0.1000mol•
4
L-1FeSO
标准溶液滴定至终点时(铈被还原为 Ce3+,其它杂质均不反应),
消耗 25.00mL 标准溶液.该产品中 CeO2 的质量分数为 。
28.(15 分)氮硫的氧化物是造成大气污染的主要物质。研究它们的反应机理, 对于消除环境污染有重要意义。
(1)2NO (g)+O2(g)= 2NO2(g) △H 的反应机理和各基元反应(基元反应是指在 反应中一步直接转化为产物的反应,又称为简单反应)的活化能为:
-1
①2NO(g) +O2(g) 2NO2(g) △H= kJ•mol
应速率常数 k1、k-1、k2、 k-2 的关系式为 K= ;
,平衡常数 K 与上述反
-2 2
-2 -1
②某温度下反应 2NO(g) +O2(g) 2NO2(g)的速率常数 k=8.8×10
L •mol •s ,
当反应物浓度都是 0.05mol• L-1 时,反应的速率是 mol •
L-1•s-1;若此时缩小容器的体积,使气体压强增大为原来的 2 倍,则反应速率增 大为之前的 倍。
(2)2SO2(g)+O2(g) 2SO3 (g)反应过程中能量变化如图 28-1 所示。在 V2O5
存在时,该反应的机理为:V2O5+SO2 2VO2+SO3(快) 4VO2+O2 2V2O5(慢)
下列说法正确的是( )
A.反应速率主要取决于 V2O5 的质量 B.VO2 是该反应的催化剂 C.逆反应的活化能大于 198kJ/mol D.增大 SO2 的浓度可显著提高反应速率
(3)某研究小组研究 T1℃、T2℃时,氮硫的氧化物的转化:NO2(g)+SO2(g)
NO (g) +SO3(g) 中 lgP(NO2)和 lgP(SO3)关系如图 28-2 所示,实验初始时体 系中的 P(NO2)和 P(SO2)相等、P(NO)和 P(SO3)相等。
①根据题意可知:T1 T2 (填“>”“<”或者“=”),理由是
。
②由平衡状态 a 到 b,改变的条件是 。
(4)工业上可用 NaClO 碱性溶液或“亚硫酸盐法”吸收 SO2。
为了提高吸收效率,常用 Ni2O3 作为催化剂。催化过程如图 28-3 所示。
①过程 2 的离子方程式 。
②Ca(C1O)2 也可用于脱硫,且脱硫效果比 NaC1O 更好,原因是
(二)选考题:共 15 分。请考生从 2 题任选一题作答。如果多做,则按所做的 第一题计分。
35.【化学一选修 3:物质结构与性质】(15 分)
5G 时代的到来对人类社会的影响是巨大的, GaN 是制造 5G 芯片的材料,氮化 镓和氮化铝 LED 可发出紫外光。回答下列问题:
(1)基态 Ga 原子的核外电子排布式为 。
(2)据元素周期律,元素的电负性 Se (填“大于”或“小于”,下同)As。
n+
(3)科学家合成了一种阳离子为“N5
’,其结构是对称的,5 个 N 排成“V”形,
每个 N 原子都达到 8 电子稳定结构,且含有 2 个氮氮三键;此后又合成了一种
n+
宙有“N5
”化学式为“N8”的离子晶体,其电子式为 ,其中的阴离子的空
间构型为 。
(4)组成相似的 CaF3 和 GaCl3 晶体,前者属于离子晶体,后者属于分子晶体。从
F-和 Cl-结构的不同分析其原因是 。
(5)原子晶体 GaAs 的晶胞参数 a=xpm,它的晶胞结构如下图所示。该晶胞内部存 在的共价键数为 ;紧邻的 As 原子之间的距离为 b,紧邻的 As、Ca 原子之 间的距离为 d,则 b:d= ,该晶胞的密度为 g ▪cm-3。(阿伏加德罗常数 用 NA 表示)
36.【化学—选修 5:有机化学基础】(15 分)
美托洛尔(H)属于一线降压药,是当前治疗高血压、冠心病、心绞痛、慢性心 力衰竭等心血管疾病的常用药物之一。它的一种合成路线如下:
已知:CH3COCH2R ¾Z¾n( H¾g ) /¾H¾Cl ® CH3CH2CH2R。 (1)A 物质化学名称是 。
(2)反应 B→C 的化学方程式为 ;C→D 的反应类型为 。 (3)D 中所含官能团的名称是 。
(4)G 的分子式为 ; 已知碳原子上连有 4 个不同的原子或基团时,该碳 原子称为手性碳原子,则 H(美托洛尔)中含有 个手性碳原子。 (5)芳香族化合物 X 与 C 互为同分异构体。写出同时满足下列条件的 X 的一种结 构简式 。
①发生银镜反应; ②不与 FeCl3 发生显色反应;
③含"C-Cl”键; ④核磁共振氢谱有 4 个峰,峰面积比为 2:2:2:1。
(6)4-苄基苯酚( )是一种药物中间体,请设计以苯甲醇 和 苯 酚 为 原 料 制 备 4 基 苯 酚 的 合 成 路 线: (无机试剂任选)。
参考答案
7.【答案】C
【解析】A. FRP 属于纤维增强复合材料,不属于无机非金属材料,A 项错误; B. ETFE 保温内膜属于乙烯-四氟乙烯共聚物,不属于无机非金属材料,
B 项错误;
C. 长城城砖属于无机非金属材料,C 项正确; D.熔喷布的主要成分是聚丙烯,属于有机高分子 D 项错误;
8.【答案】A
【解析】 A.芳香族化合物定义就是含苯环的化合物是对的; B.与氧相连的碳是四面体结构不可能碳和氧都共平面 C.羟基直接和苯环相连的才能遇氯化铁显紫色
D 肽键水解生产有机物质是两种物质
9. 【答案】B
【解析】A.反应 3H2(g)+N2(g) 2NH3(g) ΔH=-92kJ·mol-1,当放出 9.2kJ
热量时,转移电子 0.6NA 说法是对的
B.常温下电解饱和食盐水,当溶液 pH 由 7 变为 13 时,电路中转 移的电子数为 0.1NA 少体积
C.1 mol HI 被氧化为 I2 时转移的电子数为 NA 说法是对的
3 3
D.将 0.1 mol CH COONa 溶于稀醋酸中使溶液呈中性,溶液中 CH COO-
数目等于 0.1NA 电荷守恒
10. 【答案】B
2+ -
【解析】A.在此实验条件下 H2O2 氧化 Fe
的速率比氧化 SCN
的速率快
B.通过实验Ⅱ推出实验Ⅰ中红色褪去的原因是由于 SCN-被氧化,
正确
C.通过实验Ⅰ和实验Ⅲ对比推出红色褪去与 O2 的氧化性有关, 错误,只与 H2O2 有关
D.综上所述,实验Ⅰ中红色褪去的原因与化学平衡移动原理有关
11. 【答案】 C
【解析】A.阳极已知正极书写正常 B.充电是电解池阳离子向阴极移动铝箔是阴极 C.铁的价态发生变化
D 电子从负极到正极
12.【答案】D
【解析】由图可知,a 点表示 SO2 气体通入 112mL 即 0.005mol 时 pH=7,溶液 呈中性。说明 SO2 气体与 H2S 溶液恰好完全反应,可知饱和 H2S 溶液中 溶质物质的量为 0.01mol,c(H2S)=0.1 mol/L。a 点之前为 H2S 过量,a 点之后为 SO2 过量,溶液均呈酸性,故 a 点水的电离程度最大,A 选项
2
正确;由图中起点可知 0.1 mol/L H S 溶液电离出的 c(H+)=10
-4.1 mol/L,
—7.2
可根据平衡常数表达式算出该温度下 H2S 的 Ka1≈10
,B 选项正确;
当 SO2 气体通入 336mL 时,相当于溶液中的 c(H2SO3)= 0.1 mol/L,因
为 H2SO3 酸性强于 H2S,故此时溶液中对应的 pH 应小于 4.1,故曲线 y
代表继续通入 SO2 气体后溶液 pH 的变化,C 选项正确;根据平衡常数
— +
表达式可知 c(HSO3
)/ c(H2SO3)= Ka1/ c(H ),a 点之后,随 SO2 气体的
2
通入,c(H+)增大,当通入的 SO 气体达饱和时,c(H+)就不变了,故 D
选项错误。
13. 【答案】D
【解析】短周期主族元素 W、X、Y、Z 的原子序数依次增大,X 的原子半径是 所有短周期主族元素中最大的,则 X 为 Na 元素;根据结构,W 最外层 有 6 个电子,原子序数小于 11,则 W 为 O 元素;Y 最外层有 4 个电子, 原子序数大于 11,则 Y 为 Si 元素;W 的核外电子数为 8,与 X、Z 的 最外层电子数之和相等,则 Z 最外层有 7 个电子,只能为 Cl 元素;Y 的原子序数是 Z 的最外层电子数的 2 倍,符合题意。根据上述分析,W 为 O 元素,X 为 Na 元素,Y 为 Si 元素,Z 为 Cl 元素。A.同一周期, 从左向右,非金属性增强,同一主族,从上到下,非金属性减弱,则
元素非金属性强弱的顺序为 Cl>Si,即 Z>Y,但 O 的非金属性大于硅
和氯故 A 错误;B.W 形成的氢化物的沸点高于氯化氢的,故 B 错误;
C.O 与 Na 能够形成氧化钠和过氧化钠 2 种,故 C 错误;D.根据
,阴离子带 2 个单位负电荷,其中 O 都满足 8 电 子稳定结构,故 D 正确
26.(14 分)
(1)ABC(2 分)
(2)恒压滴液漏斗(或者恒压分液漏斗)(1 分)双氧水(1 分)
(3)在油水分离器中加满乙酸丁酯(2 分)
(4)降低共沸物的沸点,防止温度过高,过氧乙酸分解(2 分)
(5)①当滴入最后一滴 KMnO4 溶液时,溶液由无色变成浅红色,且半分钟不 褪色。(2 分)
2+ + 3+
②CH3COOOH+2Fe
+2H =CH3COOH+2Fe
+H2O(2 分)
③ (2 分)
27.(14 分)
(1)增大固体的接触面积,加快反应的速率,反应更充分(1 分)
(2 分)
(2)≤8 (2 分)
(3)Ln2O3+2HCl=2LnOCl+H2O (2 分)
(4)①1:6 (2 分)
②550℃ 1.0h (1 分) 该条件下,氧化率高(接近 100﹪),产率高, 温度相对较低,节约能源,时间较短,经济效益好。(2 分)
(5)95.56﹪ (2 分)
28.(15 分)
(1)①-113 (1 分) (2 分)
②1.1×10-5(1 分) 8(1 分)
(2)CD (1 分)
(3)①< (1 分) 该反应为放热反应,温度越高 Kp 越小(2 分)
②将容器体积缩小为原来的 1/10 (2 分)
- -
(4)2NiO2+ClO
=Ni2O3+Cl +2O(2 分)
Ca2+与 SO 2-结合生成微溶物 CaSO 有利反应的进行(2 分)
4 4
35.【化学一选修 3:物质结构与性质】(15 分)
(1) [Ar]3d104s24p1(2 分) (2) 大于(1 分)
(3) 直线形(2 分)
(4)氯离子的电子层数比氟离子的电子层数要多,半径比氟离子的半径要大, 正负离子半径较大的是 CaF3 是离子键,形成离子晶体,正负离子半径小的 是 GaCl3 共价键形成分子晶体。(2 分)
(5)16 (2 分)
36.【化学—选修 5:有机化学基础】(15 分)
(1) 苯酚(2 分)
(2) 还原反应(1 分)
(3) (酚)羟基、氯原子(2 分)
(4) C12H16O3(2 分)1(1 分)