- 619.50 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1
初高中化学衔接——物质间的相互转化
初中化学所涉及的元素化合物知识主要包括以 O2、H2、C、S、P 等为代表的非金属单质,
以 Fe 为代表的金属单质,以 CO、CO2 等为代表的非金属氧化物,以 Fe2O3 、CuO 等为代表的
金属氧化物,以及酸、碱、盐等。这些物质之间的相互关系可以通过物质间相互转化关系图
(即八圈图)。
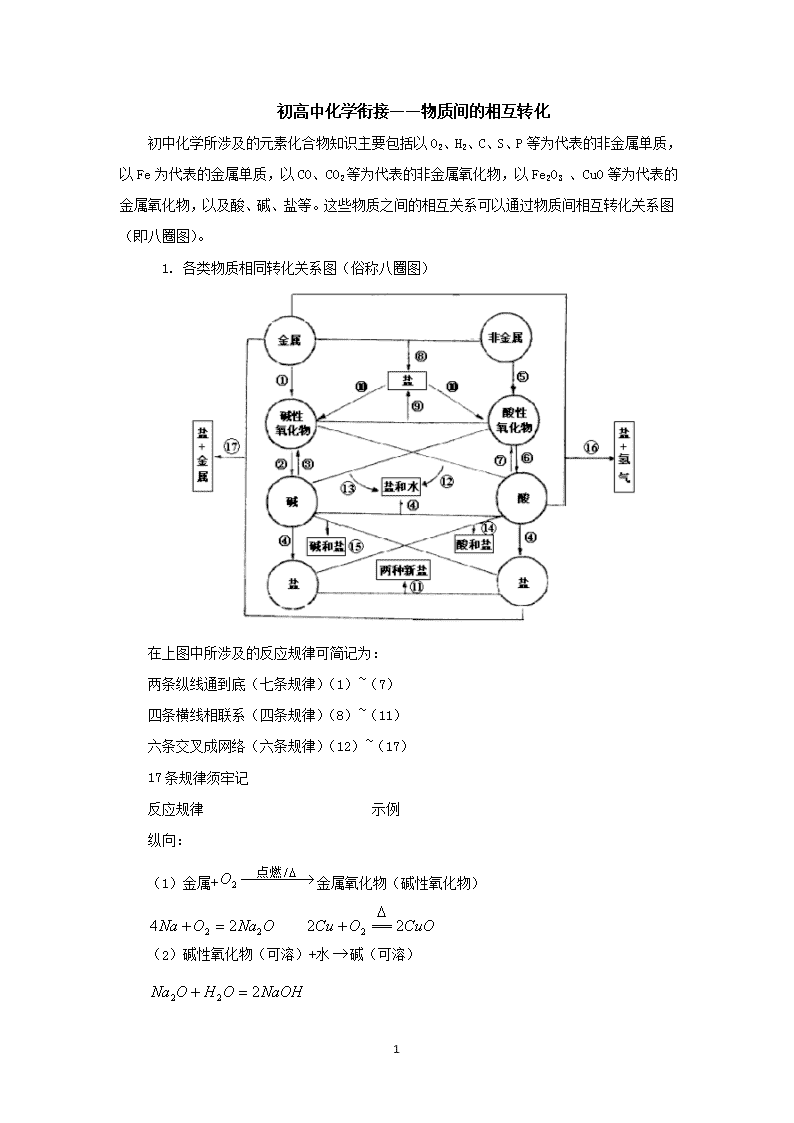
1. 各类物质相同转化关系图(俗称八圈图)
在上图中所涉及的反应规律可简记为:
两条纵线通到底(七条规律)(1)~(7)
四条横线相联系(四条规律)(8)~(11)
六条交叉成网络(六条规律)(12)~(17)
17 条规律须牢记
反应规律 示例
纵向:
(1)金属+ /
2
点燃O 金属氧化物(碱性氧化物)
ONaONa 22 24 CuOOCu 22 2
(2)碱性氧化物(可溶)+水 碱(可溶)
NaOHOHONa 222
2
(3)碱(难溶) 高温/ 碱氧(难溶) + 水
2)(OHCu OHCuO 2
(4)酸+碱 盐+水
OHPONaPOHNaOH 24343 33
OHCuSOSOHOHCu 24422 2)(
(5)非金属+ 点燃
2O 非金属氧化物(酸性氧化物)
22 COOC
点燃
522 254 OPOP
点燃
(6)酸性氧化物(易溶)+水 酸(易溶)
3222 COHOHCO 43252 23 POHOHOP
(7)酸(易挥发 / 难溶) 酸氧+水(易挥发 / 难溶)
2232 COOHCOH 2232 SiOOHSiOH
从纵向来看,金属 碱性氧化物 碱 盐,其中金属元素相同。
非金属 酸性氧化物 酸(含氧酸) 盐,其中非金属元素相同。
横向:
(8)金属+非金属 (无氧酸)盐
NaClClNa 22 2
点燃
(9)碱氧+酸氧 (含氧酸)盐
32 CaSiOSiOCaO
高温
(10)含氧酸盐 碱氧+酸氧
23 COCaOCaCO
高温
(11)盐+盐 两种新盐
AgClNaNOAgNONaCl 33
交叉:
(12)酸+碱氧 盐+水
OHCuSOCuOSOH 2442
3
(13)碱+酸氧 盐+水
OHCONaCONaOH 23222
(14)酸+盐 新酸+新盐
32423242 COHSONaCONaSOH
2232 COOHCOH
(15)碱+盐 新碱+新盐
2424 )(2 OHCuSONaCuSONaOH
(16)金属+酸 盐+ 2H
2442 )( HZnSOSOHZn 稀
(17)金属+盐 新盐+新金属
44 ZnSOCuCuSOZn
以上十七条规律的应用:
(1)可知某物质的性质。
(2)可知某物质的制法。如:(4)、(8)、(9)、(11)~(17)为盐的十种制法。
(3)已知各类物质间的相互关系。
说明:
<1> 以上各规律为各物质间相互转化的一般规律,具体到某些物质有些规律要具体分
析,未必均适用。
例如:制取 2ZnCl 的方法与制取 4CuSO 的方法各有几种?(思考)
答:制取 2ZnCl :
① 222 HZnClHClZn
② OHZnClHClZnO 222
③ OHZnClHClOHZn 222 22)(
④ 2223 2 COOHZnClHClZnCO
⑤ 22 ZnClClZn
点燃
4
⑥ 4224 BaSOZnClBaClZnSO
⑦ CuZnClCuClZn 22
因 2ZnCl 为无氧酸盐,故规律(9)、(13)不适用。
因 2)(OHZn 为难溶碱,故规律(15)不适用。
∴ 只有如上 7 种制法。
制取 4CuSO :
① OHCuSOSOHCuO 2442
② OHCuSOSOHOHCu 24422 2)(
③ 224423 COOHCuSOSOHCuCO
因 Cu 为 H 后金属, 2)(OHCu 为难溶碱、CuO 不能直接与 SO3 反应生成 CuSO4,Ag2SO4
为微溶物,不符合与 CuCl2 发生复分解反应的条件,也不能与 Cu 发生置换反应等原因,∴
CuSO4 只有上述三种制取方法(初中范围内,方法③也不常见)
<2> 此外,在物质的制取中还有一些常见的规律,如:
对于盐+酸 新盐+新酸,有如下规律:
① 强酸 弱酸
如: 2223 2 COOHCaClHClCaCO
② 稳定的(不易分解的)酸 不稳定的(另分解的)酸。
如: 2223 2 COOHCaClHClCaCO
③ 高沸点(不易挥发的)酸 低沸点(易挥发的)酸。
如:
HClSONaNaClSOH 2)(2)( 4242 固浓
④ 可溶性酸 难溶性酸。
如: 3232 22 SiOHNaClHClSiONa
<3> 从反应规律与反应类型的关系来看。
属于化合反应的有:规律(1)、(2)、(5)、(6)、(8)、(9)。
属于分解反应的有:规律(3)、(7)、(10)。
属于置换反应的有:规律(16)、(17)。
属于复分解反应的有:规律(4)、(11)、(12)、(14)、(15)。
5
规律(13)不属于任何一种基本反应类型。
初中阶段不属于任何一种基本反应类型的反应包括:
OHCOOCH 2224 22
点燃
OHCOOOHHC 22252 323
点燃
2COCuCuOCO
酸氧+碱 盐+水
2. 金属活动顺序表及其使用范围:
(1)金属活动顺序: 很活泼
NaCaK
较活泼
FeZnAlMg )(HPbSn
钝化 不活泼
AuPtAgHgCu
(2)在金属活动性顺序里,位于氢以前的较活泼金属,能与盐酸或稀硫酸发生置换反
应,置换出酸中的氢,氢后的金属则不能。较活泼的金属能将不活泼金属从它的盐溶液里置
换出来。
(3)很活泼的金属与某些盐溶液反应时,先与水反应生成碱,然后碱再与盐溶液发生
复分解反应,无金属生成。
2、 酸、碱、盐的溶解性规律
(1)酸:无机化合物中,除硅酸( 32 SiOH )不溶于水,大多数常见的酸易溶于水。
(2)碱:一水合氨( OHNH 23 )、 2)(OHBaKOHNaOH 、、 易溶; 2)(OHCa 微
溶;其余碱不溶于水。
(3)盐:铵盐、钾盐、钠盐、硝酸盐易溶;盐酸盐中 22ClHgAgCl、 (氯化亚汞)不
溶,其余溶;硫酸盐中 44 PbSOBaSO 、 不溶, 4CaSO 、 42SOAg 微溶,其余都溶;碳酸盐
中,
NaKNH 、、4 溶,
2Mg 微溶,其余不溶;磷酸盐、硫化物中除
NaKNH 、、4
溶外,其余不溶。
(4)酸中 342 HNOSOHHCl 、、 为强酸, 43 POH 为中强酸, 、、 3232 COHSiOH
COOHCHSH 32 、 为弱酸。
(5)可溶性碱除 OHNH 23 (弱碱)外均为强碱,不溶性碱为弱碱。了解酸、碱、盐
的溶解性的应用之一是判断某些复分解反应能否发生。
4. 复分解反应的发生条件
(1)复分解反应需在溶液里才能发生,在固态时无自由移动的离子时不发生反应。
6
还要看生成物是否满足下列条件之一:
① 产生沉淀 ② 放出气体 ③ 生成难电离的水
(2)复分解反应常发生在下列几条反应规律中:
① 酸+碱 盐+水(有强酸或强碱,至少一种物质可溶,若碱不溶于水但能溶于酸)
② 酸+碱性氧化物 盐+水(碱氧可不溶于水,但要溶于酸,酸为强酸)
③ 酸+盐 新酸+新盐(盐可不溶于水,但要溶于酸,酸为强酸)
④ 碱+盐 新碱+新盐(反应物的碱和盐均要溶于水)
⑤ 盐+盐 两种新盐(反应物均要溶于水)
【典型例题】
第一类:物质推断题
解决这一类的题目,要从现象入手,然后根据无机物之间的关系和无机物的性质,找到
突破口,解决问题。
[例题 1] 有三种金属 M、N、R,其氧化物中只有 N 的氧化物溶于水,且水溶液 pH 值大
于 7,已知 R 能从 3AgNO 溶液中置换出 Ag ,R 不溶于盐酸,M 能在 2O 中剧烈燃烧,火星
四射,生成黑色固体物质。则 M、N、R 在金属活动顺序表中的正确位置是( )
A. M、N、H、R B. R、M、H、N
C. R、H、M、N D. N、M、H、R
解析:本题考查根据实际反应推导金属活动性顺序,关键是先确定一个标准,其他的
与它相比较。排在前面的金属能把排在后面的金属从它的盐溶液里置换出来,而不管它是在
氢前还是在氢后,但要注意金属与盐反应时,盐应为可溶性盐。根据题意溶于水且水溶液
pH>7 的碱性氧化物只有 ONaOK 22 、 和 BaOCaO、 ,这些金属的活动性都很强。又据题干信
息可知, AgRH ,M 是铁,故 M、N、R 的金属活动性顺序应为 N、M、H、R。
答案:D
[例题 2] 有 A、B、C、D、E、F 六种物质的稀溶液,已知它们分别是 K2CO3、BaCl2、Ca(NO3)2、
NaCl、H2SO4、AgNO3 中的某一种溶液。下图为常温时上述溶液两两混合的部分实验现象,其
中“↓”表示生成沉淀,“↑”表示生成气体,“-”表示无明显现象或生成微溶物。请回
答下列问题:在下图中的空格内用“↓”“↑”“-”表示出对应反应的实验现象,问:F
是 。
7
解答:解决这道题目,可以先把 K2CO3、BaCl2、Ca(NO3)2、NaCl、H2SO4、AgNO3 相互之间
反映的现象各自列出来,例如:K2CO3 与 BaCl2 反应产生沉淀,与 NaCl 反应无现象,与 H2SO4
反应产生气体,与 AgNO3 反映也产生气体。将其他物质互相反映的现象全部列出来,对照上
面的表格,将 A、B、C、D、E、F 分别是什么列出来,解决本题目。
(2)硝酸钙[或 Ca(NO3)2]
[例题 3] 现有 Cu、CuO、CuSO4、C、CO、CO2 六种物质,它们的反应关系如下图所示(图
中每个字母分别代表上述六种物质中的一种)。
(1)请利用初中所学知识推断图中 Y、Z、W、N 分别对应物质的化学式:
Y 、Z 、W 、N ;
(2)写出 M →N 的化学方程式 ;
(3)写出 X →W 的化学方程式 。
解析:这是一道表格型的推理题,其实解决方法雷同,Cu、CuO、CuSO4、C、CO、CO2 这
六中物质两两反应的现象列出来,再根据表格,知道,X 能得到的物质有三种,W 能由四中
物质分别得到,所以 Z 是二氧化碳,由此推导出去。
答案:(1)CO CO2 Cu CuSO4
(2)CuO + H2SO4 = CuSO4 + H2O
(3)2CuO + C 2Cu + CO2↑
第二类:实验题
[例题 4] 镁是一种用途很广的金属材料,目前世界上 60%的镁从海水中提取。主要步
骤如下:
8
(1)为了使 MgCl2 转化为 Mg(OH)2,试剂①可以选用 ,要使 MgCl2
完全转化为沉淀,加入试剂①的量应 。
( 2 ) 加 入 试 剂 ① 后 , 能 够 分 离 得 到 Mg ( OH ) 2 沉 淀 的 方 法
是 。
(3)试剂②可以选用 。
(4)无水 MgCl2 在熔融状态下,通电后会产生 Mg 和 Cl2,写出该反应的化学方程
式
。
解析:根据所给的实验流程,由前向后,因为海水中含有氯化镁,而氯化镁要与碱反应
产生沉淀氢氧化镁,所以试剂①可以选用氢氧化钠。第二小题,要分离出沉淀,当然要用到
过滤的方法,而氢氧化钠要得到氯化镁,需要与盐酸反应。
答:(1) NaOH 过量 (2) 过滤
(3) 稀盐酸
(4)
[例题 5] 有 A、B、C、D 四瓶失去标签的白色粉末(均为纯净物),已知它们可能是硫
酸铜、碳酸钙、氯化钾、硫酸钾中的一种。某学生的鉴别实验过程记录如下:
步骤 1:取 A、B、C、D 四种白色粉末各一药匙,分别放入四支洁净的试管中,各加蒸
馏水 2 mL,振荡后静置。四支试管底部均有固体存在,只有盛放 A 的试管中液体呈蓝色,
其他均呈无色。
步骤 2:继续向盛放 B、C、D 的试管中加入等量的稀硫酸,只有 D 的试管中有气泡产生,
其他均无明显变化。
步骤 3:将步骤 2 盛放 B 和 C 的试管中固体滤出后,向滤液中分别滴加氯化钡溶液。
请根据该学生的实验过程,回答下列问题:
(1)步骤 1 中“四支试管底部均有固体存在”,与该学生预测的“只有一支试管中有
固体存在,其他试管中均为澄清溶液”的现象不同,其原因可能是 。
( 2 ) 步 骤 3 中 , 可 能 观 察 到 的 实 验 现 象
是 。
(3)根据该学生的实验,请选择下列①或②中的一个问题回答:
9
① 四 种 白 色 粉 末 均 已 一 一 鉴 别 出 来 , 分 别
是
(写代号及其对应物质的化学式)。
② 四 种 白 色 粉 末 只 能 部 分 被 鉴 别 出 来 , 分 别
是 (写代号及其对应物质的
化学式);对尚未鉴别出来的物质,请设计实验进行确定,并填写下表。
实验操作 实验现象及结论
解法 1:
(1)取用固体过多(或加水量较少,或固体未能完全溶解)
(2)B(或 C)的试管中出现大量白色沉淀,C(或 B)的试管中出现少量白色沉淀
(3)① A 是 CuSO4 B(或 C)是 K2SO4 C(或 B)是 KCl D 是 CaCO3
解法 2:
(1)取用固体过多(或加水量较少,或固体未能完全溶解)
(2)两支试管中均出现白色沉淀
(3)② A 是 CuSO4 D 是 CaCO3
实验操作 实验现象及结论
1. 取少量 B、C 的粉末分别放入两支
洁净的试管中,分别加入足量水,充分振
荡后观察
2. 向两支试管中分别滴加氯化钡溶
液
两支试管中均为无色澄清溶液
出现白色沉淀的原物质是 K2SO4;
仍是澄清溶液的原物质是 KCl
第四类:实验探究题
10
[例题 6] 铁暴露在空气中会生锈。不知你注意了没有,将苹果切开不久,果肉上就会
产生一层咖啡色的物质,也好象是生了“锈”一样。某化学活动小组对此进行了探究。
【提出问题】切开的苹果“生锈”与什么因素有关?
【猜想与假设】
猜想①:可能与空气没有关系,只是果肉内的物质自身相互反应而“生锈”。
猜想②:可能是果肉中的物质与空气中的氧气作用而“生锈”;
猜想③:可能是果肉中的物质与空气中的氮气作用而“生锈”;
猜想④:可能是果肉中的物质与空气中的二氧化碳作用而“生锈”;
猜想⑤:可能是果肉中的物质与空气中的氧气作用而“生锈”,并且苹果“生锈”的速
度还可能与温度有关。
【收集证据】
(一)查阅有关资料:已知苹果“生锈”是果肉里的物质(酚和酶)与空气中的一种物
质发生反应,生成咖啡色的物质。
(二)实验探究:针对上面的猜想①至猜想⑤,化学活动小组依次设计了实验方案,进
行了实验验证,并依次观察到下列实验现象。请你将他们设计的可行的实验探究方案,填写
在下表中。
【 得 出 结
论】
。
猜
想
可行的实验方案
观察到的实验
现象
猜
想①
将一小块果肉浸入盛有蒸馏水的烧杯中,观察
现象。
果肉表面不变
色。
猜
想②
果肉表面变
色。
猜
想③
果肉表面不变
色。
猜
想④
果肉表面不变
色。
猜
想⑤
温度高的先变
色。
11
【反思与评价】 (1)在②—⑤四种猜想中,你认为猜想 (填
代 号 ) 最 不 合 理 , 理 由
是
。
(2)在验证猜想①时,同学们发现,如果水不与空气隔绝,果肉放在水中时间长了也
会 变 色 , 其 可 能 的 原 因
是
。
【应用】根据上述结论,要防止果汁变质,果品加工厂加工和保存果汁时可采取的措施
是
。
答案:
猜想 可行的实验方案
猜想②
将一小块切开的苹果放入盛有氧气的集气瓶中,观察现
象。
猜想③ 将切开的苹果放入盛有氮气的集气瓶中,观察现象。
猜想④
将切开的苹果放入盛有二氧化碳的集气瓶中,观察现
象。
猜想⑤
各取一小块苹果分别放入两支集满氧气的试管中,将其
中一支试管放入热水中,观察两试管中苹果的变色速度。
【得出结论】 是果肉中的成分与氧气作用的结果,“生锈”的速度与温度有关,温度
越高,果肉变色速度越快。
【反思与评价】
(1)③ 氮气化学性质很稳定,通常不与其它物质反应。
(2)水中溶解了氧气
【应用】将水果在隔绝空气的条件下加工,采用真空包装并低温保存。
第五类:综合题
[例题 7] 某工厂中含有少量氧化铜和锌粉的废渣与废盐酸混合形成污水,若向污水中
加入足量的铁粉,则处理后的水中一定含有的金属离子是( )
A. 2Zn 、 2Cu B. 2Zn 、 2Fe
12
C. 2Cu 、 2Fe D. 只有 2Fe
解析:理解题中各物质加入的先后顺序及量之间的关系是解此题的关键。含有少量氧
化铜和锌粉的废渣在未加入铁粉前先与废盐酸作用:
OHCuClHClCuO 222 , 222 HZnClHClZn ,未反应完的废盐酸
与加入的铁粉继续反应直至废盐酸消耗尽: 222 HFeClHClFe ,另外,铁粉还要
与溶液中的 2CuCl 反应: CuFeClCuClFe 22 ,至 2CuCl 反应完,铁粉仍有剩余(∵
铁粉足量),此时溶液中含有的金属阳离子只有 2Fe 与未参与反应的 2Zn 。
答案:B
[例题 8] 在某无色透明溶液中,下列离子能大量共存的是( )
A. Na 、
2Mg 、 Cl 、 OH
B. H 、 2Cu 、
3NO 、
2
4SO
C.
2Mg 、
2
4SO 、 K 、
3NO
D. Na 、
4MnO 、 2Ca 、
2
3CO
解析:此题为离子共存问题的考察。溶液中大量共存的离子必须相互不起反应,另外还
要注意题目中的隐含条件“无色”,说明虽能共存但有色的离子也不符合要求。
A 中
2Mg 与 OH ,反应生成 2)(OHMg ;B 中 2Cu 为蓝色;D 中
4MnO 为紫色,
且 2Ca 与
2
3CO 反应生成 3CaCO 。
答案:C
[例题 9] 某溶液中可能有下列阴离子:
2
4SO 、
2
3SO 、
2
3CO 、 Cl 。
(1)当溶液中存在大量 H 时,溶液中不能大量存在的离子是 。
(2)当溶液中存在大量 2Ba 时,溶液中不能大量存在的离子是 。
(3)当溶液中存在大量 和 离子时,上述阴离子都不能存在。
解析:此题仍为离子共存问题,解题关键是要了解哪些离子不能共存,即符合复分解反
应的发生条件,生成沉淀,气体或水, 334 BaCOBaSOAgClBaSO 、、、 为沉淀, H 与
13
2
3SO 、
2
3CO 反应生成 32 SOH 、 32COH ,二者均易分解为水和气体( 2SO 和 2CO )。
答案:
(1)
2
3SO 、
2
3CO
(2)
2
4SO 、
2
3SO 、
2
3CO
(3)
Ag 、 2Ba
[例题 10] 某化工厂有甲、乙两个车间,它们排放的工业废水澄清透明,共有 K 、
Ag 、
2Cu 、 Cl 、 OH 、
3NO 六种离子。
(1)甲车间的废水中含有三种离子,明显呈碱性,则甲车间废水中不可能存在的阳离
子是 。
(2)乙车间的废水中含有另外三种离子,其中阴离子是 。
(3)如果加足量的铁粉,把甲车间和乙车间的废水按适当的比例混合,可以使废水中
的某些离子转化为两种沉淀,经过滤后的废水主要含(填化学式) 可用来浇灌农
田。
解析:此题联系生产实际考查综合能力。根据两个车间排放的工业废水澄清透明,可知
废水中无沉淀物存在,每个车间废水中的离子间不会发生反应(能共存),由甲车间的废水
含三种离子且呈碱性,说明甲车间的废水中含有 OH ,则无
Ag 、 2Cu ,甲车间废水中
不可能存在的阳离子是
Ag 、 2Cu ,则只能是 OH 、 K 、 Cl ,乙车间废水中含有另
外三种离子只能是
Ag 、 2Cu 、
3NO ;如向乙的废水中加足量铁粉,可回收其中的 Ag 、
Cu ;如果将甲车间和乙车间的废水按适当的比例混合,可使废水中的
Ag 、 2Cu 、 Cl 、
OH 转化为 AgCl 、 2)(OHCu 两种沉淀,经过滤后废水中主要含有 3KNO (属复合肥),
其溶液可浇灌农田。
答案:(1)
Ag 、 2Cu ;(2)
3NO ;(3) 3KNO
[例题 11] 铜器久置于空气中会和空气中的水蒸气、CO2、O2 作用产生“绿锈”,该“绿
锈”俗称“铜绿”,又称“孔雀石”[化学式为 Cu2(OH)2CO3],“铜绿”能跟酸反应生成铜盐
和 CO2、H2O。某同学利用下述系列反应实现了“铜→铜绿→……→铜”的转化。
铜――→① 铜绿 ――→② A――→③ Cu(OH)2――→④ B――→⑤
H2
Cu
14
(1)从三种不同分类标准回答,“铜绿”属于哪类物质?
(2)请写出铜绿与盐酸反应的化学方程式。
(3)写出 B 的化学式________。
(4)上述转化过程中属于化合反应的是________,属于复分解反应的是________。
答案: (1)盐 铜盐 碳酸盐
(2)Cu2(OH)2CO3+4HCl===2CuCl2+3H2O+CO2↑
(3)CuO
(4)① ②③
第三类:计算题
[例题 12] 运用侯氏制碱法制得的纯碱中可能含有少量氯化钠。现取某种仅含有氯化钠
一种杂质的纯碱样品 23.4 g 全部溶解在 350.0 g 水中,再加入氯化钡溶液 166.0 g,恰好
完全反应生成碳酸钡沉淀。过滤出沉淀并干燥后,称得沉淀的质量为 39.4 g。
(1)求 23.4 g 纯碱样品中碳酸钠的质量。
(2)求滤液中氯化钠的质量分数。
解析:这是一道典型的溶液质量分数的题目,不仅要用到质量守恒,而且要用到利用化
学方程式计算,要注意两个细节,一是沉淀是纯量,可以直接用入化学方程式,二是原物质
中也含有氯化钠。
答案:(1)21.2 克 (2) 5.12%
[例题 13] 宇宙飞船内,宇航员呼出的气体要通过盛有氢氧化锂的过滤网,以除去所含
的二氧化碳,如下式所示:2LiOH(固)+CO2(气)=Li2CO3(固)+H2O(液)
(1)试计算 1g 氢氧化锂所能吸收的二氧化碳的质量。
(2)若用氢氧化钾来代替氢氧化锂,试计算 1g 氢氧化钾所能吸收的二氧化碳的质量。
(3)利用(1)和(2)所得的结果,试解释为什么宇宙飞船选用氢氧化锂来吸收二氧
化碳较用氢氧化钾为佳:______________________________________________________。
(4)若每位宇航员每天所呼出的二氧化碳平均是 502L,我国今年发射的“神州 6 号”
上有 2 名宇航员进行一项为期 5 天的太空任务,试计算在宇宙飞船上应携带氢氧化锂的质量
(在宇宙飞船内的温度和气压下,二氧化碳气体的密度为 1.833g/L)。
解析:这是一道综合性的计算题,第一小题,只要直接用化学方程式计算就可以,第二
小题,也雷同,第三小题要在前面两题的基础上比较,最后要注意,计算中要用纯量。
答案:0.92g 0.39g
因为相同质量的氢氧化锂比氢氧化钾吸收的二氧化碳多 10038.2g
15
[例题 14] 小明在课外活动中用一定量的金属 R (反应后生成正二价)和稀盐酸反应制
取氢气,所做 5 次实验结果记录如下表(假设每次实验所产生的氢气全部被收集,体积在同
温同压下测定)。
实 验
编号
R 的质量
(g)
稀盐酸体积
(ml)
生成 H2 的体积
(L)
1 1.5 50.0 1.47
2 2.0 50.0 1.96
3 2.2 50.0 2.16
4 2.5 50.0 2.16
5 3.0 50.0 2.16
根据上述实验结果进行分析、计算,并回答下列问题:
① 上 述 实 验 中 , 金 属 一 定 过 量 ( 太 多 ) 的 组 的 编 号
是 , 稀 盐 酸 一 定 过 量 的 组 的 编 号
是 。
②在当时实验条件下,H2 的密度为 0.085 克/升,求反应所用金属 R 的相对原子质
量 。
解析:这是一题表格型的计算题,首先要对起表格中的数据进行分析,稀盐酸的用量相
同,1、2 两处,产生的氢气在增多,那么 R 就过量,而 4、5 产生的氢气不变,也就是盐酸
已经反应完全。要求出 R 的原子量,就需要利用 R 完全反应的时候的氢气的质量,所以可以
用 1、2 两次的数据。R+2HCl=RCl2+H2 来计算。注意,氢气要转化成质量。
答案:①4 和 5,1 和 2
②1.96L 氢气的质量为:1.96×0.085=0.167g
R+2HCl=RCl2+H2↑
x 2
2 0.167
解得 x=23.95
【基础练习】
1. 下列变化中,既有化学变化又有物理变化的是( )
A. 固体碘受热变成蒸气
B. 蜡烛被点燃时发生的变化
C. 玻璃被金刚石刻划
D. 干冰蒸发使水蒸气凝结成水滴
16
2. 下列物质中,属于纯净物的是( )
A. 不锈钢 B. 自来水
C. 葡萄酒 D. 复合肥料硝酸钾
3. 有如下粒子结构示意图: 、 、 。有关的下列说法中正
确的是( )
A. 它们是同一元素的粒子
B. 它们都具有相对稳定的结构
C. 它们都是原子
D. 它们都是离子
4. 下列同组内的两种物质中,(金属离子除外)所含相同元素的化合价完全相同的是
( )
A. 4KMnO 和 42MnOK
B. 3KClO 和 KCl
C. 3SO 和 4NaHSO
D. 424 )( SONH 和 3HNO
5. 含有硫的煤,在火炉中如果不充分燃烧,则排放出的能污染空气的气体为( )
A. 2SO 和 CO B. 2SO
C. 2SO 和 2CO D. CO
6. 下列同组内的两种物质中,一种可用来配制农药波尔多液,另一种可用来在工业上
制取生石灰的是( )
A. 胆矾、纯碱 B. 胆矾、烧碱
C. 熟石灰、石灰石 D. 熟石灰、纯碱
7. 下列物质露置于空气中一段时间后,因发生化学变化而使质量减小的是( )
A. 酒精 B. 固体烧碱
C. 浓盐酸 D. 碳酸钠晶体
8. Ct 时, g100 硝酸钾溶液中溶有 20g 硝酸钾,则该温度下硝酸钾的溶解度为( )
17
A. 20g B. 25g C. 20% D. 无法确定
9. 下列同组内的两种物质间,能发生化学反应的是( )
A. Cu 和稀硫酸
B. Cu 和 23 )(NOHg 溶液
C. 4ZnSO 溶液和稀硝酸
D. 32OFe 和 4CuSO 溶液
10. 下列溶液中的物质,能和稀硫酸发生中和反应,并能生成白色沉淀的是( )
A. 2BaCl 溶液 B. NaOH 溶液
C. 2)(OHBa 溶液 D. 32CONa 溶液
11. 实现下列物质的转化时,只有加入酸才能通过一步反应实现的是( )
A. 34232 )(SOFeOFe
B. 2ZnClZn
C. NaClNaOH
D. 42 BaSOBaCl
12. 实验室用于检验盐酸和其他电离时能产生 Cl 的化合物的试剂是( )
A. 稀盐酸和石灰水 B. 氢氧化铁
C. 氯化钡溶液和稀硝酸 D. 硝酸银溶液和稀硝酸
13. 除去 2)(OHMg 粉末中混有的少量 4MgSO ,应采用下列方法的是( )
A. 加水、搅拌、过滤、常温下慢慢挥发
B. 加适量稀硫酸、搅拌、加热蒸发
C. 加适量氯化钡溶液、搅拌、过滤、慢慢挥发
D. 加适量石灰水,搅拌、慢慢挥发
14. 下列四种物质中,磷元素的质量分数最大的是( )
A. 424 )( HPONH B. 42 POKH
C. 242 )( POHCa D. 4CaHPO
18
15. 等质量的 OHHCCHCO 524、、 分别充分燃烧,产生温室气体 2CO 最多的是
( )
A. CO B. 4CH
C. OHHC 52 D. 无法确定
16. 下列物质中,在一定条件下能与二氧化碳发生化合反应的是( )
A. 澄清石灰水中的溶质 B. 蒸馏水
C. 氢氧化钠 D. 单质碳
17. 下列做法中,可能会导致人中毒的是( )
A. 生理盐水用于给病人输液
B. 工业酒精用于配制饮料酒
C. 工业用盐亚硝酸钠用于腌渍咸菜
D. 胃酸过多的病人内服含 3)(OHAl 的药物
18. 下列说法中,正确的是( )
A. HCl 和 42SOH 属于同类化合物,但它们在水溶液里电离时生成有不同的阴离子,
所以它们的化学性质有所不同
B. 无氧酸的正盐一定不含氢、氧元素
C. 能电离产生氢离子的化合物一定属于酸
D. 将 2)(OHCu 加入到滴有石蕊试液的蒸馏水中,溶液显蓝色
19. 检验未知溶液中是否含有
2
4SO 离子,合理的方法是( )
A. 只加入 23 )(NOBa 溶液
B. 加入 2BaCl 和 HCl 的混合溶液
C. 先加 2BaCl 溶液,再加稀硝酸
D. 先加稀盐酸,再加 2BaCl 溶液
20. 下列说法中,错误的是( )
A. 生成盐和水的反应一定是中和反应
B. 2CO 能使氢氧化钡溶液变浑蚀
19
C. 能发生的复分解反应可能既没有沉淀析出,也没有气体放出
D. 滴有石蕊的稀硫酸与氯化钡溶液恰好完全反应后,溶液仍显红色
21. 有甲、乙、丙、丁四种物质,它们分别是 42322)( SONaCONaHClOHBa 、、、 中
的一种,若将丁的溶液滴入到乙的溶液中,则产生白色沉淀,向这种白色沉淀中滴加甲的溶
液,沉淀溶解并放出一种无色气体。据此做出的下列推断中,正确的是( )
A. 甲一定是 HCl
B. 乙一定是 32CONa
C. 丙一定是 42SONa
D. 丁一定是 2)(OHBa
22. 质量相等的两块金属 A 和 B 分别跟足量的稀盐酸反应,A 置换产生的氢气比 B 多,
若 A、B 两金属在其氯化物中均为+2 价,则下列推断中,正确的是( )
A. 相对原子质量 A>B
B. 相对原子质量 A<B
C. 金属活动性一定是 A>B
D. 金属活动性一定是 A<B
23. 下列每组内的三种物质中最后一种物质均为过量(充分反应后,该物质有剩余),
分别向各组物质中加适量水,使它们充分反应后,静置、过滤,所得滤渣中有两种物质的是
( )
A. 2232 )()( OHBaNOCuCuCl 、、
B. 4CuSOFeAl 、、
C. 2234 )()( OHBaNOMgMgSO 、、
D. 4FeSOCuAl 、、
24. 下列各组物质的溶液,不另加其他试剂,只需利用组内物质,就能加以鉴别的是
( )
A. 33 KNOKClAgNOHCl 、、、
B. 3232 NaNOCaClCONaHCl 、、、
20
C. HClSONaBaClSOH 、、、 42242
D. 3424 KNOSOKNaOHCuSO 、、、
25. 如图:在托盘天平两边各放一烧杯,调节至平衡,向两边烧杯中分别注入质量相等,
溶质质量分数相同的稀盐酸,再向两烧杯中分别投入质量相等的锌粒和镁条,待反应停止后,
天平指针的可能指向是:① 刻度盘上偏向放锌粒的一方;② 刻度盘的中央;③ 刻度盘上
偏向放镁条的一方,其中正确的是( )
A. ①、②、③ B. 仅③
C. ①、② D. ②、③
26. 请用氢、碳、氧、钠、硫、铜等元素中的有关元素组成符合下列要求的物质(写出
化学式)
(1)难溶于水的黑色碱性氧化物 ;
(2)无氧酸 ;
(3)能使生石灰转化为熟石灰的物质 ;
(4)含氧酸的正盐(它的浓溶液与浓盐酸反应会产生二氧化碳) ;
(5)加热条件下能被分解的碱式盐 ;
(6)蓝色的结晶水合物 ;
(7)能与人体血液里的血红蛋白结合而使人中毒的物质 。
27. 将 溶液分别滴入稀硫酸和硝酸银溶液中,都能产生不溶于稀硝酸的白色
沉淀,这两种沉淀物分别是 和 。
28. 有 Ct 的硝酸钾溶液 500g,将 200g 该溶液在 Ct 下蒸发掉 50g 水后,溶液恰好饱
和,若另取两份质量均为 100g 的原溶液,分别进行下列操作(溶液温度不变):
(1)对其中一份溶液,需蒸发掉 g 水,溶液恰好饱和;
(2)对另一份溶液,加入 12.5g 硝酸钾,完全溶解后,溶液也恰好饱和,则在 Ct 时,
硝酸钾的溶解度为 ;原 500g 溶液中硝酸钾的质量分数 ,含有钾元素的
21
质量为 g(精确至 0.1g)
29. 通电分解水时,为了增强水的导电性,可加入少量氢氧化钠,现用 31.8g 0.50%的
氢氧化钠溶液进行通电分解水的实验,经过一定时间后,得到 0.20g 氢气,同时会得到
g 氧气,此时剩余的氢氧化钠溶液中溶质的质量分数变成了 %。
30. (3 分)在化学反应 DCBA 323 中,如果将 A、B、C 三种物质各 15g 混合
均匀后加热,生成 30gD,此时,再向残留物中加入 10gA,加热后继续反应,则反应物中只
有 C 有剩余,则第一次反应停止时剩余 C 的质量是 g;A、B、C 三种物质恰好完全
化合时的质量比为 ;若 C 的相对分子质量为 m,D 的相对分子质量为 n,则 m 与 n
的比= 。
31. 将 4CuSO 溶液和 NaOH 溶液混合,充分反应后过滤,所得的滤液中一定含有的离
子是 ;在 22 ZnClFeCl 、 和 2CuCl 的混合溶液中加入一定量的镁粉,充分反应后过
滤,分别得到滤液和固体,若向滤出的固体中滴加稀硫酸,有气泡产生,则滤出的固体中一
定含有 。
32. 按要求各写出一个有硫酸镁生成的化学方程式:
(1)同时有非金属单质生成的置换反应
(2)中和反应
(3)碱性氧化物与酸反应
(4)盐与酸反应,同时有气体生成
33. 写出下列化学反应的化学方程式
(1)实验室中制氧气的反应。(要求生成物中含三种纯净物)
(2)有红色金属单质生成的置换反应。(该反应不在溶液中进行)
(3)用气体氧化物还原氧化铁。
(4)用过量的石灰乳(熟石灰的悬浊液)吸收二氧化硫
34. 有一包白色固体,可能由 32422333 )( CONaSONaNOBaCaCONaNO 、、、、 中
22
的若干种组成,将其进行检验,其过程和结果为:
据此推断:原白色固体中肯定不含有 。
原白色固体 足量蒸馏水
过 滤
白色沉淀
NaNO3溶液
+稀盐酸
无色气体
无色溶液
35. 下图所示装置中: 可用于实验室制取和收集 2O ; 可用于实验
室制取和收集 2H ; 可用于实验室制取和收集 2CO 。(填写装置的代号)
使用上述实验室制 2O 的发生装置(不得作任何改动),可以进行下列实验中的
(填写实验的代号)。供选择的实验:a. 氢气还原氧化铜;b. 一氧化碳还原氧化铜;c. 加
热碱式碳酸铜。
① ② ③ ④
36. 实验室利用下列实验装置来测定铜的氧化物 OCu x 的组成。
(1)若气体 a 为纯净的氢气,在点燃 A 装置中酒精灯以前,要将氢气通过整个装置
一段时间,其目的是 。
(2)若气体 a 为纯净的氢气,当铜的氧化物 OCu x 完全被还原为Cu 时,称得Cu 的质
量为 6.4g,同时称得 B 装置的质量增加了 0.9 克,则这种铜的氧化物中铜元素和氧元素的
原子个数之比的原始计算式为 ,该铜的氧化物的化学式为 。
23
(3)若气体 a 为混有少量 )(2 gOH 的氢气,而又未经干燥处理直接通至装置 A 中,当
铜的氧化物 OCu x 完全被还原为 Cu 时,仍然利用称量 Cu 的质量和 B 装置增加的质量的方
法来完成这个实验,将使测定结果中铜元素与氧元素质量之比的值(选填“偏大”、“偏小”
或“不受影响”) 。
(4)若气体 a 为混有少量 )(2 gOH 的氢气,不增加任何其他实验装置也不改动上述装
置的连接顺序,仍用其来测定 OCu x 的组成,必须测得哪些数据才能得到 x 的值?
37. 向氯化镁和氯化钠的混合物 25g 中加入密度
3/2.1 cmg ,质量分数为 20%的氢氧化
钠溶液 50mL,充分反应后过滤,向滤液中加入 73g 5%的盐酸,恰好完全反应,求原混合物
中氯化镁的质量分数。
38. 一定质量的乙醇 OHHC 52 在空气中燃烧不充分时生成 OHCOCO 22、、 的总质
量为 26.8g,其中 OH 2 的质量为 10.8g。求:
(1)参加反应的乙醇的质量;
(2)生成的 2CO 的质量。
【基础练习答案】
1. B 2. D 3. B 4. C 5. A 6. C 7. D 8. D 9. B 10. C 11. A 12.
D 13. A
14. C 15. B
16. BD 17. BC 18. A 19. D 20. A 21. AC 22. B 23. CD 24. B
25. C
26. (1)CuO (2) SH 2
(3) OH 2 (4) 32CONa
(5) 322 )( COOHCu (6) OHCuSO 24 5
(7)CO
27. 2BaCl (或氯化钡) 4BaSO (或硫酸钡) AgCl (或氯化银)
24
28. 25;50g;25%;48.3
29. 1.6;53
30. 9; 2:3:5 ; 10:3
31. Na 和
2
4SO ; Fe 和Cu
32. (1) )(42 稀SOHMg 24 HMgSO
(2) 422)( SOHOHMg OHMgSO 24 2
(3) 42SOHMgO OHMgSO 24
(4) 423 SOHMgCO 224 COOHMgSO
(或 423 SOHMgSO 224 SOOHMgSO )
33. (1)
224242 OMnOMnOKKMnO
(2) OHCuCuOH 22
(或 222 COCuCuOC 高温
)
(3) 232 323 COFeOFeCO 高温
(4) OHCaSOSOOHCa 2322)(
34. 42SONa
35. ②;①、④;③;c
36. (1)排除整个装置内的空气,防止加热时发生爆炸。
(2) 16
18
169.0
:64
4.6 gg
OCu2 (3)偏小 (4)分别将未反应时的 OCu x 的质
量及 OCu x 完全被还原后得到的Cu 的质量称出。
37. 解: NaOH 溶液中 NaOH 的质量 gcmgmL 12%20/2.150 3
设与 HCl 反应的 NaOH 的质量为 x
OHNaClHClNaOH 2
25
40 36.5
x %573 g
%)573(:5.36:40 gx gx 4
与 2MgCl 反应的 NaOH 的质量为 ggg 8412
设混合物中 2MgCl 的质量为 y
22 )(22 OHMgNaClNaOHMgCl
95 80
y 8g
gy 8:80:95 gy 5.9
原混合物中 2MgCl 的质量分数为
%38%10025
5.9
g
g
答:原混合物中氯化镁的质量分数为 %38 。
38. 解:10.8g OH 2 中氢元素的质量=
gg 2.118
28.10
参加反应的 OHHC 52 的质量
gg 2.946
62.1
生成的 2COCO、 的质量之和 ggg 168.108.26
设生成 2CO 的质量为 x,则生成 CO 的质量 xg 16
9.2g OHHC 52 中所含碳元素的质量与生成的 2COCO、 中所含碳元素的质量之和相
等,所以有: 28
12)16(44
12
46
2122.9 xgxg
解得:
gx 2.13
答:(1)参加反应的乙醇的质量为 9.2g;
(2)生成的 2CO 的质量为 13.2g。
26
【模拟试题】(答题时间:70 分钟)
一、选择题
1、下列自然现象的过程中,存在化学变化的是( )
A、冰雪融化 B、形成酸雨
C、发生沙尘暴天气 D、二氧化碳等物质使地球表面气温升高
2、据报道,中小学生喜欢使用的涂改液中,含有许多挥发性的有害物质,长期使用易
引起慢性中毒而头晕、头痛,二氯甲烷就是其中的一种,下列关于二氯甲烷(CH2Cl2)组成
的叙述中,正确的是( )
A、二氯甲烷是由碳、氢气和氯气组成的
B、二氯甲烷是由碳、氢和氯三种元素组成的
C、二氯甲烷是由一个碳原子、一个氢分子和一个氯分子组成的
D、二氯甲烷是由一个碳原子、两个氢原子和两个氯原子组成的
3、下列化学方程式正确的是( )
A、2Fe+6HCl=2FeCl3+3H2↑ B、Fe+ZnCl2=FeCl2+Zn
C、Fe+CuCl2=FeCl2+Cu D、Fe+2AgCl=FeCl2+2Ag
4、下列试剂能区别稀硫酸和盐酸的是( )
A、锌粉 B、紫色石蕊试液 C、氯化钡溶液 D、氢氧化钾溶液
5、下列各组物质,能在溶液中大量共存的是( )
A 、 NaCl KNO3 NaOH B 、
KOH Ba2CO3 HCl
C 、 FeCl3 NaOH KCl D 、
AgNO3 BaCl2 HNO3
6、天然气的主要成分 CH4 也是一种会产生温室效应的气体,对于相同分子数的 CH4 和 CO2,
CH4 产生的温室效应更明显。下面是有关天然气几种叙述:①天然气与煤、柴油相比是较清
洁的能源之一;②等质量的 CH4 和 CO2 产生的温室效应也是前者明显;③燃烧天然气也是酸
雨的成因之一。其中正确的是( )
A、①②③ B、只有① C、①② D、
只有③
7、锂电池是新型的高能电池,以质量轻、电容量大,颇受手机、手提电脑等用户的青
睐。某种锂电池的总反应可表示为 Li+MnO2=LiMnO2。以下说法正确的是( )
①该反应中 Mn 的化合价发生了变化;②该反应属于化合反应;
③LiMnO2 为新型的氧化物;④LiMnO2 为锂、锰、氧的合金。
27
A、①② B、①③ C、②③ D、
③④
8、二氧化氯(ClO2)是一种高效灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有着
广泛应用,二氧化氯是一种( )
A、酸 B、碱 C、盐 D、氧
化物
9、下列四个化学反应中,符合此漫画情景的是( )
A、Fe+CuSO4=FeSO4+Cu B、CuO+CO Cu+CO2
C、H2+CuO Cu+H2O D、Fe+H2SO4=FeSO4+H2
10、以下不属于高分子材料的是( )
A、塑料 B、合成纤维 C、合成橡胶 D、合
金
11、欲除去氢氧化钠溶液中的少量杂质氢氧化钙,可以选用的试剂是( )
A、KOH B、碳酸钠溶液 C、氯化钡溶液 D、稀盐酸
12、某工地发生食物中毒现象,经分析是误食了工业用亚硝酸钠(NaNO2),NaNO2 中氮
的化合价是( )
A 、 + 5 B 、 - 3 C 、 +
3 D、+2
13、甲为无色溶液,取少量甲溶液做如下实验
根据以上实验,则可推断甲为( )
A、NaOH B、AgNO C、BaCl D、
Ba(OH)
28
14、发展绿色食品,避免“白色污染”,增强环境保护意识是保护环境、提高人类生存
质量的重要措施,通常所说的“白色污染”是指( )
A、冶炼厂的白色烟尘 B、石灰窑的白色粉尘
C、聚乙烯等白色塑料垃圾 D、白色建筑废物
15、下列各组金属的活动性符号由弱到强顺序排列的是( )
A、K Ca Hg Al Fe B、Cu Fe Al Ca
C、Cu Pt Au Ag Hg D、Cu Hg Ag Au
16、下列各组物质中,主要成分的名称和化学式所表示的是同一组物质的是( )
A、纯碱 苛性钠 NaOH B、烧碱 碳酸
钠 Na2CO3
C、胆矾 硫酸铜晶体 CuSO4·5H2O D、熟石灰 石灰石 Ca(OH)2
17、在一种无色溶液中加入氯化钡溶液,产生白色沉淀,再加入稀硝酸沉淀不溶解,则
这种溶液中( )
A、一定含有SO B、一定含有 SO 、
Ag
C、可能含有 SO ,也可能含有 Ag D、一定含有 Ag
18、下列物质中,能把铁从铁的氧化物中还原出来的是( )
A、氧气 B、一氧化碳 C、二氧化碳 D、
氮气
19、小玲学习了用 pH 试纸测定溶液 pH 的方法后,收集了家里的几种物质进行测定,结
果如下:
物质 厕所清洁剂 牙膏 肥皂 厨房清洁剂
pH 值 2 8 10 12
上述物质中,最容易直接腐蚀铁制下水管道的是( )
A、厕所清洁剂 B、牙膏 C、肥皂 D、厨房清洁剂
20、下列实验操作不正确的是( )
29
21、下列试剂放置在空气中,溶液的质量减轻的是(不考虑溶剂蒸发)( )
A、浓硫酸 B、氢氧化钠溶液 C、澄清石灰水 D、饱和 CuSO4 溶液
22、浓硫酸稀释操作正确的是( )
A、将水缓缓倒入盛有浓硫酸的烧杯中,边倒边搅拌。
B、将浓硫酸缓缓倒入盛有水的量筒中,边倒边搅拌。
C、将浓硫酸和水同时倒入一试剂瓶中,充分振荡。
D、将浓硫酸缓缓倒入盛有水的烧杯中,边倒边搅拌。
23、垃圾是放错位置的资源,应该分类回收,生活中废弃的铁锅、铝制易拉罐、铜导线
等可以归为一类加以回收,它们属于( )
A、氧化物 B、化合物 C、非金属 D、金属
或合金
24、不能用金属跟酸直接反应得到的物质是( )
A、氯化铁 B、氯化亚铁 C、氯化锌 D、氯化镁
25、你注意过吗,现榨的苹果汁在空气中会由浅绿色变为棕黄色,其原因可能是
( )
A、苹果汁含有 OH B、苹果汁中的 Fe 变为 Fe
C、苹果汁中含有 Cu D、苹果汁在空气中腐烂了
二、填空题:
26、在通常情况下,氯气是一种黄绿色、具有刺激性气味的有毒气体,密度比空气大,
能溶于水,能与许多金属反应。试回答:①黄绿色,具有刺激性气味。这属于氯气的
30
(物理或化学)性质。②实验室收集氯气时,可用 法。③写出加
热时 Fe 与 Cl2 的反应方程式 。
27、NO 和 NO2 具有下列不同的性质:
通常情况下,NO 是无色气体,难溶于水;NO2 是棕色气体,易溶于水 (3NO2+H2O=2HNO3
+NO)。如右图将一支充满 NO2 棕色气体的试管倒立在烧杯中(水中已预先加入数滴石蕊试
液)。试分别描述实验现象:(至少写二点)
①__________________________________________;
②__________________________________________。
28、蛋白质是组成细胞的基础物质,没有蛋白质就没有生命。动物的肌肉、毛、皮等都
是由蛋白质构成的,蛋清、鲜牛奶中含有丰富的蛋白质。一些可溶性的重金属盐(如 Cu2+、
Pb2+、Ag+、Ba2+等可溶性盐)会使蛋白质丧失生理功能,因此可溶性重金属盐为有毒物质。
请回答问题:
①下列物质中,不会引起人体中毒的是____________(填序号的字母)
A、BaCO3 B、Pb(NO3)2 C、CuSO4 D、BaSO4
②医疗上用 X 射线检查胃病时,病人服用的“钡餐”中不能含有 BaCO3,其原因是 BaCO3
与 人 的 胃 液 中 含 有 的 少 量 盐 酸 反 应 产 生 有 毒 的 BaCl2, 该 反 应 的 化 学 方 程 式 为
_____________________________。
③AgNO3 遇到蛋白质即生成黑色的蛋白质。有一天学生小王实验时不慎在手指上沾染了
少量 AgNO3 溶液,第二天发现手指上沾染过 AgNO3 溶液的皮肤颜色会_______ __ 。
29、市场上销售的牙膏,从膏体上分为透明和不透明两类,主要原因是加入的摩擦剂不
同造成的。牙膏摩擦剂通常有以下三种:氢氧化铝(白色固体)、碳酸钙(白色)、二氧化
硅(无色透明)。
① 每 种 牙 膏 中 通 常 只 有 一 种 摩 擦 剂 , 白 色 牙 膏 中 含 有 的 摩 擦 剂 可 能
是
。②若牙膏中不含其它碳酸盐,检验牙膏中的摩擦剂为碳
酸 钙 的 实 验 方 法 是 , 现 象
是 。
30、汽车作为曾经推动人类文明向前跃进的现代社会的产物,在给人类的生活带来便捷
舒适的同时,对自然生态环境的恶化也有难以推卸的责任。据6 月15日某市政府发布的“2000
31
年某市环境状况公报”称:某市大气污染主要来源于工业污染和汽车尾气,99%的一氧化碳
和一氧化氮的排放来源于汽车尾气。某市近几年来汽车持有量的增长达 20%,虽然空气质
量居全国第四,但环保仍面临如汽车污染等问题的考验。另据报道:将氢气应用于汽车发动
机的技术已在我国研制成功;酒精作为燃料的汽车已在北京市、河南省使用;某市也有一部
分汽车改用液化气作为燃料。问:
①汽车尾气中的大气污染物有(写化学式)__________,________
②我市将部分汽车排气管加装三效转换器,促使一氧化碳在排气管内与空气作用转化为
二氧化碳,其反应方程式为________ __。
③若实验用氢气汽车运行 1km,需要 2858KJ 能量。现这辆汽车在某市环岛路上走一圈
(约 30 km),需要__________g 氢气。(已知每克氢气燃烧放出 142.9kJ 能量。)
31、有一包固体粉末,可能由 BaCl2、FeCl3、KCl、Na2CO3、Na2SO4 等物质中的一种或几
种组成。为证实其组成,做了以下实验:
①将这包固体粉末加入水中,充分搅拌,过滤,得白色沉淀,上层清液为无色。
②向(1)所得的白色沉淀加入盐酸,沉淀全部溶解,并放出无色气体,该气体能使澄
清石灰水变浑浊。
根 据 上 述 实 验 判 断 , 该 粉 末 中 一 定 含 有 , 一 定 不 含
有 。
32、硫酸铜是精炼铜的主要原料,某工厂用硫化铜(CuS)制硫酸铜拟选择两个方案:
方案一:CuS 在硫杆菌(催化剂)的作用下跟空气中的 O2 发生反应生成 CuSO4;方案二:
2CuS+3O2 2CuO+2SO2、CuO+H2SO4=CuSO4+H2O
① 请 写 出 方 案 一 反 应 的 化 学 方 程
式
②从环境保护的角度考虑,上述方案应选 (填“一”或“二”)
更 合 理 , 理 由
是
。
三、探究题
33、两同学在南京著名的风景区——珍珠泉发现一个有趣的现象,当珍珠泉水受到声音
的震动而喷涌时,泉水中混有大量的气泡。仔细观察,珍珠泉产生的池塘,水很深,水面也
很平静,且在水中生长大量的水草。一个同学认为水中的气泡是二氧化碳,另一位同学认为
水中的气泡是甲烷。现已收集到一瓶这种气体,采用什么实验方法,证明瓶中的气体是二氧
化碳或是甲烷。(用文字叙述,如有化学反应写出反应的化学方程式)
32
。
34、“旺旺雪饼”袋内有一个小纸袋,上面写着“干燥剂,主要成分是生石灰”。
①生石灰(CaO)可作干燥剂的理由是(用化学方程式表示)
;
②我对它作了一系列探究,获得较多收益,其实验方案如下:
问题与猜想 实验步骤
实验
现象
实验结论
问题 1:小纸袋中
的物质能否继续作干燥
剂?
取足量小纸袋中固
体放入烧杯中,加入适
量水,触摸杯壁。
杯壁
不热
不能作干燥剂
(生石灰与水反应
要放热)
问题 2:我猜想变
质后的物质可能是
__ __
35、“XX 月饼”袋内有一个小纸袋,上面写着“脱氧剂”。它的作用是除氧,以达到
保鲜的目的。三位同学打开包装袋,看到“脱氧剂”为灰黑色粉状,还有少量的红色粉末。
提出问题:该“脱氧剂”中的灰黑色、红色粉末各是什么?
甲同学认为:灰黑色粉末为氧化铜、红色粉末为铜粉。
乙同学认为:灰黑色粉末为铁粉、红色粉末为氧化铁。
丙同学认为:灰黑色粉末为活性炭、红色粉末为氧化铁。
① 你 认 为 同 学 的 猜 想 较 合 理 , 理 由
是
②请你参照下图的形式,将你初步验证该同学猜想的实验过程用框线表示出来。
乙方案:
甲 方
案:
丙 方
案:
33
四、计算题
36、2005 年 5 月 22 日,中国登山测量队成功登上珠穆朗玛峰峰顶,圆满完成珠峰高度
最新测量工作。登山队员常用的能源是氢化钙(CaH2)固体,用它和水反应生成 H2 供燃烧之
需(CaH2+2H2O=Ca(OH)2+2H2↑),请回答下列问题:
①CaH2 中钙元素为+2 价,氢元素化合价为 ;
②现有 875 克氢化钙固体能源(含 CaH296%,杂质不参加反应)与足量水反应,可生成
多少克氢气?
37、将 10g 不纯的氯化镁样品(杂质不溶于水)放入 50g 水中充分搅拌,待样品中氯化
镁全部溶解后过滤(滤液损失不计)。将所得滤液与 63.3g 氢氧化钠溶液恰好完全反应,生
成 5.8g 白色沉淀,求:
①样品中氯化镁的质量分数;
②反应后所得溶液中溶质的质量分数。
【试题答案】
一、选择题:
1 2 3 4 5 6 7 8 9
1
0
B B C C A C A D A D
1
1
1
2
1
3
1
4
1
5
1
6
1
7
1
8
1
9
2
0
B C D C B C C B A A
2
1
2
2
2
3
2
4
2
5
C D D A B
二、填空题
26、①物理 ②向上排气 ③2Fe+3Cl2 2FeCl3
27、试管内形成一段液柱或试管内棕色气体变无色或试管内气体体积缩小或试管内液柱
呈红色
28、①D ②BaCO3+2HCl=BaCl2+H2O+CO2↑ ③变黑
29、①碳酸钙(CaCO3)或氢氧化铝(Al(OH)3) ②加盐酸(HCl),有气泡产生
30、①CO,NO ②2CO+O2 2CO2 ③600
34
31、BaCl2 和 Na2CO3,FeCl3 和 Na2SO4
32、①CuS+2O2 CuSO4
②一,方案二生成了对空气有污染的 SO2 或方案二中有二氧化硫的污染。
三、探究题
33、在集气瓶中滴一滴石灰水,看水滴是否变混浊,如变混浊说明是 CO2,如不变混浊
说明是 CH4,CO2+Ca(OH)2=CaCO3↓+H2O。或点燃,如能燃烧的说明是 CH4,不能燃烧是 CO2,
CH4+2O2 CO2+2H2O。
34、①CaO+H2O=Ca(OH)2
②氢氧化钙(Ca(OH)2)(或碳酸钙 CaCO3),取固体放入烧杯中,加入足量的盐酸,固
体溶解时,没有(或有)气体产生,是氢氧化钙(或是碳酸钙)。
35、①乙,铁在常温下能与空气中的氧气和水反应,生成铁锈,从而达到除氧的目的。
②
四、计算题
36、解:①-1 价
②CaH2+2H2O=Ca(OH)2+2H2↑
42 4
875×96% x
解得 x=80g
答:可生成 80 克氢气。
37、解:MgCl2+2NaOH=Mg(OH)2↓+2NaCl
95 58 117
x 5.8 y
解得 x=9.5 克 y=11.7 克
①氯化镁的质量分数为 9.5÷10×100%=95%
②反应后所得溶液中溶质的质量分数为
35
11.7÷(63.3+10+50-5.8-10+9.5)×100%=10%