- 433.00 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
影响化学平衡的因素
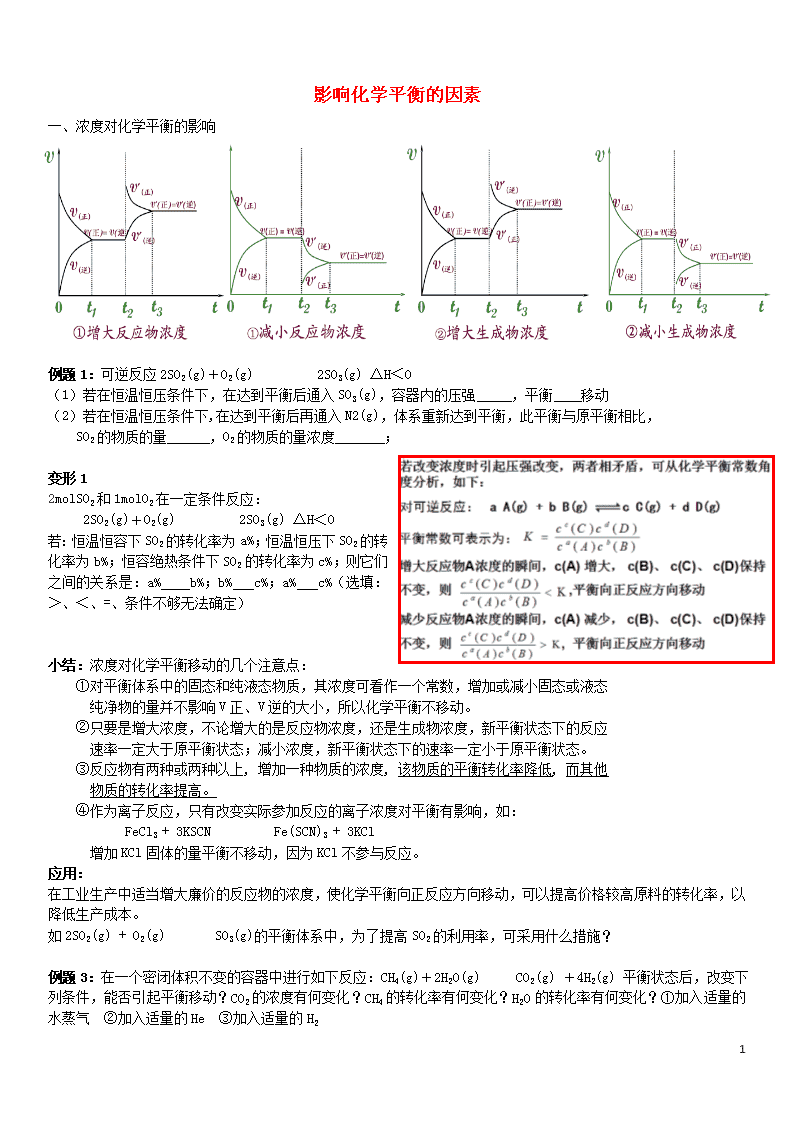
一、浓度对化学平衡的影响
例题1:可逆反应2SO2(g)+O2(g) 2SO3(g) △H<0
(1) 若在恒温恒压条件下,在达到平衡后通入SO3(g),容器内的压强 ,平衡 移动
(2) 若在恒温恒压条件下,在达到平衡后再通入N2(g),体系重新达到平衡,此平衡与原平衡相比,
SO2的物质的量 ,O2的物质的量浓度 ;
变形1
2molSO2和1molO2在一定条件反应:
2SO2(g)+O2(g) 2SO3(g) △H<0
若:恒温恒容下SO2的转化率为a%;恒温恒压下SO2的转化率为b%;恒容绝热条件下SO2的转化率为c%;则它们之间的关系是:a% b%;b% c%;a% c%(选填:>、<、=、条件不够无法确定)
小结:浓度对化学平衡移动的几个注意点:
①对平衡体系中的固态和纯液态物质,其浓度可看作一个常数,增加或减小固态或液态
纯净物的量并不影响V正、V逆的大小,所以化学平衡不移动。
②只要是增大浓度,不论增大的是反应物浓度,还是生成物浓度,新平衡状态下的反应
速率一定大于原平衡状态;减小浓度,新平衡状态下的速率一定小于原平衡状态。
③反应物有两种或两种以上, 增加一种物质的浓度, 该物质的平衡转化率降低, 而其他
物质的转化率提高。
④作为离子反应,只有改变实际参加反应的离子浓度对平衡有影响,如:
FeCl3 + 3KSCN Fe(SCN)3 + 3KCl
增加KCl固体的量平衡不移动,因为KCl不参与反应。
应用:
在工业生产中适当增大廉价的反应物的浓度,使化学平衡向正反应方向移动,可以提高价格较高原料的转化率,以降低生产成本。
如2SO2(g) + O2(g) SO3(g)的平衡体系中,为了提高SO2的利用率,可采用什么措施?
例题3:在一个密闭体积不变的容器中进行如下反应:CH4(g)+2H2O(g) CO2(g) +4H2(g) 平衡状态后,改变下列条件,能否引起平衡移动?CO2的浓度有何变化?CH4的转化率有何变化?H2O的转化率有何变化?①加入适量的水蒸气 ②加入适量的He ③加入适量的H2
5
①平衡正向移动,c(CO2)增大,CH4的转化率增大,H2O的转化率减小 ②平衡不移动,c(CO2)不变,CH4的转化率不变,H2O的转化率不变
③平衡逆向移动,c(CO2)减小,CH4的转化率减小,H2O的转化率减小
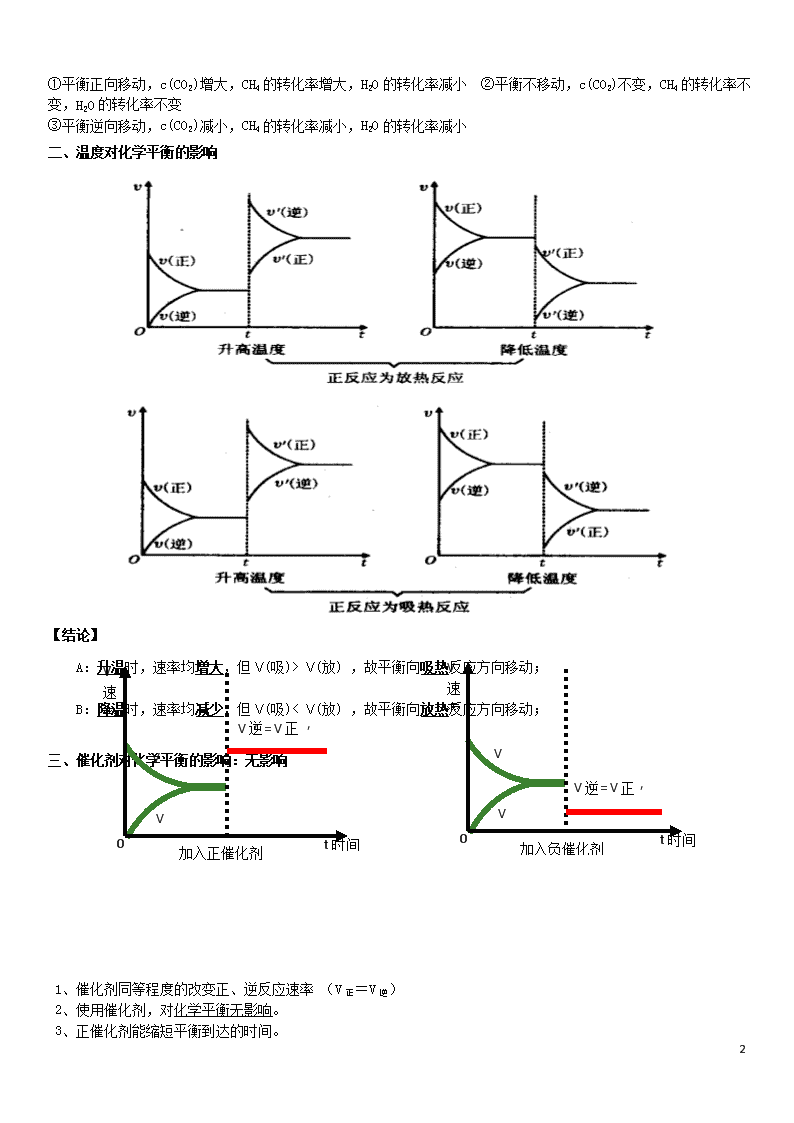
二、 温度对化学平衡的影响
【结论】
A:升温时,速率均增大,但Ѵ(吸)> Ѵ(放) ,故平衡向吸热反应方向移动;
B:降温时,速率均减少,但Ѵ(吸)< Ѵ(放) ,故平衡向放热反应方向移动;
三、催化剂对化学平衡的影响:无影响
t时间
加入负催化剂
V速率
V正
V逆
0
V逆= V正
′
′
t时间
加入正催化剂
V速率
V正
V逆
0
V逆= V正
′
′
1、催化剂同等程度的改变正、逆反应速率 (V正=V逆)
2、使用催化剂,对化学平衡无影响。
3、正催化剂能缩短平衡到达的时间。
5
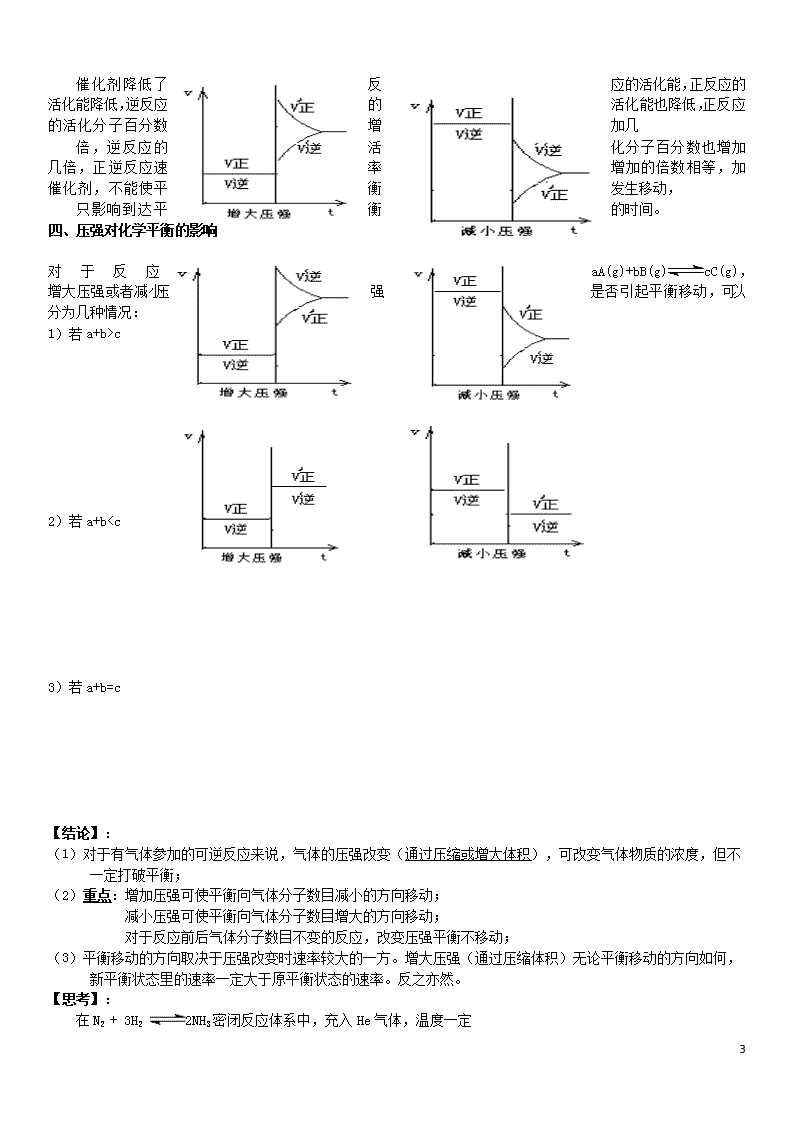
催化剂降低了反应的活化能,正反应的活化能降低,逆反应的活化能也降低,正反应的活化分子百分数增加几
倍,逆反应的活化分子百分数也增加几倍,正逆反应速率增加的倍数相等,加催化剂,不能使平衡发生移动,
只影响到达平衡的时间。
四、压强对化学平衡的影响
对于反应aA(g)+bB(g) cC(g),增大压强或者减小压强是否引起平衡移动,可以分为几种情况:
1)若a+b>c
2)若a+b p B、A 的转化率降低
C、平衡向正反应方向移动 D、C的体积分数增加
4、恒温下, 反应aX(g) bY(g) +cZ(g)达到平衡后, 把容器体积压缩到原来的一半且达到新平衡时, X的物质
的量浓度由0.1mol/L增大到0.19mol/L, 下列判断正确的( )
A. a>b+c B. a<b+c C. a=b+c D. a=b=c
五、勒夏特列原理
勒夏特列原理也叫化学平衡移动原理,其内容如下:
如果改变影响平衡的一个条件(如浓度、温度、或压强等),平衡就向能够减弱这种改变的方向移动。
注意:①是“减弱”这种改变,不是“消除”这种改变
②勒夏特列原理适用于任何动态平衡体系(如:溶解平衡、电离平衡、沉淀平衡、水解平衡等),未平衡状
态不能用此来分析
③平衡移动原理只能用来判断平衡移动方向,但不能用来判断建立平衡所需时间。
【练习】:下列能用勒夏特列原理解释的是:
①棕红色NO2加压后颜色先变深后变浅 ②FeCl3溶液加热后颜色加深
③Fe(SCN)3溶液中加入KSN后颜色变深 ④氯水宜保存在低温、避光条件下
⑤乙酸乙酯在碱性条件下水解比在酸性条件下水解更有利 ⑥SO2催化氧化成SO3的反应,往往加入过量的空气
⑦向AgCl悬浊液中加入KI溶液有黄色沉淀生成 ⑧500℃时比室温更有利于合成氨的反应
六、化学平衡移动原理应用——合成氨工业
已知N2与H2反应合成NH3是一个可逆反应,其热化学方程式为:
N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ·mol-1
合成氨的工艺流程如图所示。在工业生产中,可以通过以下途径来提高合成氨的
产率。请利用有关知识分析采取这些措施的原因。
1.向反应器中注入过量N2。
5
2.采用适当的催化剂。
3.在高压下进行反应。
4.在较高温度下进行反应。
工业基本要求:
a、反应快 b、原料利用率高 c、单位时间内产量高
1)从反应速率角度看:温度越高、压强越大,化学反应越快, 使用催化剂反应加快,单位时间内生成的产品越多;
2)从化学平衡的角度看:高压低温,平衡时生成物NH3的百含量高。
5