- 317.19 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
化学能转化为电能——电池
基础巩固
1.关于原电池的叙述正确的是( )
A.原电池工作时,电极上不一定都发生氧化或还原反应
B.某可充电电池充、放电时的总反应式为Li1-xNiO2+xLiLiNiO2,放电时此电池的负极材料是Li1-xNiO2
C.铅、银和盐酸构成的原电池工作时,铅板上有5.175 g铅溶解,正极上就有1 120 mL(标准状况)气体析出
D.在理论上可将反应CH4(g)+2O2(g)CO2(g)+2H2O(l) ΔH<0设计成原电池
答案D
解析A中原电池工作时电极上一定都发生氧化反应或还原反应;B中电池放电时,负极材料是Li;C中通过计算知正极上生成的气体在标准状况下的体积应为560 mL。
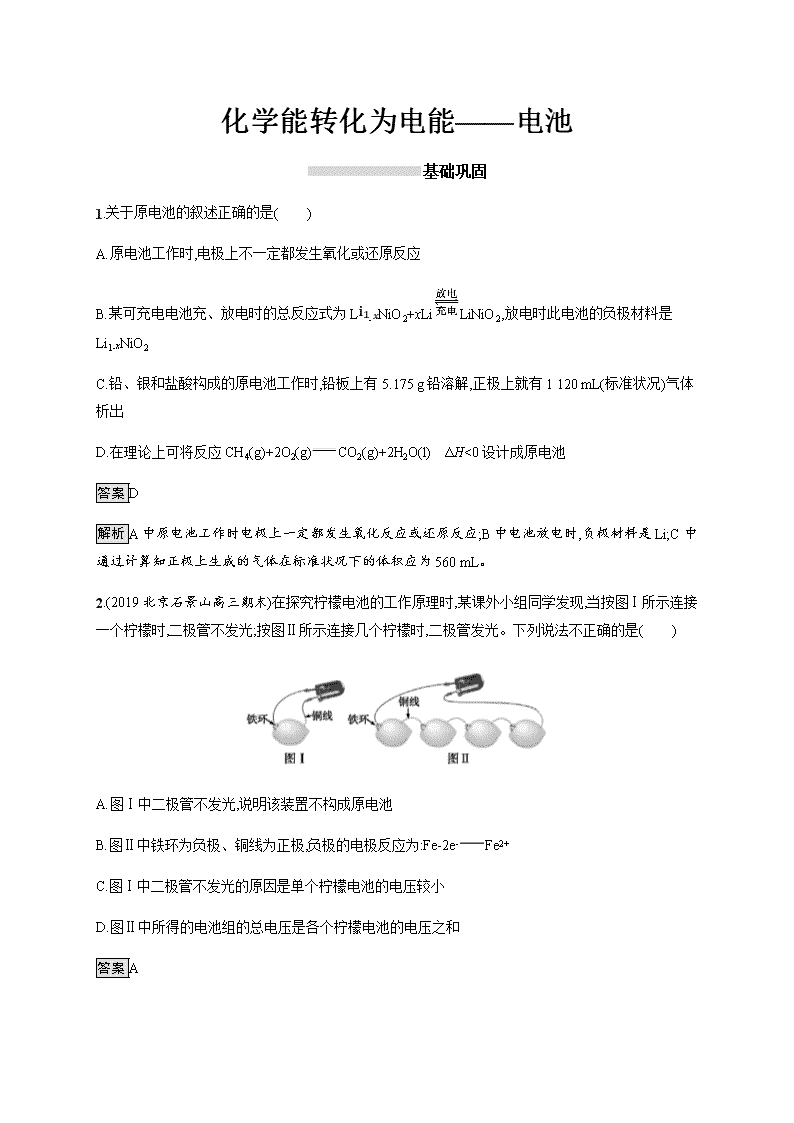
2.(2019北京石景山高三期末)在探究柠檬电池的工作原理时,某课外小组同学发现,当按图Ⅰ所示连接一个柠檬时,二极管不发光;按图Ⅱ所示连接几个柠檬时,二极管发光。下列说法不正确的是( )
A.图Ⅰ中二极管不发光,说明该装置不构成原电池
B.图Ⅱ中铁环为负极、铜线为正极,负极的电极反应为:Fe-2e-Fe2+
C.图Ⅰ中二极管不发光的原因是单个柠檬电池的电压较小
D.图Ⅱ中所得的电池组的总电压是各个柠檬电池的电压之和
答案A
解析图Ⅰ中铁环、铜线与柠檬酸构成原电池,二极管不发光是因为单个柠檬电池提供的电压较小;故A项错误;图Ⅱ中活泼金属铁作负极,不活泼金属铜作正极,负极的电极反应为Fe-2e-Fe2+,故B项正确;图Ⅰ中铁环、铜线和柠檬酸构成原电池,二极管不发光的原因是单个柠檬电池的电压较小,故C项正确;图Ⅱ中四个柠檬电池为串联关系,所得的电池组的总电压是各个柠檬电池的电压之和,故D项正确。
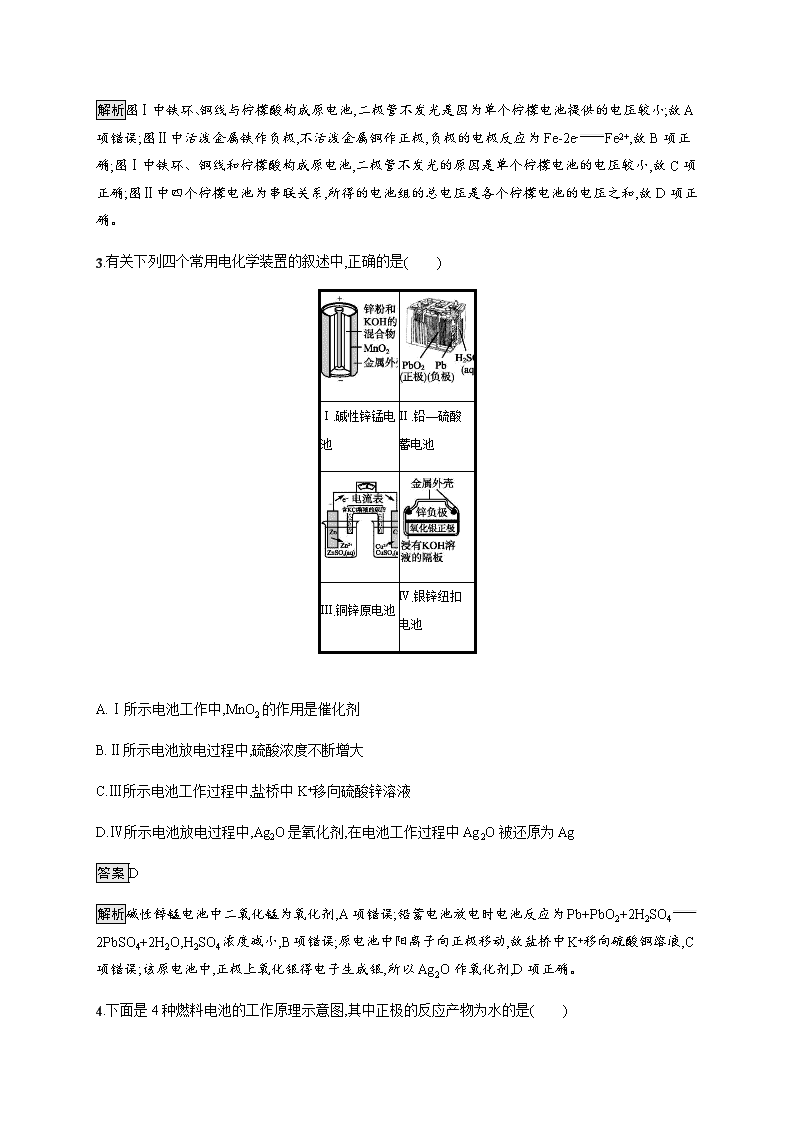
3.有关下列四个常用电化学装置的叙述中,正确的是( )
Ⅰ.碱性锌锰电池
Ⅱ.铅—硫酸蓄电池
Ⅲ.铜锌原电池
Ⅳ.银锌纽扣电池
A.Ⅰ所示电池工作中,MnO2的作用是催化剂
B.Ⅱ所示电池放电过程中,硫酸浓度不断增大
C.Ⅲ所示电池工作过程中,盐桥中K+移向硫酸锌溶液
D.Ⅳ所示电池放电过程中,Ag2O是氧化剂,在电池工作过程中Ag2O被还原为Ag
答案D
解析碱性锌锰电池中二氧化锰为氧化剂,A项错误;铅蓄电池放电时电池反应为Pb+PbO2+2H2SO42PbSO4+2H2O,H2SO4浓度减小,B项错误;原电池中阳离子向正极移动,故盐桥中K+移向硫酸铜溶液,C项错误;该原电池中,正极上氧化银得电子生成银,所以Ag2O作氧化剂,D项正确。
4.下面是4种燃料电池的工作原理示意图,其中正极的反应产物为水的是( )
答案C
解析A项,通空气的电极作正极,正极反应式为O2+4e-2O2-,不符合题意;B项,通入氧气的一极作正极,电解质溶液是碱性溶液,电极反应式为O2+2H2O+4e-4OH-,不符合题意;C项,通入空气的一极作正极,电解质传递H+,正极反应式为O2+4H++4e-2H2O,符合题意;D项,通入氧气的一极作正极,依据电池内部传递CO32-,正极反应式为O2+2CO2+4e-2CO32-,不符合题意。
5.(2019四川成都高三一诊)港珠澳大桥设计寿命120年,对桥体钢构件采用了多种防腐方法。下列分析错误的是( )
A.防腐原理主要是避免发生反应2Fe+O2+2H2O2Fe(OH)2
B.钢构件表面喷涂环氧树脂涂层,是为了隔绝空气、水等防止形成原电池
C.采用外加电流的阴极保护时需外接镁、锌等作辅助阳极
D.钢构件可采用不锈钢材料以减缓电化学腐蚀
答案C
解析铁为活泼的金属,在潮湿的空气中容易发生吸氧腐蚀,发生的主要反应有2Fe+O2+2H2O2Fe(OH)2、4Fe(OH)2+O2+2H2O4Fe(OH)3等,故A项正确;钢构件表面喷涂环氧树脂涂层,可以隔绝空气、水等防止形成原电池,防止铁发生电化学腐蚀,故B项正确;外接镁、锌等作辅助阳极属于牺牲阳极的阴极保护法,采用外加电流的阴极保护时需外接电源,故C项错误;不锈钢具有较强的抗腐蚀性,采用不锈钢材料做钢构件可以防止或减缓电化学腐蚀,故D项正确。
6.
(2019山东新泰第二中学高三月考)锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )
A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的c(SO42-)减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.阴、阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
答案C
解析由图像可知该原电池反应原理为Zn+Cu2+Zn2++Cu,故Zn电极为负极失电子发生氧化反应,Cu电极为正极得电子发生还原反应,故A项错误;该装置中为阳离子交换膜只允许阳离子和水分子通过,故两池中c(SO42-)不变,故B项错误;电解过程中溶液中Zn2+由甲池通过阳离子交换膜进入乙池,乙池中发生电极反应Cu2++2e-Cu,故乙池中为Cu2+~Zn2+,由于摩尔质量M(Zn2+)>M(Cu2+),故乙池溶液的总质量增加,C项正确;该装置中阳离子交换膜只允许阳离子和水分子通过,电解过程中溶液中Zn2+由甲池通过阳离子交换膜进入乙池保持溶液中电荷平衡,阴离子并不通过交换膜,故D项错误。
7.(2019江西师大附中高三期末)Ⅰ.甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景。
(1)工业生产甲醇的常用方法是CO(g)+2H2(g)CH3OH(g)
ΔH=-90.8 kJ·mol-1。已知:2H2(g)+O2(g)2H2O(l)
ΔH=-571.6 kJ·mol-1,H2(g)+12O2(g)H2O(g) ΔH=-241.8 kJ·mol-1。
①H2的燃烧热ΔH= kJ·mol-1。
②CH3OH(g)+O2(g)CO(g)+2H2O(g)的反应热ΔH= 。
(2)工业上利用甲醇制备氢气常用方法之一是甲醇蒸气重整法,该法中的一个主要反应为CH3OH(g)CO(g)+2H2(g),此反应能自发进行的原因是 。
Ⅱ.铅蓄电池是典型的可充电电池,它的正、负极隔板是惰性材料,电池总反应式为Pb+PbO2+4H++2SO42-2PbSO4+2H2O。请回答下列问题:
(3)放电时,正极的电极反应式是 ;当外电路通过1 mol电子时,理论上正极板的质量增加 g。
(4)在完全放电耗尽PbO2和Pb时,若按如图连接,电解一段时间后,则在A电极上生成 、B电极上生成 。
铅蓄电池示意图
答案Ⅰ.(1)①-285.8 ②-392.8 kJ·mol-1 (2)该反应是一个熵增的反应(ΔS>0)
Ⅱ.(3)PbO2+2e-+4H++2SO42-PbSO4+2H2O 48
(4)Pb PbO2
解析Ⅰ.(1)①根据燃烧热的定义,结合热化学方程式2H2(g)+O2(g)2H2O(l) ΔH=-571.6 kJ·mol-1可知,氢气的燃烧热ΔH=-285.8 kJ·mol-1。②反应1:CO(g)+2H2(g)CH3OH(g) ΔH=-90.8 kJ·mol-1,反应2:H2(g)+12O2(g)H2O(g) ΔH=-241.8 kJ·mol-1,根据盖斯定律反应2×2-反应1得到CH3OH(g)+O2(g)CO(g)+2H2O(g) ΔH=-392.8 kJ·mol-1。
(2)反应CH3OH(g)CO(g)+2H2(g)的ΔH>0,此反应能自发进行的原因是该反应是熵增加的反应。
Ⅱ.(3)电池总反应为Pb+PbO2+4H++2SO42-2PbSO4+2H2O,负极电极反应为Pb-2e-+SO42-PbSO4,正极电极反应为PbO2+2e-+4H++SO42-PbSO4+2H2O。当外电路通过1 mol电子时,依据电子守恒计算理论上负极板的质量增加0.5 mol×303 g·mol-1-0.5 mol×207 g·mol-1=48 g。
(4)在完全放电耗尽PbO2和Pb时,电极上析出的是PbSO4,若按题图连接B为阳极应是失去电子发生氧化反应,A为阴极应是得到电子发生还原反应,实质是电解反应,B电极上发生反应为PbSO4+2H2O-2e-PbO2+4H++SO42-,A电极发生的反应为PbSO4+2e-Pb+SO42-。
能力提升
8.(2019河北张家口高三模拟)一种检测空气中甲醛(HCHO)含量的电化学传感器的工作原理如图所示。下列说法正确的是( )
A.传感器工作时,工作电极电势高
B.工作时,H+通过交换膜向工作电极附近移动
C.当导线中通过1.2×10-6 mol电子,进入传感器的甲醛为3×10-3 mg
D.工作时,对电极区电解质溶液的pH增大
答案D
解析HCHO在工作电极失电子被氧化,作原电池的负极,工作电极电势低,故A项错误;根据原电池工作原理可知,工作时,溶液中的阳离子(氢离子)向电源的正极移动,即对电极方向,故B项错误;负极反应为HCHO+H2O-4e-CO2+4H+,当电路中转移1.2×10-6 mol电子时,消耗HCHO的物质的量为14×1.2×10-6 mol=3.0×10-7 mol,则HCHO的质量为3.0×10-7 mol×30 g·mol-1=9×10-3 mg,故C项错误;工作时,对电极的电极反应为4H++O2+4e-2H2O,反应后生成水,虽然有相同数量的氢离子从负极迁移过来,但是,由于溶液的体积增大,正极区溶液的酸性减弱,其pH增大,故D项正确。
9.
(2019江西师大附中高三期末)研究人员发现了一种“水”电池,其总反应为5MnO2+2Ag+2NaClNa2Mn5O10+2AgCl。如图用“水”电池为电源电解NaCl溶液的实验中,X电极上有无色气体逸出。下列有关分析正确的是( )
A.Ⅰ为负极,其电极反应式为Ag+Cl-+e-AgCl
B.“水”电池内Na+不断向负极作定向移动
C.每转移1 mol e-,U形管中消耗0.5 mol H2O
D.“水”电池内,每生成1 mol Na2Mn5O10,X电极上生成1 mol 气体
答案D
解析X电极上有无色气体逸出,应为阴极,生成氢气,则Ⅰ为负极,根据电池总反应可判断出反应中Ag的化合价升高,被氧化,Ag应为原电池的负极,AgCl是氧化产物,则负极发生反应Ag+Cl--e-AgCl,故A项错误;原电池工作时,阳离子向正极移动,所以“水”电池内Na+不断向正极作定向移动,故B项错误;每转移1 mol e-,由反应2Cl-+2H2O2OH-+H2↑+Cl2↑可知,生成0.5 mol氢气,消耗1 mol H2O,故C项错误;由方程式可知每生成1 mol Na2Mn5O10转移2 mol电子,又X电极上有无色气体逸出,即电极反应为2H2O+2e-2OH-+H2↑,所以X电极上生成1 mol气体,故D项正确。
10.(2019福建莆田第二十四中学高三调研)如图是一种新型锂电池装置,电池充、放电反应为xLi+LiV3O8Li1+xV3O8。放电时,需先引发铁和氯酸钾反应使共晶盐熔化。下列说法不正确的是( )
A.共晶盐储热效果好,利于电解质熔化
B.整个过程的能量转化只涉及化学能转化为电能
C.放电时LiV3O8电极的反应为xLi++xe-+LiV3O8Li1+xV3O8
D.充电时Cl-移向LiV3O8电极
答案B
解析共晶盐是优良的传热储能介质,利于电解质熔化,故A项正确;整个过程的能量转化有化学能转化为电能,还有热能的转化,故B项错误;放电时为原电池,LiV3O8电极作正极,其电极的反应式为xLi++xe-+LiV3O8Li1+xV3O8,故C项正确;充电时为电解池,Cl-向阳极LiV3O8电极移动,故D项正确。
11.(2019江西师大附中高三期末)一种双室微生物燃料电池,以苯酚(C6H6O)为燃料,同时消除酸性废水中的硝酸盐。下列说法正确的是( )
A.a为正极
B.左池电极反应式为C6H6O+11H2O-28e-6CO2↑+28H+
C.若右池产生0.672 L气体(标况下),则转移电子0.15 mol
D.左池消耗的苯酚与右池消耗的NO3-的物质的量之比为28∶5
答案B
解析由题意分析可知,a为负极,故A项错误;由分析知,左池电极为负极,电极反应式为C6H6O+11H2O-28e-6CO2↑+28H+,故B项正确;右池产生气体为氮气,n(N2)=0.672 L/22.4 L·mol-1=0.03 mol,由正极的电极反应式知转移电子0.3 mol,故C项错误;根据电子守恒,结合电极反应式可知左池消耗的苯酚与右池消耗的NO3-的物质的量之比应为5∶28,故D项错误。
拓展深化
12.
(1)如图所示,若溶液C为浓硝酸,电流表指针发生偏转,B电极材料为Fe,A电极材料为Cu,则B电极的电极反应式为 ,A电极的电极反应式为 ;反应进行一段时间后溶液C的pH会 (填“升高”“降低”或“基本不变”)。
(2)我国首创以铝—空气—海水电池作为能源的新型海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是 (填物质名称),负极反应为 ;正极反应为 。
(3)熔融盐电池具有高的发电效率,因而受到重视。可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,其负极反应式为2CO+2CO32--4e-4CO2,则正极反应式为 ,电池总反应式为 。
答案(1)4H++2NO3-+2e-2NO2↑+2H2O
Cu-2e-Cu2+ 升高
(2)铝 4Al-12e-4Al3+ 3O2+6H2O+12e-12OH-
(3)O2+2CO2+4e-2CO32- 2CO+O22CO2
解析(1)常温下Fe在浓硝酸中发生钝化,作正极,B电极的电极反应式为4H++2NO3-+2e-2NO2↑+2H2O,A电极的电极反应式为Cu-2e-Cu2+;反应消耗H+,反应进行一段时间后溶液C的pH会升高。(2)电源的负极材料是铝,负极反应为4Al-12e-4Al3+;正极反应为3O2+6H2O+12e-12OH-。(3)正极反应式为O2+2CO2+4e-2CO32-,电池总反应式为2CO+O22CO2。