- 4.52 MB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第
29
讲 无机化学与化学反应原理综合
(
第
30
题
)
-
2
-
精选例题
命题探究
解题策略
(2018·4·
浙江选考
)(
一
)
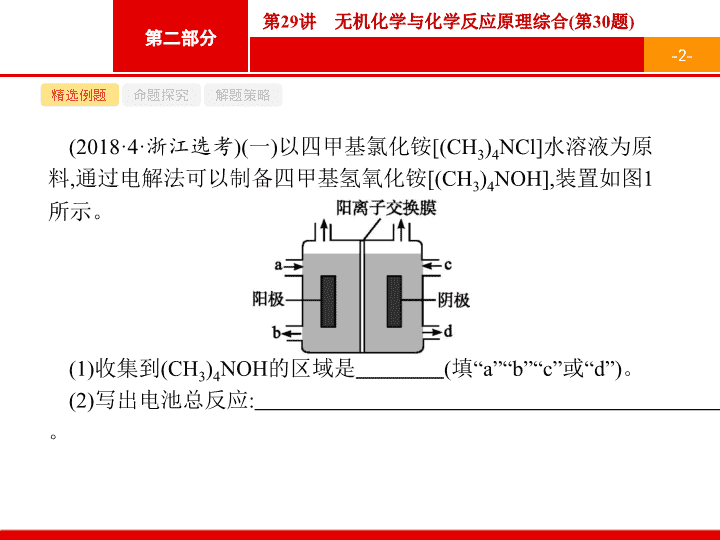
以四甲基氯化铵
[(CH
3
)
4
NCl]
水溶液为原料
,
通过电解法可以制备四甲基氢氧化铵
[(CH
3
)
4
NOH],
装置如图
1
所示
。
(1)
收集到
(CH
3
)
4
NOH
的区域是
(
填
“a”“b”“c”
或
“d”)
。
(2)
写出电池总反应
:
。
-
3
-
精选例题
命题探究
解题策略
(
二
)
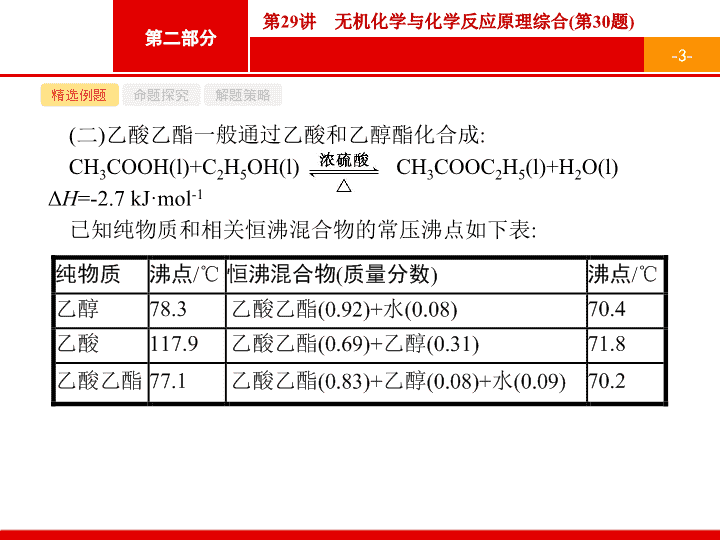
乙酸乙酯一般通过乙酸和乙醇酯化合成
:
CH
3
COOH(l)+C
2
H
5
OH(l
) CH
3
COOC
2
H
5
(l
)+H
2
O(l)
Δ
H
=-2.7 kJ·mol
-1
已知纯物质和相关恒沸混合物的常压沸点如下表
:
-
4
-
精选例题
命题探究
解题策略
请完成
:
(1)
关于该反应
,
下列说法不合理的是
。
A.
反应体系中浓硫酸有催化作用
B.
因为化学方程式前后物质的化学计量数之和相等
,
所以反应的
Δ
S
等于零
C.
因为反应的
Δ
H
接近于零
,
所以温度变化对平衡转化率的影响大
D.
因为反应前后都是液态物质
,
所以压强变化对化学平衡的影响可忽略不计
-
5
-
精选例题
命题探究
解题策略
(2)
一定温度下该反应的平衡常数
K
=4.0
。若按化学方程式中乙酸和乙醇的化学计量数比例投料
,
则乙酸乙酯的平衡产率
y
=
;
若乙酸和乙醇的物质的量之比为
n
∶
1,
相应平衡体系中乙酸乙酯的物质的量分数为
x
,
请在图
2
中绘制
x
随
n
变化的示意图
(
计算时不计副反应
)
。
(3)
工业上多采用乙酸过量的方法
,
将合成塔中乙酸、乙醇和硫酸混合液加热至
110
℃
左右发生酯化反应并回流
,
直到塔顶温度达到
70~71
℃
,
开始从塔顶出料。控制乙酸过量的作用有
。
-
6
-
精选例题
命题探究
解题策略
(4)
近年
,
科学家研究了乙醇催化合成乙酸乙酯的新方法
:
在常压下反应
,
冷凝收集
,
测得常温下液态收集物中主要产物的质量分数如图
3
所示。关于该方法
,
下列推测合理的是
。
A.
反应温度不宜超过
300
℃
B.
增大体系压强
,
有利于提高乙醇平衡转化率
C.
在催化剂作用下
,
乙醛是反应历程中的中间产物
D.
提高催化剂的活性和选择性
,
减少乙醚、乙烯等副产物是工艺的关键
-
7
-
精选例题
命题探究
解题策略
-
8
-
精选例题
命题探究
解题策略
-
9
-
精选例题
命题探究
解题策略
-
10
-
精选例题
命题探究
解题策略
(4)A
项
,
根据乙醇催化合成乙酸乙酯的新方法和图像
,
可知反应温度不宜超过
300
℃
,
合理
;B
项
,
增大体系压强
,
平衡逆向移动
,
故不利于提高乙醇平衡转化率
,
不合理
;C
项
,
由图像可知
,
乙醛的质量分数在
275
℃
之后逐渐减小
,
乙酸乙酯的质量分数逐渐增大
,
所以乙醛是反应历程中的中间产物
,
合理
;D
项
,
有机反应中副反应较多
,
提高催化剂的活性和选择性
,
减小乙醚、乙烯等副产物
,
提高催化剂的活性有利于反应的发生
,
合理。故选
ACD
。
-
11
-
精选例题
命题探究
解题策略
30
题是加试题的第
1
题
,
涉及元素化合物、化学反应原理知识
,
往往围绕一个有实际背景的可逆反应进行
,
考查热化学反应方程式、标准燃烧热、盖斯定律、化学反应速率、化学平衡移动、电化学、化学平衡及电解质溶液的知识
,
涉及的基本能力有审题能力、计算能力、简答能力及绘图能力等。此题考查知识全面
,
题目综合性较强
,
有一定难度。
-
12
-
精选例题
命题探究
解题策略
-
13
-
精选例题
命题探究
解题策略
跟踪训练
1
.(2017·11·
浙江选考
)
(
一
)
十氢萘是具有高储氢密度的氢能载体
,
经历
“
十氢萘
(C
10
H
18
)→
四氢萘
(C
10
H
12
)→
萘
(C
10
H
8
)”
的脱氢过程释放氢气。已知
:
Δ
H
1
>Δ
H
2
>0;C
10
H
18
→C
10
H
12
的活化能为
E
a1
,C
10
H
12
→C
10
H
8
的活化能为
E
a2
,
十氢萘的常压沸点为
192
℃
;
在
192
℃
,
液态十氢萘脱氢反应的平衡转化率约为
9%
。
-
14
-
精选例题
命题探究
解题策略
请回答
:
(1)
有利于提高上述反应平衡转化率的条件是
。
A.
高温高压
B.
低温低压
C.
高温低压
D
.
低温高压
(2)
研究表明
,
将适量十氢萘置于恒容密闭反应器中
,
升高温度带来高压
,
该条件下也可显著释氢
,
理由是
。
-
15
-
精选例题
命题探究
解题策略
(3)
温度
335
℃
,
在恒容密闭反应器中进行高压液态十氢萘
(1.00 mol)
催化脱氢实验
,
测得
C
10
H
12
和
C
10
H
8
的产率
x
1
和
x
2
(
以物质的量分数计
)
随时间的变化关系如图
1
所示
。
图
1
①
在
8 h
时
,
反应体系内氢气的量为
mol(
忽略其他副反应
)
。
②
x
1
显著低于
x
2
的原因是
。
-
16
-
精选例题
命题探究
解题策略
③
在图
2
中绘制
“C
10
H
18
→C
10
H
12
→C
10
H
8
”
的
“
能量
—
反应过程
”
示意图
。
图
2
(
二
)
科学家发现
,
以
H
2
O
和
N
2
为原料
,
熔融
NaOH-KOH
为电解质
,
纳米
Fe
2
O
3
作催化剂
,
在
250
℃
和常压下可实现电化学合成氨。阴极区发生的变化可视为按两步进行。
请补充完整。
-
17
-
精选例题
命题探究
解题策略
答案
:
(
一
)(1)C
(2)
温度升高加快反应速率
;
温度升高使平衡正向移动的作用大于压强增大使平衡逆向移动的作用
(3)
①
1.95
②催化剂显著降低了
C
10
H
12
→C
10
H
8
的活化能
,
反应生成的
C
10
H
12
很快转变为
C
10
H
8
,C
10
H
12
不能积累
③
-
18
-
精选例题
命题探究
解题策略
解析
:
(
一
)(1)
提高平衡转化率即平衡正向移动
,
应该升温
,
降压。所以选择高温低压
,
选
C
。
(2)
升高温度带来高压
,
该条件下也可显著释氢
,
这种现象可从两方面分析
,
一方面温度升高能加快反应速率
;
另一方面是由于温度升高使平衡正向移动的作用大于压强增大使平衡逆向移动的作用。
(3)
①
该反应可以直接看成十氢萘分别分解为四氢萘和萘
,
则生成氢气的物质的量为
:0.374
mol×5+0.027
mol×3≈1.95
mol
。
③
由题意可知
,
两个反应均为吸热反应
,
且
Δ
H
1
>Δ
H
2
。
(
二
)
根据阴极的另一个方程式以及题干信息可知
,Fe
2
O
3
参与阴极反应
,
生成
Fe
。电解质为熔融
NaOH
-
KOH,
则电极反应式为
-
19
-
精选例题
命题探究
解题策略
2
.(
2017·4·
浙江选考
)
以氧化铝为原料
,
通过碳热还原法可合成氮化铝
(AlN);
通过电解法可制取铝。电解铝时阳极产生的
CO
2
可通过二氧化碳甲烷化再利用。
请回答
:
碳热还原
Al
2
O
3
合成
AlN
的总热化学方程式是
,
该反应自发进行的条件
。
-
20
-
精选例题
命题探究
解题策略
(2)
在常压、
Ru/TiO
2
催化下
,CO
2
和
H
2
混
合
气体
(
体积比
1
∶
4,
总物质的量
a
mol)
进行反应
,
测得
CO
2
转化率、
CH
4
和
CO
选择性随温度变化情况分别如图
1
和图
2
所示
(
选择性
:
转化的
CO
2
中生成
CH
4
或
CO
的百分比
)
。
-
21
-
精选例题
命题探究
解题策略
-
22
-
精选例题
命题探究
解题策略
-
23
-
精选例题
命题探究
解题策略
①
下列说法不正确的是
。
A.Δ
H
4
小于零
B.
温度可影响产物的选择性
C.CO
2
平衡转化率随温度升高先增大后减少
D.
其他条件不变
,
将
CO
2
和
H
2
的初始体积比改变为
1
∶
3,
可提高
CO
2
平衡转化率
②
350
℃
时
,
反应
Ⅰ
在
t
1
时刻达到平衡
,
平衡时容器体积为
V
L,
该温度下反应
Ⅰ
的平衡常数为
(
用
a
、
V
表示
)
。
-
24
-
精选例题
命题探究
解题策略
③
350
℃
下
CH
4
物质的量随时间的变化曲线如图
3
所示。画出
400
℃
下
0~
t
1
时刻
CH
4
物质的量随时间的变化曲线
。
图
3
(3)
据文献报道
,CO
2
可以在碱性水溶液中电解生成甲烷
,
生成甲烷的电极反应式是
。
-
25
-
精选例题
命题探究
解题策略
-
26
-
精选例题
命题探究
解题策略
Δ
H
=+1
026
kJ
·
mol
-1
,
若使反应自发
,
则
Δ
G
<0,Δ
G
=Δ
H
-
T
Δ
S
,Δ
S
>0,Δ
H
>0,
则条件应为高温。
(2)
①
结合图
1
、图
2
分析
,400
℃
之前甲烷的选择性为
100%,CO
2
在
350
℃
之前为未平衡之前的转化率
,
之后为
CO
2
的平衡转化率
,
温度升高转化率降低
,
说明反应
Ⅰ
为放热反应
,Δ
H
4
<0,A
正确
,C
错误
;
从图
2
可知当温度小于
400
℃
时
,
只发生反应
I,
当温度大于
400
℃
时
,
反应
Ⅰ
选择性减小
,
反应
Ⅱ
的选择性增大
,B
项正确
;
其他条件不变
,
将
CO
2
和
H
2
的初始体积比改为
1
∶
3,
相当于减小了
H
2
的浓度
,CO
2
平衡转化率减小
,D
项错误。
②
350
℃
,
反应
Ⅰ
在
t
1
时刻达到平衡
,
列三段式
:
-
27
-
精选例题
命题探究
解题策略
-
28
-
精选例题
命题探究
解题策略
3
.(
2016·10·
浙江选考
)
氯及其化合物在生活和生产中应用广泛。
①
该反应是放热还是吸热
,
判断并说明理由
。
②
900 K
时
,
体积比为
4
∶
1
的
HCl
和
O
2
在恒温恒容的密闭容器中发生反应
,HCl
的平衡转化率
α
(HCl)
随压强
(
p
)
变化曲线如图
,
保持其他条件不变
,
升温到
TK(
假定反应历程不变
),
请画出压强在
1.5×10
5
~4.5×10
5
Pa
范围内
,HCl
的平衡转化率
α
(HCl)
随压强
(
p
)
变化曲线示意图。
-
29
-
精选例题
命题探究
解题策略
-
30
-
精选例题
命题探究
解题策略
①
写出在溶液中
NaClO
分解生成
NaClO
3
的热化学方程式
:
。
②
用过量的冷
NaOH
溶液吸收氯气
,
制得
NaClO
溶液
(
不含
NaClO
3
),
此时
ClO
-
的浓度为
c
0
mol·L
-1
;
加热时
NaClO
转化为
NaClO
3
,
测得
t
时刻溶液中
ClO
-
浓度为
c
1
mol·L
-1
,
写出该时刻溶液中
Cl
-
浓度的表达式
:
c
(Cl
-
)=
(
用
c
0
、
c
1
表示
)mol·L
-1
。
③
有研究表明
,
生成
NaClO
3
的反应分两步进行
:
常温下
,
反应
Ⅱ
能快速进行
,
但氯气与
NaOH
溶液反应很难得到
NaClO
3
,
试用碰撞理论解释其原因
:
。
-
31
-
精选例题
命题探究
解题策略
(3)
电解
NaClO
3
水溶液可制备
NaClO
4
。在电解过程中由于阴极上吸附氢气
,
会使电解电压升高
,
电解效率下降。为抑制氢气的产生
,
可选择合适的物质
(
不引入杂质
),
写出该电解的总化学方程式
:
。
-
32
-
精选例题
命题探究
解题策略
-
33
-
精选例题
命题探究
解题策略
-
34
-
精选例题
命题探究
解题策略
-
35
-
精选例题
命题探究
解题策略
-
36
-
精选例题
命题探究
解题策略
-
37
-
精选例题
命题探究
解题策略
4
.(
2016·4·
浙江选考
)
氨气及其相关产品是基本化工原料
,
在化工领域中具有重要的作用。
(1)
以铁为催化剂
,0.6 mol
氮气和
1.8 mol
氢气在恒温、容积恒定为
1 L
的密闭容器中反应生成氨气
,20 min
后达到平衡
,
氮气的物质的量为
0.3 mol
。
①
在第
25 min
时
,
保持温度不变
,
将容器体积迅速增大至
2 L
并保持恒容
,
体系达到平衡时
N
2
的总转化率为
38.2%,
请画出从第
25 min
起
H
2
的物质的量浓度随时间变化的曲线。
-
38
-
精选例题
命题探究
解题策略
②
该反应体系未达到平衡时
,
催化剂对逆反应速率的影响是
(
填
“
增大
”“
减少
”
或
“
不变
”)
。
-
39
-
精选例题
命题探究
解题策略
(2)
①
N
2
H
4
是一种高能燃料
,
有强还原性
,
可通过
NH
3
和
NaClO
反应制得
,
写出该制备反应的化学方程式
。
②
N
2
H
4
的水溶液呈弱碱性
,
室温下其电离常数
K
1
=1.0×10
-6
,
则
0.01mol·L
-1
N
2
H
4
水溶液的
pH
等于
(
忽略
N
2
H
4
的二级电离和
H
2
O
的电离
)
。
③
已知
298 K
和
101 kPa
条件下
:
则
表示
N
2
H
4
(l
)
的
标准燃烧热
的
Δ
H
=
。
-
40
-
精选例题
命题探究
解题策略
(3)
科学家改进了
NO
2
转化为
HNO
3
的工艺
(
如虚框所示
),
在较高的操作压力下
,
提高
N
2
O
4
/H
2
O
的质量比和
O
2
的用量
,
能制备出高浓度的硝酸
。
实际操作中
,
应控制
N
2
O
4
/H
2
O
质量比高于
5.11,
对此请给出合理解释
。
-
41
-
精选例题
命题探究
解题策略
-
42
-
精选例题
命题探究
解题策略
-
43
-
精选例题
命题探究
解题策略
-
44
-
精选例题
命题探究
解题策略
-
45
-
精选例题
命题探究
解题策略
正确的图像
为
②
催化剂能同等程度地增大化学反应速率
,
所以该反应体系未达到平衡时
,
催化剂对逆反应速率的影响也是增大的
。
-
46
-
精选例题
命题探究
解题策略
(2)
①
题给信息
N
2
H
4
“
可通过
NH
3
和
NaClO
反应制得
”,
则可以迅速找到
“
氧化剂
NaClO”
、
“
还原剂
NH
3
”
及对应的
“
氧化产物
N
2
H
4
”,
根据氧化还原反应原理
(
化合价的变化等
)
可以得出
“
还原产物
NaCl”,
再利用氧化还原反应方程式的配平方法
,
写出方程式
:
-
47
-
精选例题
命题探究
解题策略