- 231.00 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
题型十 水溶液中的离子平衡
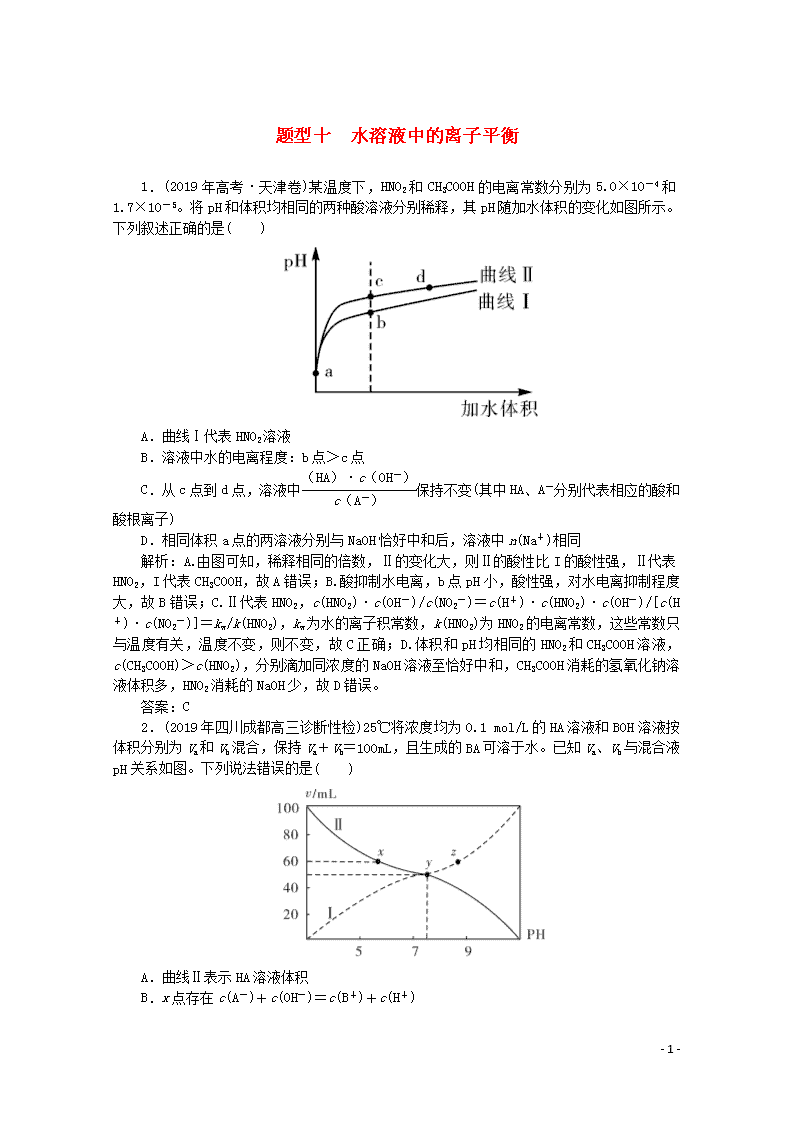
1.(2019年高考·天津卷)某温度下,HNO2和CH3COOH的电离常数分别为5.0×10-4和1.7×10-5。将pH和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是( )
A.曲线Ⅰ代表HNO2溶液
B.溶液中水的电离程度:b点>c点
C.从c点到d点,溶液中保持不变(其中HA、A-分别代表相应的酸和酸根离子)
D.相同体积a点的两溶液分别与NaOH恰好中和后,溶液中n(Na+)相同
解析:A.由图可知,稀释相同的倍数,Ⅱ的变化大,则Ⅱ的酸性比I的酸性强,Ⅱ代表HNO2,I代表CH3COOH,故A错误;B.酸抑制水电离,b点pH小,酸性强,对水电离抑制程度大,故B错误;C.Ⅱ代表HNO2,c(HNO2)·c(OH-)/c(NO2-)=c(H+)·c(HNO2)·c(OH-)/[c(H+)·c(NO2-)]=kw/k(HNO2),kw为水的离子积常数,k(HNO2)为HNO2的电离常数,这些常数只与温度有关,温度不变,则不变,故C正确;D.体积和pH均相同的HNO2和CH3COOH溶液,c(CH3COOH)>c(HNO2),分别滴加同浓度的NaOH溶液至恰好中和,CH3COOH消耗的氢氧化钠溶液体积多,HNO2消耗的NaOH少,故D错误。
答案:C
2.(2019年四川成都高三诊断性检)25℃将浓度均为0.1 mol/L的HA溶液和BOH溶液按体积分别为Va和Vb混合,保持Va+Vb=100 mL,且生成的BA可溶于水。已知Va、Vb与混合液pH关系如图。下列说法错误的是( )
A.曲线Ⅱ表示HA溶液体积
B.x点存在c(A-)+c(OH-)=c(B+)+c(H+)
- 5 -
C.电离平衡常数K(HA)>K(BOH)
D.向z点溶液加入NaOH,水的电离程度减小
解析:A.由图可知,当HA溶液与BOH溶液等体积混合时,溶液的pH>7,随着曲线I体积的增大,溶液的pH逐渐增大,说明曲线Ⅰ表示BOH溶液的体积,则曲线Ⅱ表示HA溶液体积,故A正确;B.根据图像,x点HA溶液体积大于BOH溶液体积,溶液为HA和BA的混合溶液,根据电荷守恒,有c(A-)+c(OH-)=c(B+)+c(H+),故B正确;C.由图可知,当HA溶液与BOH溶液等体积混合时,溶液的pH>7,溶液显碱性,说明K(HA)c(B2-)>c(OH-)>c(H+)
D.F点溶液c(NH4+)=2c(B2-)
解析:A.该稀酸中水电离出的c(H+)=10-13 mol/L,所以0.05 mol/L的H2B溶液中c(H+)==0.01 mol/L,所以H2B为强酸,NaHB为强酸的酸式盐为酸性,A项错误;B.向酸溶液中逐渐加入碱发生中和反应,混合液溶液的pH是逐渐增大的,B项错误; C.E点溶液由(NH4)2B和氨水混合而成,由于水电离的c(H+)>1×10-7mol/L,溶液中H+全部来自水电离,则E点水溶液显酸性,所以c(H+)>c(OH-),C项错误;D.F点溶液由(NH4)2B和氨水混合而成,由于水电离的c(H+)=1×10-7mol/L,溶液中H+全部来自水电离,则F点水溶液呈中性,此时溶液中的电荷守恒有:c(NH4+)+c(H+)=c(OH-)+2c(B2-),因c(H+)=c(OH-),所以有c(NH4+)=2c(B2-),D项正确。
答案:D
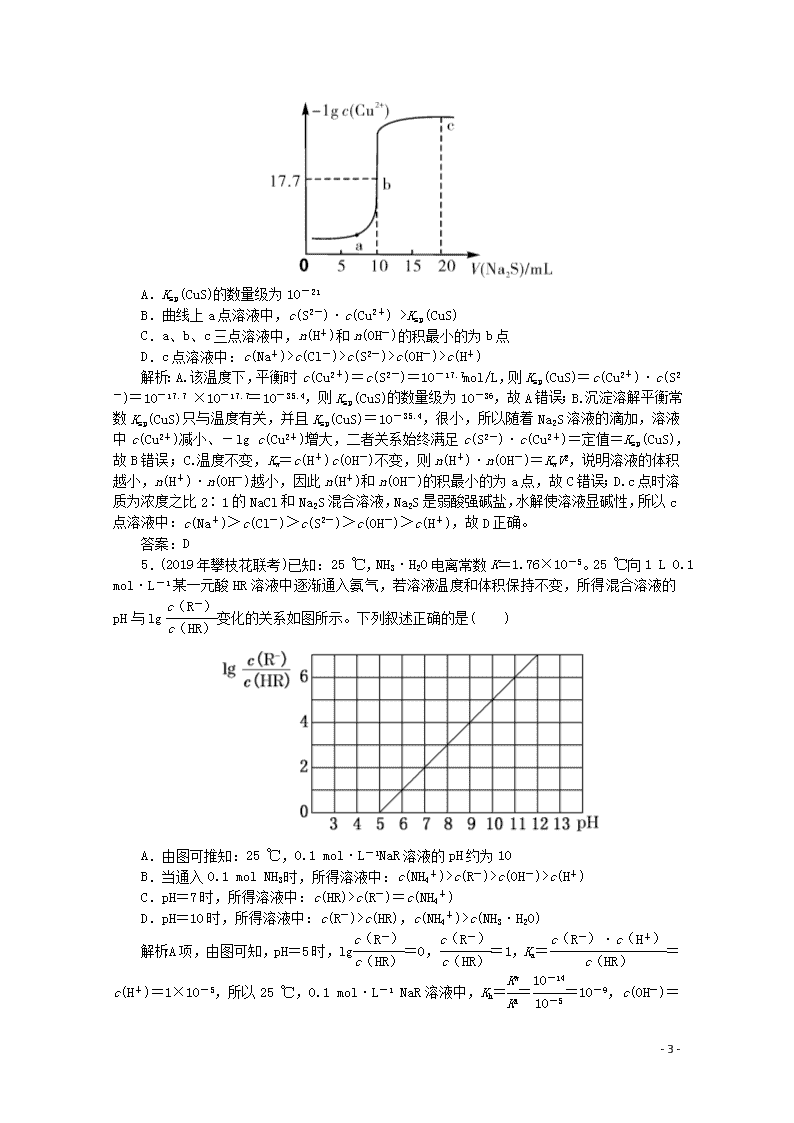
4.(2019年河南省洛阳市高三模拟考试)常温下,向10 mL 0.10 mol/L CuCl2溶液中滴加0.10 mol/L Na2S溶液,滴加过程中-lg c(Cu2+)与Na2S溶液体积(V)的关系如图所示。下列说法正确的是( )
- 5 -
A.Ksp(CuS)的数量级为10-21
B.曲线上a点溶液中,c(S2-)·c(Cu2+) >Ksp(CuS)
C.a、b、c三点溶液中,n(H+)和n(OH-)的积最小的为b点
D.c点溶液中:c(Na+)>c(Cl-)>c(S2-)>c(OH-)>c(H+)
解析:A.该温度下,平衡时c(Cu2+)=c(S2-)=10-17.7mol/L,则Ksp(CuS)=c(Cu2+)·c(S2-)=10-17.7 ×10-17.7=10-35.4,则Ksp(CuS)的数量级为10-36,故A错误;B.沉淀溶解平衡常数Ksp(CuS)只与温度有关,并且Ksp(CuS)=10-35.4,很小,所以随着Na2S溶液的滴加,溶液中c(Cu2+)减小、-lg c(Cu2+)增大,二者关系始终满足c(S2-)·c(Cu2+)=定值=Ksp(CuS),故B错误;C.温度不变,Kw=c(H+)c(OH-)不变,则n(H+)·n(OH-)=KwV2,说明溶液的体积越小,n(H+)·n(OH-)越小,因此n(H+)和n(OH-)的积最小的为a点,故C错误;D.c点时溶质为浓度之比2∶1的NaCl和Na2S混合溶液,Na2S是弱酸强碱盐,水解使溶液显碱性,所以c点溶液中:c(Na+)>c(Cl-)>c(S2-)>c(OH-)>c(H+),故D正确。
答案:D
5.(2019年攀枝花联考)已知:25 ℃,NH3·H2O电离常数K=1.76×10-5。25 ℃向1 L 0.1 mol·L-1某一元酸HR溶液中逐渐通入氨气,若溶液温度和体积保持不变,所得混合溶液的pH与lg变化的关系如图所示。下列叙述正确的是( )
A.由图可推知:25 ℃,0.1 mol·L-1NaR溶液的pH约为10
B.当通入0.1 mol NH3时,所得溶液中:c(NH4+)>c(R-)>c(OH-)>c(H+)
C.pH=7时,所得溶液中:c(HR)>c(R-)=c(NH4+)
D.pH=10时,所得溶液中:c(R-)>c(HR),c(NH4+)>c(NH3·H2O)
解析:A项,由图可知,pH=5时,lg=0,=1,Ka==c(H+)=1×10-5,所以25 ℃,0.1 mol·L-1 NaR溶液中,Kh===10-9,c(OH-)=≈
- 5 -
eq
(10-9×0.1)=1×10-5 mol·L-1,pH约为9,错误;B项,当通入0.1 mol NH3时,所得溶液中的溶质为NH4R,NH4R的阴、阳离子可以发生相互促进的水解反应,由于NH3·H2O电离常数K=1.76×10-5,而HR的Ka=1×10-5,故R-的水解程度较大,溶液显碱性,所以c(NH4+)>c(R-)>c(OH-)>c(H+),正确;C项,pH=7时,由图可知,lg=2,则=102,所以c(R-)>c(HR),由电荷守恒可知c(R-)=c(NH4+),所得溶液中:c(R-)=c(NH4+)>c(HR),错误;D项,由图可知,pH=10时,lg=5,即=105,所以c(R-)>c(HR),pH=10时,c(OH-)=1×10-4 mol·L-1,由NH3·H2O电离常数K=1.76×10-5可以求出=<1,c(NH4+)