- 266.50 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2016-2017学年河南省平顶山市叶县二中高二(上)月考化学试卷(9月份)
一、选择题(共16小题,每小题3分,满分48分)
1.热化学方程式中化学式前的化学计量数表示( )
A.分子个数 B.物质的量 C.物质的质量 D.原子个数
2.已知下列热化学方程式:
①H2(g)+O2(g)═H2O(g)△H1=a kJ•mol﹣1②2H2(g)+O2(g)═2H2O(g)△H2=b kJ•mol﹣1
③H2(g)+O2(g)═H2O(l)△H3=c kJ•mol﹣1④2H2(g)+O2(g)═2H2O(l)△H4=d kJ•mol﹣1
下列关系式中正确的是( )
A.a<c<0 B.b>d>0 C.2a=b<0 D.2c=d>0
3.在一定条件下,CO和CH4燃烧的热化学方程式分别为:
2CO(g)+O2(g)═2CO2(g)△H=﹣566kJ•mol﹣1
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890kJ•mol﹣1
由1mol CO和3mol CH4组成的混合气体在上述条件下完全燃烧时,释放的热量为( )
A.2 912 kJ B.2 953 kJ C.3 236 kJ D.3 867 kJ
4.据报道,科学家开发出了利用太阳能分解水的新型催化剂.下列有关水分解过程的能量变化示意图正确的是( )
A. B. C. D.
5.一定条件下反应2AB(g)⇌A2(g)+B2(g)达到平衡状态的标志是( )
A.单位时间内生成nmolA2的同时消耗n molAB
B.容器内,3种气体AB、A2、B2共存
C.AB的消耗速率等于A2的消耗速率
D.容器中各组分的体积分数不随时间变化
6.在一定温度不同压强(P1<P2)下,可逆反应2X(g)⇌2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是( )
A. B. C. D.
7.对可逆反应4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g),下列叙述正确的是( )
A.达到化学平衡时,4υ正(O2)=5υ逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D.化学反应速率关系是:2υ正(NH3)=3υ正(H2O)
8.已知反应A2(g)+2B2(g)⇌2AB2(g)△H<0,下列说法正确的是( )
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
9.将1mol SO2和1mol O2 通入体积不变的密闭容器中,在一定温度和催化剂作用下,反应达到平衡时 SO3为0.3mol,若此时移走0.5mol O2和0.5mol SO2则反应达到新的平衡时,SO3的物质的量是( )
A.0.3mol B.0.15mol
C.小于 0.15mol D.大于0.15mol而小于 0.3mol
10.在2A+B⇌3C+4D反应中,表示该反应速率最快的是( )
A.v(A)=0.5 mol/(L•s) B.v(B)=0.3 mol/(L•s)
C.v(C)=0.8 mol/(L•s) D.v(D)=1 mol/(L•s)
11.下列说法中有明显错误的是( )
A.对有气体参加的化学反应,增大压强体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大
B.升高温度,一般可使活化分子的百分数增大,因而反应速率增大
C.活化分子之间发生的碰撞一定为有效碰撞
D.加入适宜的催化剂,可使活化分子的百分数大大增加,从而成千上万倍地增大化学反应的速率
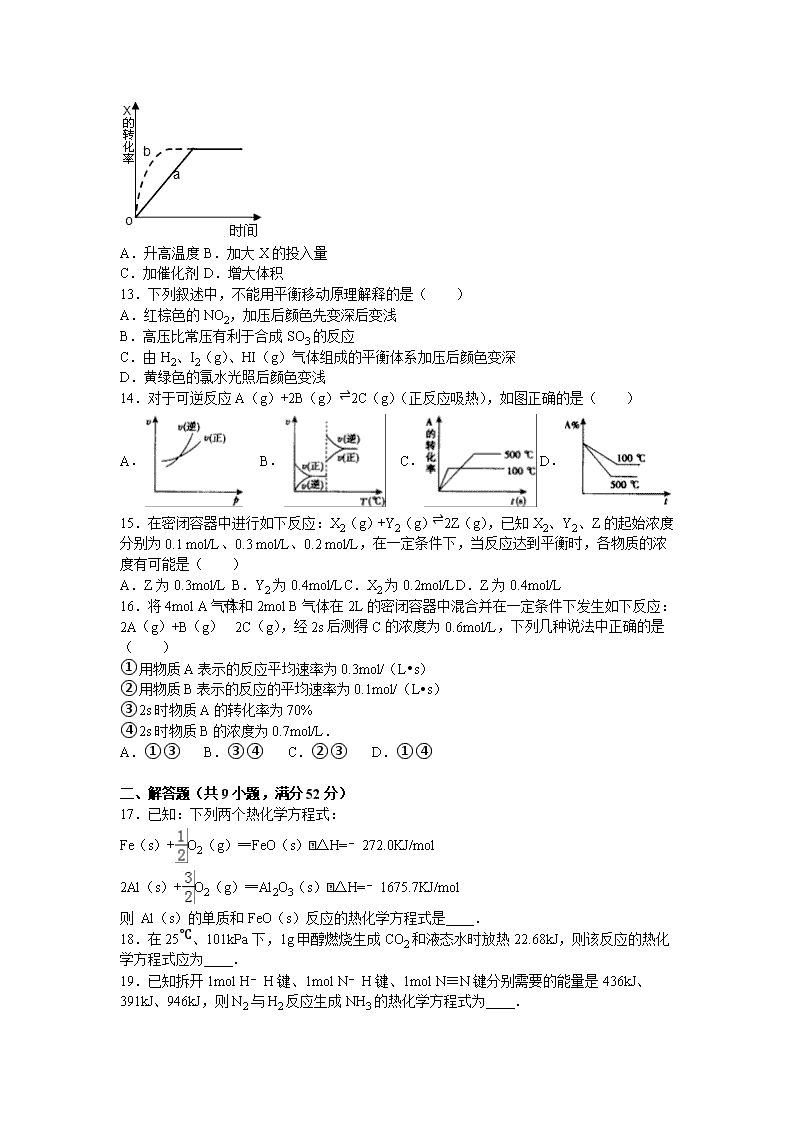
12.如图曲线a表示放热反应 X(g)+Y(g)⇌Z(g)+M(g)+N(s)△H<0进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
A.升高温度 B.加大X的投入量
C.加催化剂 D.增大体积
13.下列叙述中,不能用平衡移动原理解释的是( )
A.红棕色的NO2,加压后颜色先变深后变浅
B.高压比常压有利于合成SO3的反应
C.由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
D.黄绿色的氯水光照后颜色变浅
14.对于可逆反应A(g)+2B(g)⇌2C(g)(正反应吸热),如图正确的是( )
A. B. C. D.
15.在密闭容器中进行如下反应:X2(g)+Y2(g)⇌2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
A.Z为0.3mol/L B.Y2为0.4mol/L C.X2为0.2mol/L D.Z为0.4mol/L
16.将4mol A气体和2mol B气体在2L的密闭容器中混合并在一定条件下发生如下反应:2A(g)+B(g)⇌2C(g),经2s后测得C的浓度为0.6mol/L,下列几种说法中正确的是( )
①用物质A表示的反应平均速率为0.3mol/(L•s)
②用物质B表示的反应的平均速率为0.1mol/(L•s)
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7mol/L.
A.①③ B.③④ C.②③ D.①④
二、解答题(共9小题,满分52分)
17.已知:下列两个热化学方程式:
Fe(s)+O2(g)═FeO(s)D△H=﹣272.0KJ/mol
2Al(s)+O2(g)═Al2O3(s)D△H=﹣1675.7KJ/mol
则 Al(s)的单质和FeO(s)反应的热化学方程式是 .
18.在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,则该反应的热化学方程式应为 .
19.已知拆开1mol H﹣H键、1mol N﹣H键、1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为 .
20.对于下列反应:2SO2+O2 2SO3,如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为 ,用O2浓度变化来表示的反应速率为 .如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L•min),那么2min时SO2的浓度为 .
21.如图表示在密闭容器中反应:2SO2+O2⇌2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是 ;b c过程中改变的条件可能是 ; 若增大压强时,反应速度变化情况画在c~d处.
22.酶是蛋白质,具有蛋白质的特性,酶能催化很多化学反应,如图表示酶参加的反应中,温度与反应速率的关系,解释曲线变化原因 .
23.反应m A+n B⇌p C在某温度下达到平衡.
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是 .
②若在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为 态.
24.有两只密闭容器A和B,A能保持恒压,B能保持恒容.起始时向容积相等的A、B中分别通入体积比为2:1的等量的SO2和O2,使之发生反应:2SO2+O2⇌2SO3,并达到平衡.则(填“>”、“=”、“<”;“左”、“右”;“增大”、“减小”、“不变”).
(1)达到平衡所需要的时间:t(A) t(B),SO2的转化率:a(A) a (B)
(2)起始时两容器中的反应速率:v(A) v(B),反应过程中的反应速率:v(A) v(B).
(3)达到平衡时,在两容器中分别通入等量的Ar气.A中的化学平衡向 反应方向移动,B中的化学反应速率 .
(4)达到平衡后,向两容器中分别通入等量的原反应气体,再次达到平衡时,A容器中SO2的质量分数 ,B容器中SO2的质量分数 .
25.已知下表中的四个热化学方程式,
嫦娥一号
液氢(H2)
①2H2(g)+O2(g)=2H2O(l)△H=﹣571.6kJ•mol﹣1
②2H2(l)+O2(l)=2H2O(g)△H=﹣482.6kJ•mol﹣1
祥云火炬
丙烷
(C3H8)
③C3H8(l)+5O2(g)=3CO2(g)+4H2O(g)△H=﹣2013.8kJ•mol﹣1
④C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=﹣2221.5kJ•mol﹣1
(1)氢气的燃烧热是 ,丙烷的燃烧热是 .
(2)氢气作为燃料的主要优点是 .
2016-2017学年河南省平顶山市叶县二中高二(上)月考化学试卷(9月份)
参考答案与试题解析
一、选择题(共16小题,每小题3分,满分48分)
1.热化学方程式中化学式前的化学计量数表示( )
A.分子个数 B.物质的量 C.物质的质量 D.原子个数
【考点】热化学方程式.
【分析】热化学方程式中各物质的计量数表示的是物质的量,可以为分数,据此进行判断.
【解答】解:热化学方程式中化学式前的化学计量数不表示微粒数,表示的是物质的量,所以各计量数可以是整数,也可以是分数,
故选B.
2.已知下列热化学方程式:
①H2(g)+O2(g)═H2O(g)△H1=a kJ•mol﹣1②2H2(g)+O2(g)═2H2O(g)△H2=b kJ•mol﹣1
③H2(g)+O2(g)═H2O(l)△H3=c kJ•mol﹣1④2H2(g)+O2(g)═2H2O(l)△H4=d kJ•mol﹣1
下列关系式中正确的是( )
A.a<c<0 B.b>d>0 C.2a=b<0 D.2c=d>0
【考点】反应热的大小比较.
【分析】比较△H的大小必须带着正负号比较;根据在放热反应中,△H<0,当反应物相同时,产物的能量越高,放出的热量越小,则△H越大,反之成立;反应热的大小与计量数成比例;
【解答】解:A、反应①和③相比较,反应物相同,①的产物的能量高比③高,则放出的热量比③少,a比c大,故A错误;
B、氢气的燃烧是放热反应,即b和d均为负值,故B错误;
C、反应②是①的二倍,故b=2a,而且燃烧放热,即b=2a<0,故C正确;
D、氢气的燃烧是放热反应,即c和d均为负值,故D错误;
故选C.
3.在一定条件下,CO和CH4燃烧的热化学方程式分别为:
2CO(g)+O2(g)═2CO2(g)△H=﹣566kJ•mol﹣1
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890kJ•mol﹣1
由1mol CO和3mol CH4组成的混合气体在上述条件下完全燃烧时,释放的热量为( )
A.2 912 kJ B.2 953 kJ C.3 236 kJ D.3 867 kJ
【考点】反应热和焓变.
【分析】根据反应的化学方程式找出可燃物的质量与放出的热量之间的关系然后求得1摩CO和3摩CH4燃烧后放出的热量.
【解答】解:1摩CO完全燃烧时释放的热量为283千焦,1摩CH4完全燃烧时释放的热量为890千焦,所以1摩CO和3摩CH4燃烧后放出的热量为283千焦+890千焦×3=2953千焦,
故选:B.
4.据报道,科学家开发出了利用太阳能分解水的新型催化剂.下列有关水分解过程的能量变化示意图正确的是( )
A. B. C. D.
【考点】化学反应中能量转化的原因;催化剂的作用.
【分析】水的分解为吸热反应,反应物的总能量小于生成物的总能量,反应中加入催化剂会降低活化能,改变反应的速率,但反应热不改变.
【解答】解:A、水的分解为吸热反应,反应物的总能量小于生成物的总能量,与图不符,故A错;
B、加入催化剂反应热不变,并且图象符合反应物的总能量小于生成物的总能量,故B正确;
C、化学反应一定伴随着能量变化,反应物的总能量与生成物的总能量不相等,故C错;
D、加入催化剂降低反应的活化能,图象不符合,故D错.
故选:B.
5.一定条件下反应2AB(g)⇌A2(g)+B2(g)达到平衡状态的标志是( )
A.单位时间内生成nmolA2的同时消耗n molAB
B.容器内,3种气体AB、A2、B2共存
C.AB的消耗速率等于A2的消耗速率
D.容器中各组分的体积分数不随时间变化
【考点】化学平衡状态的判断.
【分析】根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
【解答】解:A、单位时间内生成nmolA2的同时消耗n molAB,都体现正向反应,故A错误;
B、可逆反应只要反应发生,就是反应物和生成物共存的体系,故B错误;
C、速率之比不等于计量数之比,故C错误;
D、容器中各组分的体积分数不随时间变化,说明达平衡状态,故D正确;
故选D.
6.在一定温度不同压强(P1<P2)下,可逆反应2X(g)⇌2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是( )
A. B. C. D.
【考点】产物百分含量与压强的关系曲线.
【分析】一定温度下,增大压强,反应速率增大,到达平衡的时间缩短,该反应正反应是体积增大的反应,平衡向逆反应移动,平衡时Z的物质的量减小,据此结合选项解答.
【解答】解:A、图象中压强p1到达平衡时间短,故图象中p1>p2,与题意不符,故A错误;
B、图象中压强p2到达平衡时间短,图象中p1<p2,增大压强,平衡时生成物Z的物质的量减小,与实际相符,故B正确;
C、图象中压强p1到达平衡时间短,故图象中p1>p2,与题意不符,故C错误;
D、图象中压强p2到达平衡时间短,图象中p1<p2,增大压强,平衡时生成物Z的物质的量增大,与实际不相符,故D错误;
故选B.
7.对可逆反应4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g),下列叙述正确的是( )
A.达到化学平衡时,4υ正(O2)=5υ逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D.化学反应速率关系是:2υ正(NH3)=3υ正(H2O)
【考点】化学平衡建立的过程.
【分析】A、当反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆速率之比等于化学化学计量数之比(不同物质),各物质的浓度、质量、体积分数以及百分含量不变,以及由此衍生的一些量也不发生变化;
B、都表示向反应正向进行,反应自始至终都是1:1,不能说明到达平衡;
C、增大体积压强减小,正逆速率都减小,平衡向体积增大的方向移动;
D、各物质表示的化学反应速率之比等于各物质前面的系数之比.
【解答】解:A、4v正(O2)=5v逆(NO),不同物质表示正逆反应速率之比等于化学计量数之比,表示反应达到平衡状态,故A正确;
B、若单位时间内生成xmolNO的同时,消耗xmolNH3,都表示向反应正向进行,反应自始至终都是1:1,不能说明到达平衡,故B错误;
C、达到化学平衡时,若增加容器体积,则物质的浓度减小,正逆反应速率均减小,平衡向正反应移动,故C错误;
D、化学反应速率关系是:3υ正(NH3)=2υ正(H2O),故D错误.
故选A.
8.已知反应A2(g)+2B2(g)⇌2AB2(g)△H<0,下列说法正确的是( )
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
【考点】化学平衡的影响因素.
【分析】A、升高温度正、逆反应速率都增大;
B、升高温度反应速率加快;
C、升温平衡向吸热反应方向进行,增大压强平衡向气体体积减小的方向移动;
D、降低温度平衡向放热反应移动,减小压强平衡向气体体积增大的方向移动.
【解答】解:A、升高温度正、逆反应速率都增大,该反应正反应是放热反应,逆反应速率增大更多,平衡向逆反应移动,故A错误;
B、升高温度反应速率加快,缩短到达平衡的时间,故B正确;
C、该反应正反应是体积减小的放热反应,升高温度有利于平衡向逆反应移动,增大压强有利于平衡向气正反应移动,故C错误;
D、该反应正反应是体积减小的放热反应,降低温度,平衡正向进行,减小压强平衡向气体体积增大的方向移动,即向逆反应移动,故D错误;
故选B.
9.将1mol SO2和1mol O2 通入体积不变的密闭容器中,在一定温度和催化剂作用下,反应达到平衡时 SO3为0.3mol,若此时移走0.5mol O2和0.5mol SO2则反应达到新的平衡时,SO3的物质的量是( )
A.0.3mol B.0.15mol
C.小于 0.15mol D.大于0.15mol而小于 0.3mol
【考点】化学平衡的影响因素.
【分析】反应达到平衡时移走 0.5molO2和0.5molSO2,达到新的平衡状态,该状态可以等效为开始加入时0.5molO2和0.5molSO2,所到达的平衡状态,与原平衡相比,压强降低,平衡向逆反应移动,反应物的转化率降低.
【解答】解:将lmolSO2和lmolO2通入体积不变的密闭容器中,反应达到平衡时移走 0.5molO2和0.5molSO2,达到新的平衡状态,该状态可以等效为开始加入时0.5molO2和0.5molSO2,所到达的平衡状态,与原平衡相比,压强降低,平衡向逆反应移动,反应物的转化率降低,若转化率不变时,生成的SO3为0.15mol,由于反应物转化率降低,故生成的SO3小于0.15mol,故选C.
10.在2A+B⇌3C+4D反应中,表示该反应速率最快的是( )
A.v(A)=0.5 mol/(L•s) B.v(B)=0.3 mol/(L•s)
C.v(C)=0.8 mol/(L•s) D.v(D)=1 mol/(L•s)
【考点】反应速率的定量表示方法.
【分析】利用速率之比等于化学计量数之比转化为用同一物质表示的速率,然后再进行比较.
【解答】解:都转化为D物质表示的速率进行比较,对于2A+B⇌3C+4D,
A、υ(A)=0.5 mol/(L•s),速率之比等于化学计量数之比,故υ(D)=2υ(A)=1mol/(L•s),
B、υ(B)=0.3mol/(L•s),速率之比等于化学计量数之比,故υ(D)=4υ(B)=1.2mol/(L•s),
C、υ(C)=0.8mol/(L•s),速率之比等于化学计量数之比,故υ(D)=υ(C)=×0.8mol/(L•s)=1.1mol/(L•s),
D、υ(D)=1 mol/(L•s),
故速率B>C>A=D,
故选B.
11.下列说法中有明显错误的是( )
A.对有气体参加的化学反应,增大压强体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大
B.升高温度,一般可使活化分子的百分数增大,因而反应速率增大
C.活化分子之间发生的碰撞一定为有效碰撞
D.加入适宜的催化剂,可使活化分子的百分数大大增加,从而成千上万倍地增大化学反应的速率
【考点】化学反应速率的影响因素.
【分析】A、根据压强对反应速率的影响进行判断;
B、利用温度对反应速率的影响分析;
C、活化分子之间发生的碰撞分为有效碰撞和无效碰撞;
D、催化剂对化学反应速率的影响进行判断.
【解答】解:A、增大压强体系体积减小,对于有气体参加的反应,可使单位体积内活化分子数增加,反应速率增大,故A说法正确;
B、升高温度,反应体系中物质的能量升高,一般可使活化分子的百分数增大,因而反应速率增大,故B说法正确;
C、由于活化分子之间的碰撞分为有效碰撞和无效碰撞,故C说法错误;
D、催化剂可使反应需要的能量减小,使活化分子的百分数大大增加,从而成千上万倍地增大化学反应的速率,故D说法正确;
故选C.
12.如图曲线a表示放热反应 X(g)+Y(g)⇌Z(g)+M(g)+N(s)△H<0进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
A.升高温度 B.加大X的投入量
C.加催化剂 D.增大体积
【考点】转化率随温度、压强的变化曲线.
【分析】由图象可知,由曲线a到曲线b,到达平衡的时间缩短,改变条件,反应速率加快,且平衡时x的转化率不变,说明条件改变不影响平衡状态的移动,据此结合选项判断.
【解答】解:由图象可知,由曲线a到曲线b,到达平衡的时间缩短,改变条件,反应速率加快,且平衡时x的转化率不变,说明条件改变不影响平衡状态的移动,
A、该反应正反应是放热反应,升高温度,反应速率加快,平衡向逆反应移动,x的转化率降低,故A错误;
B、加大X的投入量,X浓度增大,反应速率加快,平衡向正反应移动,但x的转化率降低,故B错误;
C、加入催化剂,反应速率加快,催化剂不影响平衡移动,x的转化率不变,故C正确;
D、增大体积,压强减小,该反应前后气体的物质的量不变,压强降低平衡不移动,但反应速率降低,故D错误;
故选C.
13.下列叙述中,不能用平衡移动原理解释的是( )
A.红棕色的NO2,加压后颜色先变深后变浅
B.高压比常压有利于合成SO3的反应
C.由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
D.黄绿色的氯水光照后颜色变浅
【考点】化学平衡移动原理.
【分析】平衡移动原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,平衡移动原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用平衡移动原理解释.
【解答】解:A.存在平衡2NO2(g)⇌N2O4(g),增大压强,混合气体的浓度增大,平衡体系颜色变深,该反应正反应为体积减小的反应,增大压强平衡正反应移动,二氧化氮的浓度又降低,颜色又变浅,由于移动的密度目的是减弱变化,而不是消除,故颜色仍不原来的颜色深,所以可以用平衡移动原理解释,故A不选;
B.存在平衡2SO2+O2(g)⇌2SO3(g),正反应为气体体积减小的反应,增大压强,平衡向正反应移动,有利于合成SO3,能用平衡移动原理解释,故B不选;
C.存在平衡H2+I2(g)⇌2HI(g),该反应前后气体的体积不变,增大压强,平衡不移动,增大平衡体系的压强气体的体积减小,碘的浓度增大,颜色变深,不能用平衡移动原理解释,故C选;
D.对氯水中的次氯酸受光照射会分解,次氯酸浓度减小,使得化学平衡Cl2+H2O⇌HCl+HClO向右移动,能用平衡移动原理解释,故D不选;
故选:C.
14.对于可逆反应A(g)+2B(g)⇌2C(g)(正反应吸热),如图正确的是( )
A. B. C. D.
【考点】化学反应速率与化学平衡图象的综合应用;体积百分含量随温度、压强变化曲线;转化率随温度、压强的变化曲线.
【分析】A、该反应为气体体积减小的反应,增大压强,平衡向着正向移动,应该正反应速率大于逆反应速率;
B、该反应为吸热反应,升高温度,平衡向着正向移动,正反应速率应该大于逆反应速率;
C、温度越高,反应速率越快,优先达到平衡状态,500℃时应该先达到平衡;
D、该反应为吸热反应,温度升高,A的转化率增大,则A的含量减小,且温度高的先达到平衡状态.
【解答】解:A、由反应方程式可知,正反应为体积缩小的反应,增大压强,化学平衡向着正向移动,图象A中增大压强后,逆反应速率大于正反应速率,平衡向着逆向移动,与该反应不符,故A错误;
B、该反应为吸热反应,达到平衡状态后,升高温度,正逆反应速率都增大,且正反应速率大于逆反应速率,平衡向着正向移动,图象B逆反应速率大于正反应速率,平衡向着逆向移动,与实际情况不符,故B错误;
C、升高温度,化学反应速率增加,平衡时间缩短,500℃时应该先达到平衡状态,图象C中却是100℃先达到平衡,图与理论不符,故C错误;
D、升高温度,平衡向着正向移动,A的转化率增大,A的百分含量减小,温度高的条件下先达到平衡状态,图象D与实际反应相符,故D正确;
故选D.
15.在密闭容器中进行如下反应:X2(g)+Y2(g)⇌2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
A.Z为0.3mol/L B.Y2为0.4mol/L C.X2为0.2mol/L D.Z为0.4mol/L
【考点】化学平衡建立的过程.
【分析】化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,
若反应向正反应进行到达平衡,X2、Y2的浓度最小,Z的浓度最大;
若反应逆正反应进行到达平衡,X2、Y2的浓度最大,Z的浓度最小;
利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,据此判断分析.
【解答】解:若反应向正反应进行到达平衡,X2、Y2的浓度最小,Z的浓度最大,假定完全反应,则:
X2(气)+Y2(气)⇌2Z(气),
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.1 0.1 0.2
平衡(mol/L):0 0.2 0.4
若反应逆正反应进行到达平衡,X2、Y2的浓度最大,Z的浓度最小,假定完全反应,则:
v X2(气)+Y2(气)⇌2Z(气),
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.1 0.1 0.2
平衡(mol/L):0.2 0.4 0
由于为可逆反应,物质不能完全转化所以平衡时浓度范围为0<c(X2)<0.2,0.2<c(Y2)<0.4,0<c(Z)<0.4,故A正确、BCD错误.
故选A.
16.将4mol A气体和2mol B气体在2L的密闭容器中混合并在一定条件下发生如下反应:2A(g)+B(g)⇌2C(g),经2s后测得C的浓度为0.6mol/L,下列几种说法中正确的是( )
①用物质A表示的反应平均速率为0.3mol/(L•s)
②用物质B表示的反应的平均速率为0.1mol/(L•s)
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7mol/L.
A.①③ B.③④ C.②③ D.①④
【考点】化学平衡的计算.
【分析】经2s后测得C的浓度为0.6mol/L,C的物质的量为0.6mol/L×2L=1.2mol,则
2A(g)+B(g)⇌2C(g)
开始 4 2 0
转化 1.2 0.6 1.2
2s 2.8 1.4 1.2
结合v=、转化率=×100%、c=计算.
【解答】解:经2s后测得C的浓度为0.6mol/L,C的物质的量为0.6mol/L×2L=1.2mol,则
2A(g)+B(g)⇌2C(g)
开始 4 2 0
转化 1.2 0.6 1.2
2s 2.8 1.4 1.2
①用物质A表示的反应平均速率为=0.3mol/(L•s),故正确;
②用物质B表示的反应的平均速率为=0.15mol/(L•s),故错误;
③2s时物质A的转化率为=30,故错误;
④2s时物质B的浓度为=0.7mol/L,故正确;
故选D.
二、解答题(共9小题,满分52分)
17.已知:下列两个热化学方程式:
Fe(s)+O2(g)═FeO(s)D△H=﹣272.0KJ/mol
2Al(s)+O2(g)═Al2O3(s)D△H=﹣1675.7KJ/mol
则 Al(s)的单质和FeO(s)反应的热化学方程式是 3FeO(s)+2Al(s)Al2O3(s)+3Fe(s)D△H=﹣859.7KJ/mol .
【考点】用盖斯定律进行有关反应热的计算.
【分析】依据题干热化学方程式结合盖斯定律写出该热化学反应方程式.
【解答】解:①Fe(s)+O2(g)=FeO(s)△H=﹣272.0kJ•mol﹣1
②2Al(s)+O2(g)=Al2O3(s)△H=﹣1675.7kJ•mol﹣1
将方程式②﹣①×3得2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=﹣859.7 kJ•mol﹣1,
故答案为:2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=﹣859.7 kJ•mol﹣1.
18.在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,则该反应的热化学方程式应为 CH3OH(l)+O2(g)=CO2(g)+2H2O(l)△H=﹣725.8KJ/mol .
【考点】热化学方程式.
【分析】在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,32g甲醇燃烧生成液态水和二氧化碳气体放热22.68KJ×32=725.8KJ,依据热化学方程式的书写方法和注意问题,标注对应反应的焓变写出.
【解答】解:在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,32g甲醇燃烧生成液态水和二氧化碳气体放热22.68KJ×32=725.8KJ,反应的热化学方程式为:CH3OH(l)+O2(g)=CO2(g)+2H2O(l)△H=﹣725.8KJ/mol;
故答案为:CH3OH(l)+O2(g)=CO2(g)+2H2O(l)△H=﹣725.8KJ/mol.
19.已知拆开1mol H﹣H键、1mol N﹣H键、1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为 N2(g)+3H2(g)=2NH3(g)△H=﹣92kJ•mol﹣1 .
【考点】热化学方程式.
【分析】化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热.
【解答】解:在反应N2+3H2⇌2NH3中,断裂3molH﹣H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N﹣H键,放出的能量为:6×391kJ=2346kJ,吸收的热量少,放出的热量多,该反应为放热反应,放出的热量为:2346kJ﹣2254kJ=92kJ;
故答案为:N2(g)+3H2(g)=2NH3(g)△H=﹣92kJ•mol﹣1.
20.对于下列反应:2SO2+O2 2SO3,如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为 2mol/(L•min) ,用O2
浓度变化来表示的反应速率为 1mol/(L•min) .如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L•min),那么2min时SO2的浓度为 2mol/L .
【考点】反应速率的定量表示方法;化学平衡的计算.
【分析】①根据化学反应速率公式计算;
②根据同一反应中,各物质的反应速率之比等于计量数之比计算;
③根据浓度的变化量与时间、反应速率的关系计算;
【解答】解:①v(SO2)==2mol/L.min;
②同一反应中,各物质的反应速率之比等于计量数之比,所以氧气的反应速率为二氧化硫的一半,所以是1mol/L.min;
③同一反应中,各物质的反应速率之比等于计量数之比,当氧气的反应速率为0.5 mol/(L•min)时,二氧化硫的反应速率为1mol/(L•min).
v(SO2)===1mol/(L•min),C2min=2mol/L
21.如图表示在密闭容器中反应:2SO2+O2⇌2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是 升温 ;b c过程中改变的条件可能是 减小生成物浓度 ; 若增大压强时,反应速度变化情况画在c~d处.
【考点】化学平衡的影响因素.
【分析】根据影响化学反应速率和化学平衡的条件可作判断;根据压强对化学反应速率的影响可画出相关的图.
【解答】解:根据图可知,在a时刻,正逆反应速率都增大,且逆反应速率大于正反应速率,即平衡逆向移动,因为反应的△H<0,根据影响化学反应速率和化学平衡的条件可知,a~b过程中改变的条件可能是升温;在b时刻,正反应速率不变,逆反应速率减小,且正反应速率大于逆反应速率,即平衡正向移动,根据影响化学反应速率和化学平衡的条件可知,b~c过程中改变的条件可能是减小生成物C的浓度;在b~c过程后,若增大压强,正逆反应速率都会增大,由于该反应为体积缩小的反应,所以平衡正向移动,根据压强对化学反应速率的影响可画出相关的图为:;
故答案为:升温;减小生成物的浓度;.
22.酶是蛋白质,具有蛋白质的特性,酶能催化很多化学反应,如图表示酶参加的反应中,温度与反应速率的关系,解释曲线变化原因 升高温度,增大反应速率,温度过高,使催化剂失去活性,反应速率减小 .
【考点】化学反应速率的影响因素.
【分析】酶作催化剂时,有一个最适宜温度,低于此温度,酶的催化效果不明显,高于此温度,酶易变性,以此解答该题.
【解答】解:升高温度,可增大反应速率,催化剂加快反应速率,但高温下酶发生变性,失去催化作用,反应速率减慢,
故答案为:升高温度,增大反应速率,温度过高,使催化剂失去活性,反应速率减小.
23.反应m A+n B⇌p C在某温度下达到平衡.
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是 m+n>P .
②若在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为 气 态.
【考点】化学平衡的影响因素.
【分析】①根据影响化学平衡因素结合速率大小分析判断反应前后的体积变化,减压后平衡向体积增大的方向移动;
②反应前后系数相同,改变压强平衡移动说明反应物中含有固体或纯液体.
【解答】解:①反应mA+nB⇌pC,若A、B、C都是气体,减压后正反应速率小于逆反应速率,证明逆向反应是气体体积增大的反应,得到m+n>p,
故答案为:m+n>p;
②若反应mA+nB⇌pC;如果在体系中增加或减少B的量,平衡均不发生移动,证明B一定是固体或纯液体,不是气体,
故答案为:气.
24.有两只密闭容器A和B,A能保持恒压,B能保持恒容.起始时向容积相等的A、B中分别通入体积比为2:1的等量的SO2和O2,使之发生反应:2SO2+O2⇌2SO3,并达到平衡.则(填“>”、“=”、“<”;“左”、“右”;“增大”、“减小”、“不变”).
(1)达到平衡所需要的时间:t(A) < t(B),SO2的转化率:a(A) > a (B)
(2)起始时两容器中的反应速率:v(A) ═ v(B),反应过程中的反应速率:v(A) > v(B).
(3)达到平衡时,在两容器中分别通入等量的Ar气.A中的化学平衡向 左 反应方向移动,B中的化学反应速率 不变 .
(4)达到平衡后,向两容器中分别通入等量的原反应气体,再次达到平衡时,A容器中SO2的质量分数 不变 ,B容器中SO2的质量分数 降低 .
【考点】化学平衡的计算;化学反应速率的影响因素;化学平衡的影响因素.
【分析】(1)A能保持恒压,B能保持恒容.起始时向容积相等的A、B中分别通入体积比为2:1的等量的SO2和O2,使之发生反应:2SO2+O2⇌2SO3,恒温恒容随反应进行压强减小速率减慢,恒温恒压容器中反应过程中压强增大,反应速率大;转化率大;
(2)起始二氧化硫和氧气浓度相同,反应速率相同;过程中A容器中的压强大于B容器反应速率大;
(3)恒温恒容容器加入惰气总压增大,分压不变,平衡不动,反应速率不变;恒温恒压容器,加入惰气压强减小,平衡向气体体积增大的方向进行;
(4)恒温恒压容器加入等量原反应物,最后达到相同平衡状态;恒温恒容容器,加入原反应物压强增大,平衡正向进行;
【解答】解:(1)A能保持恒压,B能保持恒容.起始时向容积相等的A、B中分别通入体积比为2:1的等量的SO2和O2,使之发生反应:2SO2+O2⇌2SO3,恒温恒容随反应进行压强减小速率减慢,恒温恒压容器A中反应过程中压强不变,反应速率比恒容容器中大;转化率大;所以达到平衡所需要的时间A小于B,SO2的转化率A大于B;
故答案为:<;>;
(2)起始二氧化硫和氧气浓度相同,反应速率相同;过程中A为恒温恒压容器中的压强大于B恒温恒容容器中的反应速率大;
故答案为:═;>;
(3)恒温恒容B容器加入惰气总压增大,分压不变,平衡不动,反应速率不变;恒温恒压A容器,加入惰气压强减小,平衡向气体体积增大的方向进行,反应是气体体积减小的反应,所以平衡逆向进行;
故答案为:左;不变;
(4)恒温恒压容器A中加入等量原反应物,最后达到相同平衡状态物质的质量分数不变;恒温恒容容器B,加入原反应物压强增大,平衡正向进行,二氧化硫质量分数减小;
故答案为:不变;降低.
25.已知下表中的四个热化学方程式,
嫦娥一号
液氢(H2)
①2H2(g)+O2(g)=2H2O(l)△H=﹣571.6kJ•mol﹣1
②2H2(l)+O2(l)=2H2O(g)△H=﹣482.6kJ•mol﹣1
祥云火炬
丙烷
(C3H8)
③C3H8(l)+5O2(g)=3CO2(g)+4H2O(g)△H=﹣2013.8kJ•mol﹣1
④C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=﹣2221.5kJ•mol﹣1
(1)氢气的燃烧热是 285.8 kJ•mol﹣1 ,丙烷的燃烧热是 2221.5 kJ•mol﹣1 .
(2)氢气作为燃料的主要优点是 燃烧热值高,燃烧产物不污染环境 .
【考点】燃烧热.
【分析】(1)1mol可燃物完全燃烧生成稳定氧化物放出的热量为燃烧热,结合热化学方程式分析判断和计算燃烧热进行判断;
(2)根据燃烧热值高低结合产物有无污染环境判断.
【解答】解:(1)由①2H2(g)+O2(g)=2H2O(l)△H=﹣571.6kJ•mol﹣1 ,热化学方程式是2mol氢气燃烧生成稳定氧化物的反应,则氢气的燃烧热是=285.8kJ•mol﹣1,
②2H2(l)+O2(l)=2H2O(g)△H=﹣482.6kJ•mol﹣1,热化学方程式生成的是气体水,不是稳定氧化物,不能据此计算;
③C3H8(l)+5O2(g)=3CO2(g)+4H2O(g)△H=﹣2013.8kJ•mol﹣1,反应生成的水是气体,不是稳定氧化物,不能据此计算;
④C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=﹣2221.5kJ•mol﹣1,是1mol丙烷完全燃烧生成稳定氧化物放热为燃烧热即为2221.5kJ•mol﹣1;
故答案为:285.8 kJ•mol﹣1;2221.5 kJ•mol﹣1;
(2)根据(1)得出氢气的燃烧热是285.8kJ•mol﹣1,则氢气的燃烧热值为=142.9KJ/g,丙烷燃烧热为2221.5kJ•mol﹣1,则丙烷燃烧热值为=50.49KJ/g,所以氢气作为燃料的主要优点是燃烧热值高,燃烧产物不污染环境,
故答案为:燃烧热值高,燃烧产物不污染环境.