- 510.50 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第2课时 化学反应的限度
[学习目标] 1.知道化学反应的限度、可逆反应和化学平衡的含义,认识当一定的外界条件改变时化学反应限度可能发生改变。2.认识化学平衡的特征,会判断化学平衡状态,会分析判断化学平衡的移动。
一、化学反应的限度
[自主学习]
1.可逆反应
(1)定义:在相同条件下同时向正、反两个方向进行的反应。
(2)表示方法:书写可逆反应的化学方程式时不用“===”而用“”。
(3)特点
①正向反应和逆向反应同时进行。
②正向反应和逆向反应的条件相同。
③在一定条件下,反应物不可能全部转化为生成物,反应只能进行到一定的程度,即化学反应的限度。
2.化学平衡
(1)化学平衡状态的概念:在一定条件下可逆反应进行到一定程度时,反应物的浓度与生成物的浓度不再随时间的延长而发生变化,正反应速率与逆反应速率相等,这种状态称为化学平衡状态,简称化学平衡。
(2)化学平衡状态的特征:
1.在密闭容器中充入2 mol SO2和1 mol O2,在一定条件下发生反应2SO2(g)+O2(g)
- 8 -
2SO3(g),当充分反应后,最终容器中能否得到2 mol SO3?
提示:不能。因为可逆反应不能进行彻底。
2.在密闭容器中进行反应2SO2(g)+O2(g)2SO3(g),当SO2、O2、SO3的浓度之比为2∶1∶2时能否说明该反应达到化学平衡状态?
提示:不能。因为不能说明各组分的浓度一定不变。也不能说明该反应的正、逆反应速率相等。
[点拨提升]
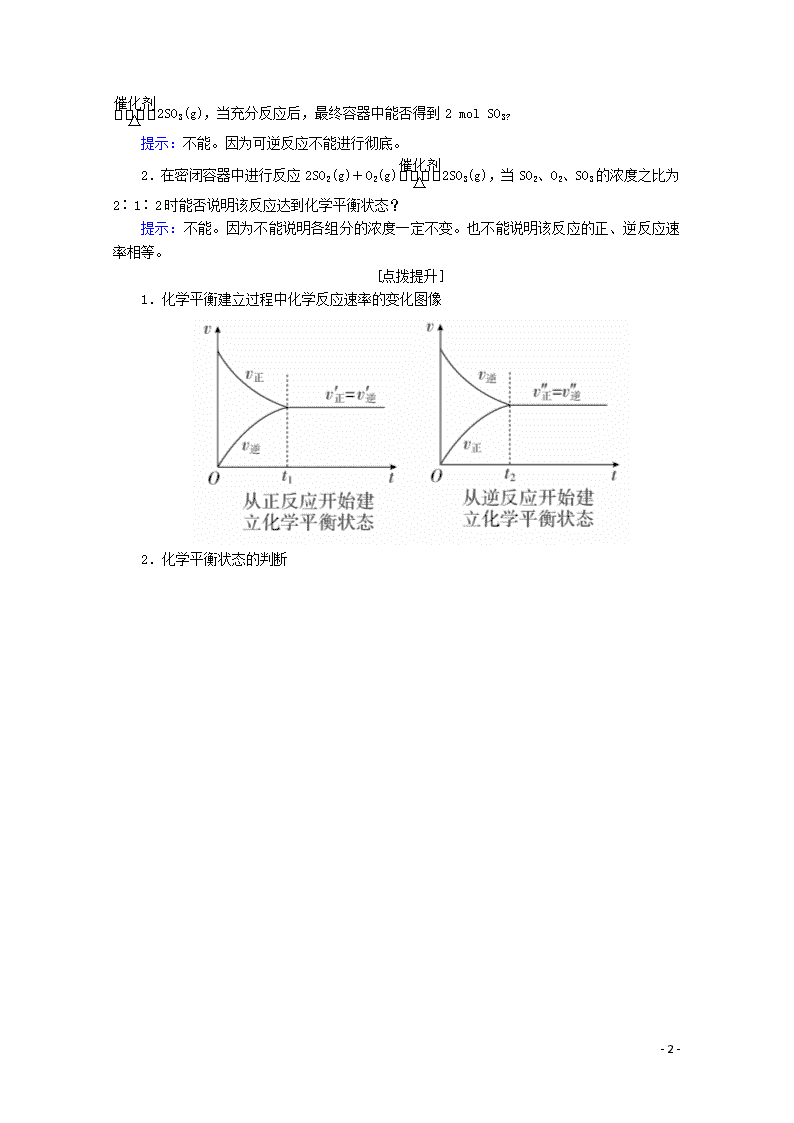
1.化学平衡建立过程中化学反应速率的变化图像
2.化学平衡状态的判断
- 8 -
- 8 -
[练习与活动]
1.在密闭容器中进行反应:2SO2(g)+O2(g)2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1。当反应达到平衡时,可能存在的数据是( )
A.SO2为0.4 mol·L-1,O2为0.2 mol·L-1
B.SO2为0.25 mol·L-1
C.SO2、SO3均为0.15 mol·L-1
D.SO3为0.4 mol·L-1
答案 B
解析 该反应为可逆反应,当SO2和O2完全转化为SO3时,c(SO2)=c(O2)=0,c(SO3)=0.4 mol·L-1;当SO3完全转化为SO2和O2时,c(SO3)=0,c(SO2)=0.4 mol·L-1,c(O2)=0.2 mol·L-1。根据可逆反应的特点:可逆反应不可能进行到底,故平衡时,0v逆⇒平衡正向移动。
(2)v正