- 871.00 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
温馨提示:
此套题为Word版,请按住Ctrl,滑动鼠标滚轴,调节合适的观看比例,答案解析附后。关闭Word文档返回原板块。
高考热点突破微课16
溶液中粒子浓度的比较
一、三大守恒
1.物料守恒(原子守恒)
在电解质溶液中,由于某些离子能够水解,粒子种类增多,但这些粒子所含某些原子的总数始终不变,符合原子守恒。如NaHCO3溶液中,n(Na+)∶n(C)=1∶1,因HC水解:HC+H2OH2CO3+OH-以及HC电离:HCH++C,碳元素的存在形式有3种,即HC、H2CO3、C,由n(Na+)∶n(C)=1∶1,得c(Na+)=c(HC)
+c(C)+c(H2CO3)。
2.电荷守恒
在电解质溶液中,阳离子的电荷总数与阴离子的电荷总数相等,即溶液呈电中性。如NaHCO3溶液中有Na+、H+、HC、C、OH-,存在如下关系:n(Na+)+
n(H+)=n(HC)+2n(C)+n(OH-),推出c(Na+)+c(H+)=c(HC)+2c(C)+
c(OH-)。(因C带2个单位负电荷,所以其所带电荷数为其离子数的2倍)
3.质子守恒
电解质溶液中,电离、水解等过程中得到的质子(H+)数等于失去的质子(H+)数。如NaHCO3溶液中:
即有c(H+)+c(H2CO3)=c(OH-)+c(C)
另外,质子守恒式可以由电荷守恒式和物料守恒式推导得出。
以KHS溶液为例,电荷守恒式为c(K+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)①,物料守恒式为c(K+)=c(HS-)+c(S2-)+c(H2S)②,由①-②消去没有参与变化的K+得质子守恒式c(H+)+c(H2S)=c(OH-)+c(S2-)。
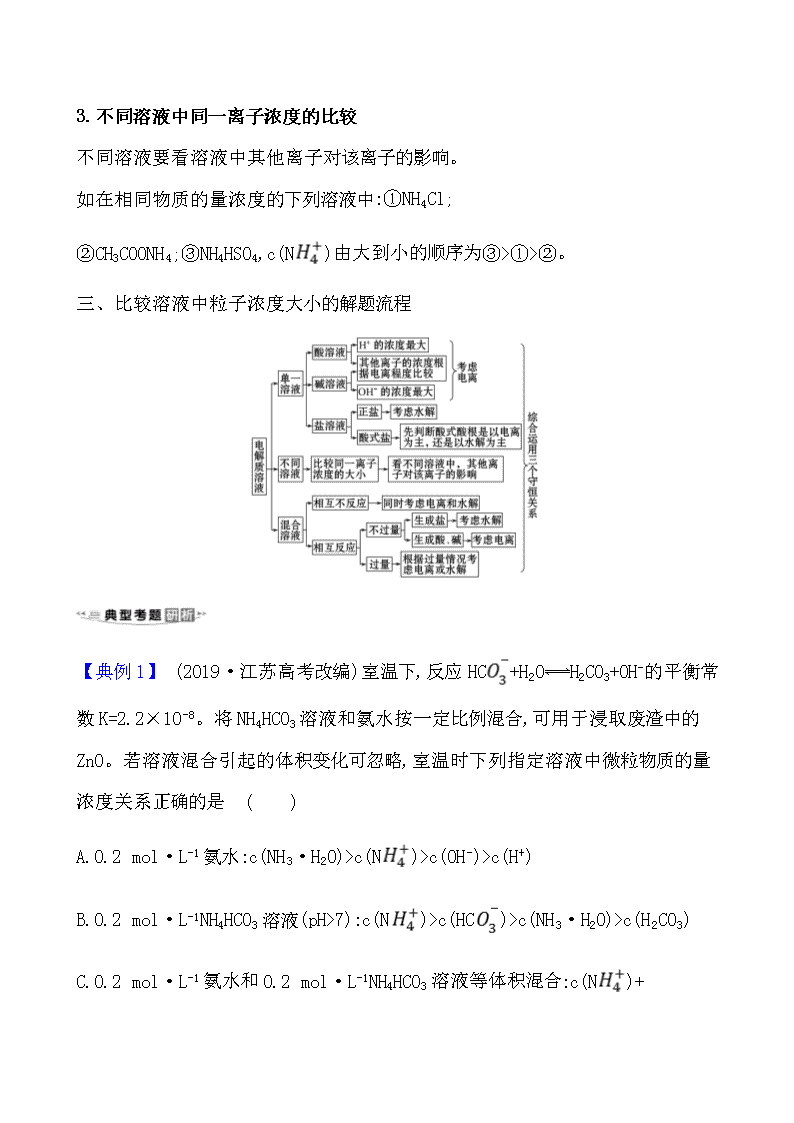
二、比较溶液中粒子浓度大小的三大类型
1.单一溶液中各离子浓度的比较
(1)多元弱酸溶液:多元弱酸分步电离,电离程度逐级减弱。如H3PO4溶液中:c(H+)>c(H2P)>c(HP)>c(P)。
(2)多元弱酸的正盐溶液:多元弱酸的酸根离子分步水解,水解程度逐级减弱。如在Na2CO3溶液中:c(Na+)>c(C)>c(OH-)>c(HC)。
2.混合溶液中各离子浓度的比较
混合溶液要综合分析电离、水解等因素。如在0.1 mol·L-1NH4Cl溶液和0.1 mol·L-1的氨水混合溶液中,各离子浓度大小的顺序为c(N)>c(Cl-)>c(OH-)>c(H+)。
3.不同溶液中同一离子浓度的比较
不同溶液要看溶液中其他离子对该离子的影响。
如在相同物质的量浓度的下列溶液中:①NH4Cl;
②CH3COONH4;③NH4HSO4,c(N)由大到小的顺序为③>①>②。
三、比较溶液中粒子浓度大小的解题流程
【典例1】 (2019·江苏高考改编)室温下,反应HC+H2OH2CO3+OH-的平衡常数K=2.2×10-8。将NH4HCO3溶液和氨水按一定比例混合,可用于浸取废渣中的ZnO。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是 ( )
A.0.2 mol·L-1氨水:c(NH3·H2O)>c(N)>c(OH-)>c(H+)
B.0.2 mol·L-1NH4HCO3溶液(pH>7):c(N)>c(HC)>c(NH3·H2O)>c(H2CO3)
C.0.2 mol·L-1氨水和0.2 mol·L-1NH4HCO3溶液等体积混合:c(N)+
c(NH3·H2O)=c(H2CO3)+c(HC)+c(C)
D.0.6 mol·L-1氨水和0.2 mol·L-1NH4HCO3溶液等体积混合:c(NH3·H2O)
+c(C)+c(OH-)=0.3 mol·L-1+c(H2CO3)+c(H+)
【解析】选D。A项,氨水中存在:NH3·H2ON+OH-,H2OH++OH-,氨水中NH3·H2O的电离是少量的,所以主要以NH3·H2O分子存在,两个电离方程式中均有OH-,所以c(OH-)>c(N),错误;B项,NH4HCO3溶液显碱性,说明HC的水解程度大于N的水解,所以c(N)>c(HC),HC水解:HC+H2OH2CO3+OH-,N水解:N+H2ONH3·H2O+H+,前者水解程度大,则c(H2CO3) >c(NH3·H2O),错误;C项,由物料守恒,n(N)∶n(C) =2∶1,则有c(N)+c(NH3·H2O)=2[c(H2CO3) +
c(HC)+c(C)],错误;D项,由物料守恒,n(N)∶n(C)=4∶1,则有c(N)
+c(NH3·H2O)= 4[c(H2CO3)+c(HC)+c(C)]①,由电荷守恒:c(N)+c(H+)
=c(HC)+2c(C)+c(OH-)②,结合①②消去c(N),得:c(NH3·H2O)+c(OH-)
=c(H+)+4c(H2CO3)+3c(HC)+2c(C)③,0.2 mol·L-1NH4HCO3与氨水等体积混合后,c(NH4HCO3)=0.1 mol·L-1,由碳原子守恒有,c(H2CO3)+c(HC)+c(C)=
0.1 mol·L-1④,将③等式两边各加一个c(C),则有c(NH3·H2O) +c(OH-) +c(C)=c(H+)+c(H2CO3)+3c(H2CO3)+3c(HC)+3c(C)⑤,将④代入⑤中得,c(NH3·H2O)+c(OH-)+c(C)=c(H+)+c(H2CO3)+0.3 mol·L-1,正确。
【典例2】用0.1 mol·L-1 NaOH溶液分别滴定体积均为20 mL、浓度均为0.1 mol·L-1的HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图。下列说法中正确的是 ( )
A.HX为强酸
B.M点c(HX)(X-)且有c(Na+)=c(X-)+c(HX)
D.P点c(Cl-)=0.05 mol·L-1
【解析】选C。A项,根据图象知,滴定开始时HCl的浓度为0.1 mol·L-1,pH=1,完全电离为强酸,则HCl的滴定曲线为含P点的曲线,那么含M、N点的曲线为HX的滴定曲线,0.1 mol·L-1的HX溶液的pH=5,说明HX部分电离,为弱酸,错误;B项,M点NaOH溶液V=10.00 mL,溶液中的溶质为等浓度的NaX和HX混合溶液,pH>7溶液呈碱性,说明水解大于电离,即M点c(HX)>c(X-),错误;C项,N点NaOH溶液V=20.00 mL,溶液中的溶质为NaX,X在溶液中存在形式有:HX、X-,
根据物料守恒得c(Na+)=c(HX)+c(X-),正确;D项,P点c(Cl-)==0.067 (mol·L-1),错误。
1.(双选)下列说法正确的是 ( )
A.常温下,pH为1的0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液恰好完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+)
B.相同浓度的CH3COONa和NaClO溶液混合后,溶液中各离子浓度的大小关系为c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
C.pH=1的NaHSO4溶液中c (H+)=2 c (S)+ c (OH-)
D.常温下,pH=7的CH3COONa和CH3COOH混合溶液中:c (CH3COO-)=c(Na+)>
c (CH3COOH) >c (H+)=c (OH-)
【解析】A、D。常温下,pH为1的0.1 mol·L-1 HA溶液中,c(H+)=0.1 mol·L-1,则HA为强酸溶液,与0.1 mol·L-1 NaOH溶液恰好完全反应时,溶液中溶质为强电解质NaA,c(Na+)=c(A-),溶液呈中性,c(OH-)和 c(H+)来自水且c(OH-)=c(H+) ,故A正确;相同浓度时酸性:CH3COOH>HClO,即CH3COOH电离程度大于HClO,即c(CH3COO-)> c(ClO-);相同浓度的CH3COONa和NaClO溶液混合后,水解程度:
CH3COONa c(ClO-),故B错误;pH=1的NaHSO4溶液中含有Na+、S、H+、OH-,电荷守恒式为c(Na+)+c (H+)=2c (S)+c (OH-),故C错误;pH=7,溶液呈中性,c (H+) =c (OH-),则(CH3COO-)=c(Na+),CH3COONa和CH3COOH混合溶液,c (CH3COO-) > c (CH3COOH),溶液中各离子浓度的大小关系为
c (CH3COO-)=c(Na+)> c (CH3COOH)>c (H+) = c (OH-),故D正确。
2.25℃时,分别向20.00 mL 0.100 0 mol·L-1的氨水、醋酸铵溶液中滴加
0.100 0 mol·L-1的盐酸,溶液pH与加入盐酸体积的变化关系如图所示。下列说法正确的是 ( )
A.M点溶液中:c(OH-)>c(N)>c(NH3·H2O)>c(H+)
B.N点溶液中:c(N)>c(Cl-)>c(NH3·H2O)>c(OH-)
C.P点溶液中:c(N)>2c(CH3COO-)+c(NH3·H2O)
D.Q点溶液中:2c(Cl-)=c(CH3COOH)+c(N)
【解析】选B。一水合氨是弱电解质,电离程度较小,一水合氨电离导致溶液呈碱性,水还电离出氢氧根离子,则存在c(NH3·H2O)>c(OH-)>c(N)>c(H+),故A错误;N点溶液中溶质为等物质的量浓度的一水合氨、氯化铵,混合溶液呈碱性,说明一水合氨电离程度大于铵根离子水解程度,但是其电离和水解程度都较小,则存在c(N)>c(Cl-)>c(NH3·H2O)>c(OH-),故B正确;P点溶液中溶质为等物质的量浓度的氯化铵、醋酸铵和醋酸,溶液中存在物料守恒c(N)+c(NH3·H2O)
=c(CH3COO-)+c(CH3COOH)=2c(Cl-),存在电荷守恒c(N)+c(H+)=c(CH3COO-)+
c(Cl-)+c(OH-),溶液呈酸性,则c(H+)>c(OH-),c(N)⑤>③>④>①
B.c(HC)的大小关系为:④>③>⑤>②>①
C.将溶液蒸干灼烧只有①不能得到对应的固体物质
D.②③④⑤既能与盐酸反应,又能与NaOH溶液反应
【解析】选A。由于④中N与HC互相促进水解,故c(HC):③>④,c(C)也是:③>④,B错误;将各溶液蒸干后①③④⑤都分解,得不到原来的物质,C错误;Na2CO3只能与盐酸反应,而与NaOH溶液不反应,D错误;A项:N与C水解相互促进,c(C):②>⑤,HC既水解又电离,水解程度大于电离程度,
c(C):③④<②⑤,H2CO3是弱酸,二级电离Ka2很小,H2CO3中的c(C)最小。
2.25 ℃时,向10 mL 0.10 mol·L-1的一元弱酸HA(Ka=1.0×10-3)中逐滴加入
0.10 mol·L-1NaOH溶液,溶液pH随加入NaOH溶液体积的变化关系如图所示。下列说法正确的是 ( )
A.a点时,c(HA)+c(OH-)=c(Na+)+c(H+)
B.溶液在a点和b点时水的电离程度相同
C.b点时,c(Na+)=c(HA)+c(A-)+c(OH-)
D.V=10 mL时,c(Na+)>c(A-)>c(H+)>c(HA)
【解析】选A。A项中a点pH=pKa=3,所以c(A-)=c(HA),根据电荷守恒,可知A项正确;B项,a点溶质为HA、NaA,水电离c(OH-)=10-11,b点溶质为NaOH、NaA,水电离c(H+)>10-11;C项,根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(A-),可知c(Na+)<
c(OH-)+c(A-),故C错误;加入NaOH溶液V=10 mL时,恰好完全反应生成NaA,A-水解,溶液呈碱性,则有c(Na+)>c(A-)>c(OH-)>c(HA)>c(H+),D项错误。
关闭Word文档返回原板块
相关文档
- 化学名师讲练大一轮复习方略人教通2021-07-027页
- 2021版化学名师讲练大一轮复习鲁科2021-07-021页
- 化学名师讲练大一轮复习方略人教通2021-07-0210页
- 2021版化学名师讲练大一轮复习鲁科2021-07-029页
- 2021版化学名师讲练大一轮复习鲁科2021-07-023页
- 2021版化学名师讲练大一轮复习鲁科2021-07-022页
- 2021版化学名师讲练大一轮复习鲁科2021-07-027页
- 2021版化学名师讲练大一轮复习鲁科2021-07-027页
- 2021版化学名师讲练大一轮复习鲁科2021-07-027页
- 化学名师讲练大一轮复习方略人教通2021-07-022页