- 201.50 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
湘西自治州2018年下学期高二年级12月四校联考
化学试题
命题:廖小芳 审题:泸溪一中 高一化学备课组
时间:90分钟 总分:100分
相对原子质量:H-1 Zn- 65 Cu- 64 Fe -56 Mg- 24 Al -27 S- 32 O- 16 C -12
一、选择题(每小题只有一个选项符合题意,每小题3分,共48分)
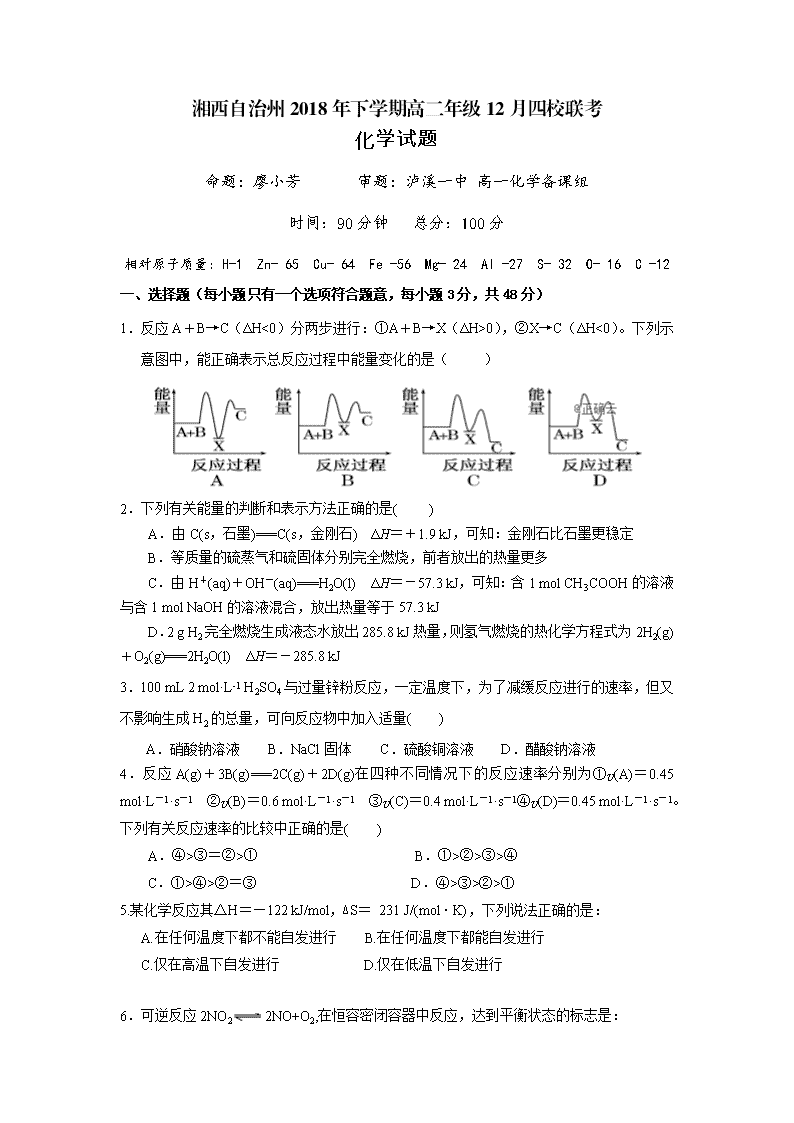
1.反应A+B→C(ΔH<0)分两步进行:①A+B→X(ΔH>0),②X→C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是( )
2.下列有关能量的判断和表示方法正确的是( )
A.由C(s,石墨)===C(s,金刚石) ΔH=+1.9 kJ,可知:金刚石比石墨更稳定
B.等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量更多
C.由H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ,可知:含1 mol CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量等于57.3 kJ
D.2 g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)===2H2O(l) ΔH=-285.8 kJ
3.100 mL 2 mol·L-1 H2SO4与过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成H2的总量,可向反应物中加入适量( )
A.硝酸钠溶液 B.NaCl固体 C.硫酸铜溶液 D.醋酸钠溶液
4.反应A(g)+3B(g)===2C(g)+2D(g)在四种不同情况下的反应速率分别为①v(A)=0.45 mol·L-1·s-1 ②v(B)=0.6 mol·L-1·s-1 ③v(C)=0.4 mol·L-1·s-1④v(D)=0.45 mol·L-1·s-1。下列有关反应速率的比较中正确的是( )
A.④>③=②>① B.①>②>③>④
C.①>④>②=③ D.④>③>②>①
5.某化学反应其△H=—122 kJ/mol,∆S= 231 J/(mol·K),下列说法正确的是:
A.在任何温度下都不能自发进行 B.在任何温度下都能自发进行
C.仅在高温下自发进行 D.仅在低温下自发进行
6.可逆反应2NO22NO+O2,在恒容密闭容器中反应,达到平衡状态的标志是:
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2的同时生成2n mol NO
③NO2、NO、O2 的反应速率的比为2 : 2 : 1的状态
④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态
A.①④ B.②③⑤ C.①③④ D.①②③④⑤
7、下列事实不能用勒夏特列原理解释的是:
A. 黄绿色的氯水光照后颜色变浅 B. 温度过高对合成氨不利
C. 由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
D. 溴水中有平衡:Br2+ H2OHBr+ HBrO,当加入AgNO3溶液后,溶液颜色变浅
8.可逆反应mA(g)+nB(s)pC(g)+qD(g),在反应过程中,当其他条件不变时,D的百分含量与温度(T)和压强(P)的关系如图所示,判断下列叙述中不正确的是:
A.达到平衡后,升高温度,平衡向逆反应方向移动
B.达到平衡后,若使用催化剂,D的物质的量分数不变
C.化学方程式中一定有m<p+q
D.平衡后增大B的量,有利于平衡向正反应方向移动
9、在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的体积扩大两倍,测得A的浓度变为0.35 mol/L,下列有关判断正确的是:
A. x+y<z B. 平衡正向移动 C. A的转化率降低 D. C的体积分数升高
10.某温度下,H2(g)+CO2(g)H2O(g)+CO(g)的平衡常数K=,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示,
起始浓度
甲
乙
丙
c(H2)(mol/L)
0.010
0.020
0.020
c(CO2)(mol/L)
0.010
0.010
0.020
下列判断不正确的是:
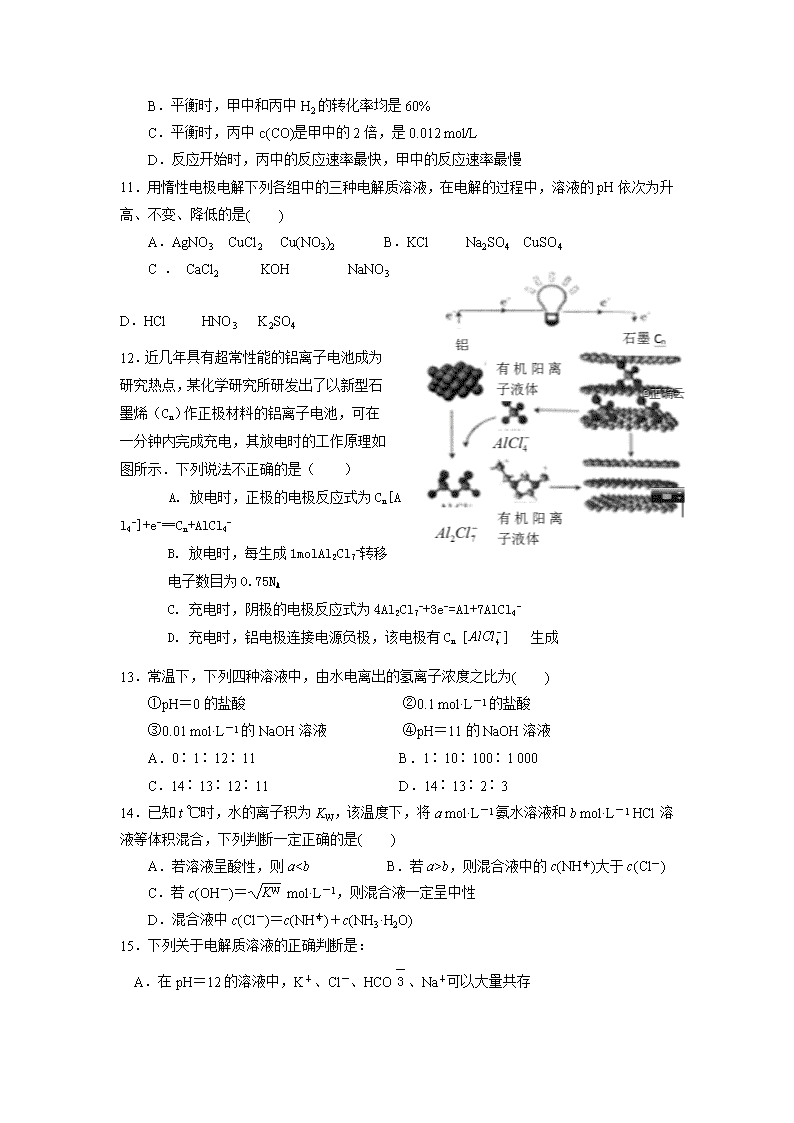
A.平衡时,乙中H2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO)是甲中的2倍,是0.012 mol/L
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
11.用惰性电极电解下列各组中的三种电解质溶液,在电解的过程中,溶液的pH依次为升高、不变、降低的是( )
A.AgNO3 CuCl2 Cu(NO3)2 B.KCl Na2SO4 CuSO4
C.CaCl2 KOH NaNO3 D.HCl HNO3 K2SO4
12.近几年具有超常性能的铝离子电池成为研究热点,某化学研究所研发出了以新型石墨烯(Cn)作正极材料的铝离子电池,可在一分钟内完成充电,其放电时的工作原理如图所示.下列说法不正确的是( )
A. 放电时,正极的电极反应式为Cn[AlCl4-]+e-═Cn+AlCl4-
B. 放电时,每生成1molAl2Cl7-转移电子数目为0.75NA
C. 充电时,阴极的电极反应式为4Al2Cl7-+3e-=Al+7AlCl4-
D. 充电时,铝电极连接电源负极,该电极有Cn 生成
13.常温下,下列四种溶液中,由水电离出的氢离子浓度之比为( )
①pH=0的盐酸 ②0.1 mol·L-1的盐酸
③0.01 mol·L-1的NaOH溶液 ④pH=11的NaOH溶液
A.0∶1∶12∶11 B.1∶10∶100∶1 000
C.14∶13∶12∶11 D.14∶13∶2∶3
14.已知t ℃时,水的离子积为KW,该温度下,将a mol·L-1氨水溶液和b mol·L-1 HCl溶液等体积混合,下列判断一定正确的是( )
A.若溶液呈酸性,则ab,则混合液中的c(NH)大于c(Cl-)
C.若c(OH-)= mol·L-1,则混合液一定呈中性
D.混合液中c(Cl-)=c(NH)+c(NH3·H2O)
15.下列关于电解质溶液的正确判断是:
A.在pH=12的溶液中,K+、Cl-、HCO、Na+可以大量共存
B.在pH=0的溶液中,Na+、NO、SO、K+可以大量共存
C.由0.1 mol/L一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH===B++OH-
D.由0.1 mol/L一元酸HA溶液的pH=3,可推知NaA溶液存在A-+H2OHA+OH-
16.常温下,浓度均为0.1 mol·L-1、体积均为V0的HX和HY溶液,分别加水稀释至体积V,AG随lg 的变化如图所示。下列叙述正确的是( )
A.相同条件下NaX溶液的pH大于NaY溶液的pH
B.水的电离程度:a=bp2)的关系曲线。
图(a)
(3) 工业上常采用除杂效率高的吸收-电解联合法,除去天然气中杂质气体H2S,并转化为可回收利用的单质硫,其装置如下图所示。
通电前,先通入一段时间含H2S的甲烷气,使部分NaOH吸收H2S转化为Na2S,再接通电源,继续通入含杂质的甲烷气,并控制好通气速率。则装置中右端碳棒为 极,左端碳棒上的电级反应为 ,右池中的c(NaOH):c(Na2S) (填“增大”、“ 基本不变”或“减小)。
(4)已知:HCN的电离常数Ka=4.9×10-10,H2S的电离常数Ka1=1.3×10−7,Ka2=7.0×10−15,向NaCN溶液中通入少量的H2S气体,反应的化学方程式为 。
在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.0020 mol·L−1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS−浓度为1.0×10−4 mol·L−1时,Mn2+开始沉淀,则a= 。[已知:Ksp(MnS)=1.4×10−15]
湘西州2018年下学期高二年级十二月联考化学答案
一、选择题(每小题3分,共16小题,共48分)
题号
1
2
3
4
5
6
7
8
9
答案
D
B
D
C
B
A
C
D
C
题号
10
11
12
13
14
15
16
答案
A
B
D
B
C
D
B
二、非选择题(共5题,共52分)
17.(每空1分,共6分)
(1) ⑤ > ④ > ② > ③ > ① ; ① > ③ > ② > ⑤ > ④
(2)= >
(3) c(HSO3-)+ 2c(SO32-)+ c(OH-) 0.1mol/L
18.(共8分)⑴ 2CH3OHCH3OCH3+H2O (1分)
⑵> (1分)
⑶①> (1分) ②A (1分); < (1分); 温度升高,化学反应速率加快(1分)
⑷a e(2分)
19、(每空2分,共12分)
(1)①氧化 2Fe3++2e-=2Fe2+
②正、I2+2e-=2I-
(2) 2Cu2++2H2O=2Cu+O2+4H+ 0.7;
20.(每空2分,共12分)
(1)c(K+)> c (HC2O4—)> c (H+)> c (C2O42—)> c (OH—)
(2)5H2C2O4 + 2MnO4- + 6H+= 10CO2↑ + 2Mn2+ + 8H2O;
溶液由无色变成紫红色;
(3)10 (4) 能
21(共14分)
(1)2CH4(g)C2H4(g)+2H2(g) ΔH=+202.5 kJ/mol (2分)
(2)0.25 (2分) (2分)
(3) 阳(1分)2H2O+2e-=2OH-+H2↑或2H++2e-=H2↑(1分)基本不变(2分)
(4) NaCN+H2S=HCN+NaHS (2分) 6(2分)