- 284.50 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
安阳市第二中学2018-2019学年第一学期期中考试高一化学
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Cu 64
第I卷(选择题)
一、单选题
1.朱自清先生在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里…月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影…”月光穿过薄雾所形成的种种美景的本质原因是
A. 雾是一种胶体 B. 光是一种胶体
C. 空气中的小水滴颗粒大小约为10﹣9m~10﹣7m D. 发生丁达尔效应
【答案】C
【解析】
A、雾是一种胶体,但这不是月光穿过薄雾所形成的种种美景的本质原因,A错误;B、雾是一种胶体,光不是,B错误;C、题干中所提及的雾,是空气中的小液滴,是一种胶体,本质特征是分散质粒子的直径在1~100nm,即10-9m~10-7m,C正确;D、雾作为一种胶体,确实能发生丁达尔效应,但这也不是月光穿过薄雾所形成的种种美景的本质原因,D错误,答案选C。
2.化学与生活、社会发展息息相关,下列说法不正确的是
A. “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
B. “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
C. “青蒿一握,以水二升渍,绞取汁”,诗句中体现的屠呦呦对青蒿素的提取属于化学变化
D. “春蚕到死丝方尽,蜡炬成灰泪始干” 诗句中涉及氧化还原反应
【答案】C
【解析】
【详解】A.雾霾所形成的气溶胶属于胶体,具有丁达尔效应,所以A选项是正确的;
B.铁置换铜属于湿法炼铜,该过程发生了置换反应,所以B选项是正确的;
C.对青蒿素的提取利用的是萃取原理,萃取过程中没有新物质生成,属于物理变化,故C错误;
D.石蜡的燃烧是氧化还原反应,所以D选项是正确的.
综上所述,本题应选C。
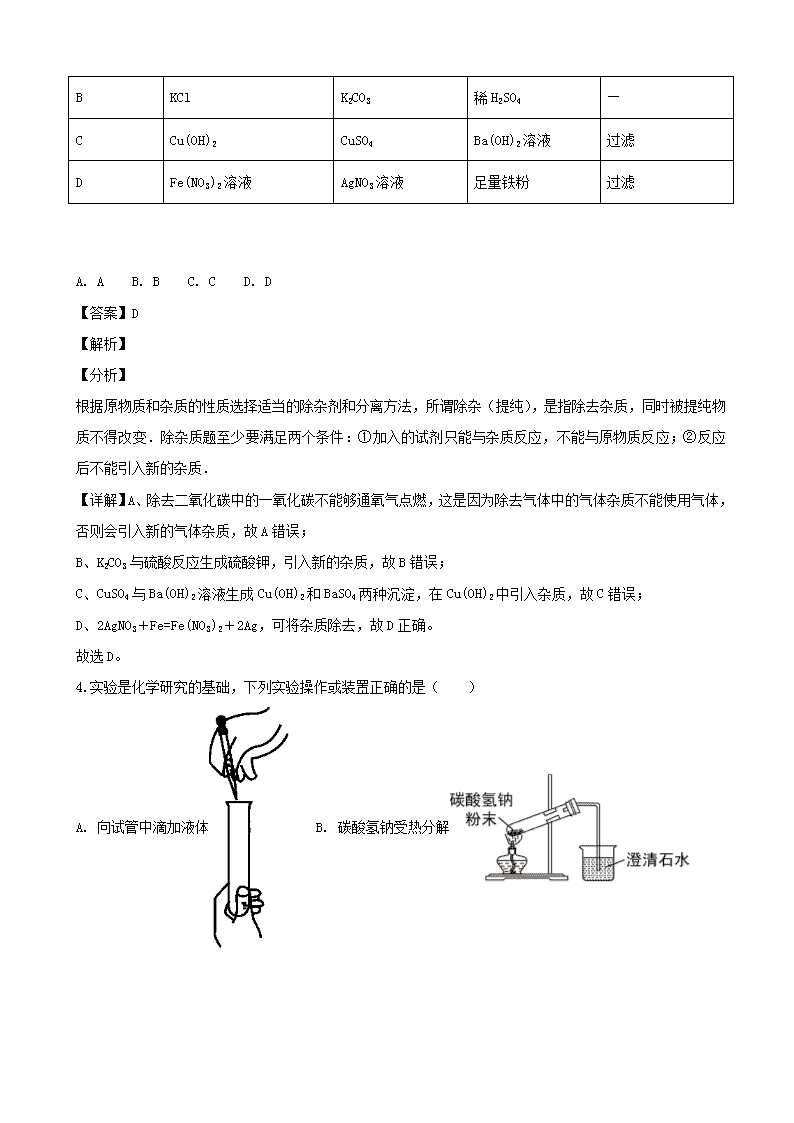
3.下列除杂试剂及操作正确的是( )
物质
所含杂质
除杂试剂
除杂操作
A
CO2
CO
O2
加热
B
KCl
K2CO3
稀H2SO4
—
C
Cu(OH)2
CuSO4
Ba(OH)2溶液
过滤
D
Fe(NO3)2溶液
AgNO3溶液
足量铁粉
过滤
A. A B. B C. C D. D
【答案】D
【解析】
【分析】
根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
【详解】A、除去二氧化碳中的一氧化碳不能够通氧气点燃,这是因为除去气体中的气体杂质不能使用气体,否则会引入新的气体杂质,故A错误;
B、K2CO3与硫酸反应生成硫酸钾,引入新的杂质,故B错误;
C、CuSO4与Ba(OH)2溶液生成Cu(OH)2和BaSO4两种沉淀,在Cu(OH)2中引入杂质,故C错误;
D、2AgNO3+Fe=Fe(NO3)2+2Ag,可将杂质除去,故D正确。
故选D。
4.实验是化学研究的基础,下列实验操作或装置正确的是( )
A. 向试管中滴加液体 B. 碳酸氢钠受热分解
C. 除去CO气体中的CO2气体 D. 过滤
【答案】C
【解析】
【分析】
A.胶头滴管不能伸入试管中;
B.碳酸氢钠分解生成水,试管口要向下倾斜,防止生成的水会倒流;
C.除杂时,气体从长导管进入;
D.过滤需要引流.
【详解】A.胶头滴管不能伸入试管中,防止污染试剂,应悬空正放在试管上方,故A错误;
B.碳酸氢钠分解生成水,试管口要向下倾斜,防止生成的水会倒流,则试管口应略向下倾斜,故B错误;
C.除杂时,气体从长导管进入,且CO不与NaOH溶液反应,除杂合理,故C正确;
D.过滤需要引流,图中缺少玻璃棒,故D错误;
故选C。
【点睛】本题考查化学实验方案的评价,解题关键:掌握实验基本操作、除杂、过滤及性质实验等,易错点B,要理解用试管加热固体的原理。
5.化学实验的基本操作是完成化学实验的关键,下列实验操作正确的是( )
①用50 mL量筒量取5.2 mL稀硫酸
②用分液漏斗分离苯和四氯化碳的混合物
③用托盘天平称量117.7 g氯化钠晶体
④用量筒量取23.10 mL溴水
⑤用蒸发皿高温灼烧石灰石
⑥用250 mL容量瓶配制250 mL 0.2 mol·L-1的NaOH溶液;
A. ③⑥ B. ②③④⑤ C. ①②④ D. ②⑤⑥
【答案】A
【解析】
量取5.2 mL稀硫酸应选10 mL量筒,①错;苯和CCl4可以混溶,②错;量筒的精度是0.1mL,④错;高温灼烧石灰石用坩埚, ⑤错;故选A。
6.现有下列10种物质: ①液态氧 ②空气 ③Mg ④二氧化碳⑤H2SO4 ⑥Ca(OH)2 ⑦CuSO4·5H2O ⑧ 牛奶
⑨C2H5OH⑩NaHCO3下列分类正确的是( )
A. 属于混合物的是②⑦⑧ B. 属于盐的是⑥⑩
C. 属于电解质的是⑤⑥⑦⑩ D. 属于分散系的是②⑦⑧⑨
【答案】C
【解析】
①液态氧属于非金属单质,既不是电解质也不是非电解质;②空气属于气态混合物;③Mg属于金属单质,既不是电解质也不是非电解质;④二氧化碳属于化合物,属于酸性氧化物,属于非电解质;⑤H2SO4属于酸,属于电解质;⑥Ca(OH)2属于碱,属于电解质;⑦CuSO4·5H2O属于盐,属于电解质;⑧牛奶属于混合物,属于分散系中的胶体;⑨C2H5OH属于醇,属于非电解质;⑩NaHCO3属于酸式盐,属于电解质。A项,属于混合物的是②⑧,错误;B项,属于盐的是⑦⑩,错误;C项,属于电解质的是⑤⑥⑦⑩,正确;D项,属于分散系的是⑧,错误;
7.下列说法正确的是 ( )
A. 液态HCl、固态AgCl均不导电,所以HCl、AgCl是非电解质
B. NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质
C. 蔗糖、酒精在液态或水溶液里均不导电,所以它们是非电解质
D. 铜、石墨均导电,所以它们是电解质
【答案】C
【解析】
A、液态HCl、固态AgCl均不导电,原因是液态氯化氢和固态AgCl中不含自由移动的阴阳离子,但HCl溶于水后或AgCl熔融状态下能电离出自由移动的阴阳离子而使其水溶液导电,所以HCl、AgCl是电解质,故A错误;B、NH3、CO2的水溶液均能导电原因是氨气和二氧化碳分别和水反应生成氨水、碳酸,氨水、碳酸能电离出自由移动的阴阳离子而使其水溶液导电,电离出阴阳离子的是氨水和碳酸不是氨气和二氧化碳,所以氨气和二氧化碳是非电解质,故B错误;C、蔗糖和酒精在水中以分子存在,导致其溶液不导电,所以蔗糖和酒精是非电解质,故C正确;D、铜、石墨能导电,但铜和石墨是单质,所以既不是电解质也不是非电解质,故D错误。故选C。
8.设NA为阿伏伽德罗常数的值。下列有关叙述正确的是( )
A. 24g镁在足量的O2中燃烧,转移的电子数为0.1NA
B. 分子总数为NA的NO2和CO2混合气体中含有的氧原子數为2NA
C. 1L一氧化碳气体一定比1L氧气的质量小
D. 常温常压下8gO3中含有8NA个电子
【答案】B
【解析】
A项,n(Mg)==1mol,Mg在足量O2中燃烧生成MgO,1个Mg原子失去2个电子,转移的电子数为2NA,错误;B项,1个NO2分子和1个CO2分子中都含有2个氧原子,分子总数为NA的NO2和CO2混合气体中含有氧原子数为2NA,正确;C项,由于CO和O2所处温度、压强未知,1LCO和1LO2的质量无法比较,错误;D项,n(O3)==mol,1个O3中含有24个电子,含有的电子物质的量为4mol,错误;答案选B。
9.同温、同压下等质量的SO2气体和CO2气体,下列有关比较的叙述中,正确的是( )
①分子个数比为16∶11 ②密度比为16∶11 ③体积比为16∶11 ④原子个数比为11∶16
A. ① ③ B. ① ④ C. ② ③ D. ② ④
【答案】D
【解析】
同温、同压下不同气体的物质的量之比等于其体积比,也等于其分子数之比;同温、同压下不同气体的密度之比等于其摩尔质量之比。等质量的SO2气体和CO2气体,其物质的量之比等于 :。所以同温、同压下等质量的SO2气体和CO2气体,其分子个数比为11∶16,其原子个数比为11∶16,其体积比为11∶16,其密度比为16∶11。综上所述,D正确。本题选D。
10.有两种体积相同的某植物的营养液,其配方如下:对于两种营养液的成分,下列说法中,正确的是( )
KCl
K2SO4
ZnSO4
ZnCl2
1
0.3mol
0.2mol
0.1mol
—
2
0.1mol
0.3mol
—
0.1mol
A. 只有K+的物质的量相等 B. 只有Cl—的物质的量相等
C. 各离子的物质的量均不同 D. 各离子的物质的量完全相同
【答案】D
【解析】
【分析】
KCl、K2SO4、ZnSO4、ZnCl2均为强电解质,在溶液中完全电离,根据各电解质的物质的量计算离子的物质的量,确定离子关系。
【详解】①中n(K+)=0.3mol+0.2mol×2=0.7mol,n(SO42-)=0.2 mol+0.1mol=0.3mol,n (Zn2+)=0.1 mol,(Cl-)=0.3 mol,
②中n(K+)=0.1mol+0.3mol×2=0.7mol,n(SO42- )=0.3mol,n (Zn2+)=0.1 mol,(Cl-)=0.1mol+0.1mol×2=0.3 mol,
①和②中各种离子的物质的量:n(K+)=0.7 mol,n(SO42-)=0.3 mol,n (Zn2+)=0.1 mol,n(Cl-)=0.3 mol,所以成分相同,
故选D。
11.下列溶液中Cl-浓度最小的是( )
A. 200mL 2mol/L MgCl2溶液 B. 300mL 2.5mol/L FeCl3溶液
C. 500mL 2.5mol/L NaCl溶液 D. 250mL 1mol/L AlCl3溶液
【答案】C
【解析】
【分析】
电解质离子浓度=电解质浓度×电解质电离出的该离子数目,与溶液的体积无关,据此结合选项计算判断。
【详解】A、200mL 2mol/L MgCl2溶液中,c(Cl-)=2mol/L×2=4mol/L;
B、300mL 2.5mol/L FeCl3溶液中c(Cl-)=2.5mol/L×3=7.5mol/L;
C、500mL 2.5mol/L NaCl溶液中,c(Cl-)=2.5mol/L×1=2.5mol/L;
D、250mL 1mol/L AlCl3溶液中,c(Cl-)=1mol/L×3=3mol/L;
故选项C NaCl溶液中氯离子浓度最小,答案选C。
【点睛】本题考查离子物质的量浓度的有关计算,难度不大,注意电解质离子浓度与电解质浓度关系。
12.下列叙述中,正确的是 ( )
A. H2SO4的摩尔质量是98
B. 等质量的O2和O3中所含的氧原子数相同
C. 等质量的CO与CO2中所含碳原子数之比为7︰11
D. 98g H2SO4溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2 mol•L-1
【答案】B
【解析】
【详解】A、H2SO4的摩尔质量是98g/mol,A错误;
B、O2和O3均是氧元素形成的单质,因此等质量的O2和O3中所含的氧原子数相同,B正确;
C、等质量的CO与CO2中所含碳原子数之比为,C错误;
D、98g H2SO4
的物质的量是1mol,溶解于500mL水中,所得溶液的体积不是500mL,所以硫酸的物质的量浓度不是2 mol•L-1,D错误。
答案选B。
13.某白色粉末由两种物质组成,为鉴别其成分进行如下实验:①取少量样品加入足量水仍有部分固体未溶解,再加入足量稀盐酸,有气泡产生,固体全部溶解②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在。该白色粉末可能为( )
A. NaHCO3 、Al(OH)3 B. AgCl、NaHCO3 C. Na2CO3、BaCO3 D. Na2CO3、CuCO3
【答案】C
【解析】
A项,若白色粉末为NaHCO3和Al(OH)3,加入足量水,NaHCO3溶解,Al(OH)3不溶,无论加入足量盐酸还是足量硫酸都有气泡产生,最后固体都全部溶解,不符合题意;B项,若白色粉末为AgCl和NaHCO3,加入足量水,NaHCO3溶解,AgCl不溶,无论加入足量盐酸还是足量硫酸都有气泡产生,最后仍有固体AgCl存在,不符合题意;C项,若白色粉末为Na2CO3和BaCO3,加入足量水,Na2CO3溶解,BaCO3不溶,加入盐酸Na2CO3、BaCO3都与盐酸反应产生气泡,固体全部溶解,加入硫酸Na2CO3、BaCO3都与硫酸反应产生气泡,同时产生不溶性固体BaSO4,符合题意;D项,CuCO3为蓝绿色固体,不符合题意;答案选C。
14.有BaCl2和NaCl的混合溶液VL,将它分成两等份。一份滴加硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗amolH2SO4、bmolAgNO3。则原混合溶液中的c(Na+)为( )
A. (2b-4a)/Vmol·L-1 B. (b-a)/Vmol·L-1 C. (2b-2a)/Vmol·L-1 D. (b-2a)/Vmol·L-1
【答案】A
【解析】
【分析】
根据SO42-+Ba2+═BaSO4↓计算溶液中的Ba2+离子的物质的量,根据Ag++Cl-=AgCl↓算Cl-的物质的量,再根据c=n/V计算Ba2+离子、Cl-离子浓度,利用电荷守恒有2c(Ba2+)+c(Na+)=c(Cl-),据此计算原溶液中的Na+浓度.
【详解】BaCl2和NaCl的混合溶液V L,将它均分成两份,
一份滴加稀硫酸,使Ba2+完全沉淀,消耗amolH2SO4,则:
SO42-+Ba2+═BaSO4↓
a mol amol
c(Ba2+)=amol/0.5VL=2a/Vmol·L-1,
另一份滴加AgNO3溶液,使Cl-完全沉淀,反应中消耗bmolAgNO3,则:
Ag++Cl-=AgCl↓
b mol b mol
c(Cl-)=bmol/0.5VL=2b/Vmol·L-1,
溶液不显电性,由电荷守恒可知,c(Na+)+2a/Vmol·L-1×2=2b/Vmol·L-1,
解得c(Na+)=(2b-4a)/Vmol·L-1,
故选A。
【点睛】本题考查混合物的有关计算、物质的量浓度的计算等,解题关键:理解发生的离子反应及溶液不显电性,解题技巧,利用电荷守恒,熟悉物质的量浓度的计算公式,易错点D,注意两等份溶液的浓度关系。
15.下列离子方程式书写正确的是( )
A. 氢氧化铁与盐酸反应:H++OH-=H2O
B. 过量NaHSO4溶液与少量Ba(OH)2反应:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
C. 铁与H2SO4反应:Fe+2H+=Fe3++H2↑
D. NaHCO3溶于盐酸中:CO32-+2H+=CO2↑+H2O
【答案】B
【解析】
【分析】
A、氢氧化铁难溶,不能拆开;
B、氢氧化钡不足生成硫酸钡、硫酸钠和水;
C、铁与稀硫酸反应生成硫酸亚铁和氢气;
D、碳酸氢根离子不能拆开。
【详解】A、氢氧化铁难溶于水,应该用化学式表示,则氢氧化铁与盐酸反应的离子方程式为Fe(OH)3+3H+=3H2O+Fe3+,A错误;
B、过量NaHSO4溶液与少量Ba(OH)2溶液反应生成硫酸钡白色沉淀、硫酸钠和水,因此反应的离子方程式为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,B正确;
C、铁与H2SO4反应生成硫酸亚铁和氢气,反应的离子方程式为Fe+2H+=Fe2++H2↑,C错误;
D、碳酸氢根离子不能拆开,应该用化学式表示,则NaHCO3溶于盐酸中反应的离子方程式为HCO3-+H+=CO2↑+H2O,D错误;
答案选B。
【点睛】掌握相关物质的性质、发生的化学反应以及物质的拆分是解答的关键。判断离子方程式正确与否时一般可以从以下几个角度考虑,即检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,检查是否符合守恒关系(如质量守恒和电荷守恒等),检查是否符合原化学方程式等。
考点:考查离子方程式的正误判断
16.下列化学方程式中,不能用离子方程式 Ba2++===BaSO4↓表示的是
A. Ba(NO3)2+H2SO4===BaSO4↓+2HNO3
B. BaCl2+Na2SO4===BaSO4↓+2NaCl
C. BaCO3+H2SO4===BaSO4↓+H2O+CO2↑
D. BaCl2+H2SO4===BaSO4↓+2HCl
【答案】C
【解析】
A、离子反应方程式为Ba2++SO42-=BaSO4↓,不符合题意,故A错误;B、离子反应是Ba2++SO42-=BaSO4↓,不符合题意,故B错误;C、BaCO3是难溶物,不能拆写成离子,离子反应是BaCO3+2H++SO42-=BaSO4↓+CO2↑+H2O,符合题意,故C正确;D、离子反应是Ba2++SO42-=BaSO4↓,不符合题意,故D错误。
17.在酸性无色溶液中能大量共存的离子组是( )
A. NH4+、Mg2+、SO42-、Cl- B. Ba2+、K+、OH-、NO3-
C. Al3+、Cu2+、SO42-、Cl- D. Na+、Ca2+、Cl-、CO32-
【答案】A
【解析】
【分析】
强酸性溶液中存在大量氢离子,无色溶液时可排除Cu2+、MnO4-等有色离子,结合离子反应是否发生复分解反应、氧化还原反应等分析.
【详解】A、四种离子间不反应,也不与氢离子反应,无色溶液,在溶液中能够大量共存,故A正确;
B、OH-与氢离子反应,不能大量共存,故B错误;
C、Cu2+为有色离子,故C错误;
D、钙离子与碳酸根离子反应生成碳酸钙沉淀,在溶液中不能大量共存,故D错误;
故选A。
18.下列说法正确的是( )
A. 氧化还原反应一定属于四大基本反应类型
B. 氧化还原反应中,反应物不是氧化剂就是还原剂
C. 在氧化还原反应中,氧化剂和还原剂既可以是不同物质也可以是同种物质
D. 失电子越多,还原性越强,得电子越多,氧化性越强
【答案】C
【解析】
A项,氧化还原反应不一定属于四大基本反应类型,如反应2Na2O2+2H2O=4NaOH+O2
↑属于氧化还原反应,但不属于四大基本反应类型,错误;B项,氧化还原反应中有的物质参与反应既不是氧化剂又不是还原剂,如反应2Na2O2+2H2O=4NaOH+O2↑中H2O既不是氧化剂又不是还原剂,错误;C项,在氧化还原反应中氧化剂和还原剂可以是不同物质(如Zn+2HCl=ZnCl2+H2↑等),也可以是同种物质(如2KMnO4K2MnO4+MnO2+O2↑等),正确;D项,氧化性(或还原性)的强弱指得(或失)电子的能力,与得(或失)电子的多少无关(如还原性:NaAl,Na失去1个电子,Al失去3个电子等),得电子能力越强氧化性越强,失电子能力越强还原性越强,错误;答案选C。
19.下列氧化还原反应方程式,所标电子转移方向与数目错误的是
A. B.
C. D.
【答案】B
【解析】
分析:A.该反应中Fe元素化合价由0价变为+2价、H元素化合价由+1价变为0价,得失电子的最小公倍数是2;B.该反应中Cl元素化合价由+5价、-1价变为0价,得失电子总数是5;C.该反应中Cl元素化合价由0价变为+1价、-1价,得失电子总数是2;D.该反应中N元素化合价由+2价变为+5价、O元素化合价由0价变为-2价,得失电子总数是12。
详解:A.该反应中Fe元素化合价由0价变为+2价、H元素化合价由+1价变为0价,得失电子的最小公倍数是2,中电子转移方向与数目正确,选项A正确;B.该反应中Cl元素化合价由+5价、-1价变为0价,得失电子总数是5,其电子转移方向和数目为,选项B错误;C.该反应中Cl元素化合价由0价变为+1价、-1价,得失电子总数是2,转移电子方向和数目为,选项C正确;D.该反应中N元素化合价由+2价变为+5价、O元素化合价由0价变为-2价,得失电子总数是12,转移电子方向和数目为,选项D
正确;答案选B。
点睛:本题考查了电子转移方向和数目,根据元素化合价变化来分析解答,易错选项是B,该反应中部分HCl不参加氧化还原反应,为易错点。
20.汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3===K2O+5Na2O+16N2↑下列说法正确的是:
A. KNO3是还原剂,其中氮元素被氧化
B. 生成物中的N2是氧化产物,K2O是还原产物
C. 每转移1 mol电子,可生成标准状况下N2的体积为35.84 L
D. 若有65 g NaN3参加反应,则被氧化的N的物质的量为3.2 mol
【答案】C
【解析】
KNO3中氮元素化合价由+5价降低为0价,KNO3是氧化剂;NaN3中氮元素化合价由- 升高为0价, NaN3为还原剂,N2既是氧化产物又是还原产物;由方程式可知转移10mol电子,产生16mol气体,现若转移1mol电子,产生1.6mol气体,标准状况下N2的体积为35.84 L;若有65 g NaN3参加反应,则被氧化的N的物质的量为3 mol,故C正确。
21.今有下列三个氧化还原反应:(1)2FeCl3+2KI =2FeCl2+2KCl+I2(2)2FeCl2+Cl2 = 2FeCl3 (3)2KMnO4+16HCl = 2KCl+2MnCl2+8H2O+5Cl2↑ 若某溶液中有 Fe2+ 和 I- 共存,要氧化除去I-而又不影响Fe2+ 和Cl- ,可加入的试剂是
A. FeCl3 B. KMnO4 C. Cl2 D. HCl
【答案】A
【解析】
【分析】
由信息可知,氧化性由强至弱的顺序为:MnO4﹣>Cl2>Fe3+>I2,还原性由强至弱的顺序为I﹣>Fe2+>Cl﹣>Mn2+。
【详解】A.FeCl3能氧化除去I﹣而不影响Fe2+和Cl﹣,故A选;
B.KMnO4能将Fe2+、I﹣和Cl﹣均氧化,故B不选;
C.氯气能将Fe2+、I﹣均氧化,故C不选
D.HCl与三种离子均不反应,故D不选;
故选A。
【点睛】在氧化还原反应中,氧化剂的氧化性大于氧化产物 ,还原剂的还原性大于还原产物。
22.一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3=2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子的个数比为
A. 5∶3 B. 5∶4 C. 1∶1 D. 3:5
【答案】A
【解析】
根据反应方程式,5mol的NH4NO3中含有5mol的NH4+和5mol NO3-,NH4+中N元素的化合价是-3价, N2中N元素的化合价是0价,所以5mol的NH4+共失去3×5=15mol电子,作还原剂生成氧化产物N22.5mol;NO3-中N元素的化合价是+5价,其中2mol NO3-生成2HNO3化合价未变,3mol NO3-作氧化剂生成还原产物N21.5mol,共得到5×3=15mol电子,所以还原产物与氧化产物的物质的量之比等于1.5:2.5=3:5,答案选D。
点睛:氧化还原反应价态的变化规律中有两点:①相互靠拢,不发生交叉,②在发生氧化还原反应中化合价是逐级变化,在具体应用中体现出来的是归中和歧化反应,所以这两类反应是氧化还原反应规律的应用。
23.M2O7x-与S2-在酸性溶液中发生如下反应:M2O7x-+3S2-+14H+=2M3++3S↓+7H2O,则M2O7x-中M元素的化合价为
A. +2 B. +3
C. +4 D. +6
【答案】D
【解析】
试题分析:M2O7x-+3S2-+14H+=2M3++3S↓+7H2O中,由电荷守恒可知,(-x)+3×(-2)+14×(+1)=2×(+3)
解得x=2,设M2O72-中的M的化合价为y,M2O7x-中元素的化合价的代数和为-x,则y×2+(-2)×7=-2,解得y=+6。答案选D。
考点:元素化合价的求法
24.在0.2L由NaCl、MgCl2、BaCl2组成的混合溶液中,部分离子浓度大小如图所示,对于该溶液成分。下列说法不正确的是( )
A. NaCl的物质的量为0.2mol
B. 溶质MgCl2的质量为9g
C. 该混合液中BaCl2的物质的量为0.1mol
D. 将该混合液加水稀释至体积为1L,稀释后溶液中Ba2+的物质的量浓度为0.1mol/L
【答案】B
【解析】
A项,n(Na+)=1.0mol/L0.2L=0.2mol,NaCl物质的量为0.2mol,正确;B项,n(Mg2+)=0.5mol/L0.2L=0.1mol,n(MgCl2)=0.1mol,m(MgCl2)=0.1mol95g/mol=9.5g,错误;C项,根据电荷守恒,c(Na+)+2c(Mg2+)+2c(Ba2+)=c(Cl-),c(Ba2+)=(3.0mol/L-1.0mol/L-0.5mol/L2)2=0.5mol/L,n(BaCl2)=n(Ba2+)=0.5mol/L0.2L=0.1mol,正确;D项,稀释前后溶质物质的量不变,则稀释后Ba2+物质的量浓度为0.1mol1L=0.1mol/L,正确;答案选B。
25.已知有如下反应:①ClO3-+5Cl-+6H+=3Cl2↑+3H2O,②2FeCl3+2KI=2FeCl2+2KCl+I2,
③2FeCl2+Cl2=2FeCl3。下列说法正确的是
A. 反应①中氧化剂与还原剂的物质的量之比为5:1
B. 根据上述三个反可知氧化性:ClO3->Cl2>Fe3+>I2
C. 反应②中每生成127 g I2,转移的电子数为2NA
D. 反应②中FeCl3 只作氧化剂,反应③中FeCl3只是氧化产物
【答案】B
【解析】
A、①ClO3-+5Cl-+6H+=3Cl2↑+3H2O反应中ClO-中Cl元素化合价由+5降低到0价为氧化剂,Cl-中Cl元素化合价由-1价升高到0价为还原剂,所以氧化剂与还原剂的物质的量之比为1:5,A错误;B、①ClO3-+5Cl-+6H+=3Cl2↑+3H2O中,氧化性:ClO3->Cl2;②2FeCl3+2KI=2FeCl2+2KCl+I2,氧化性:Fe3+>I2;③2FeCl2+Cl2=2FeCl3中,氧化性:Cl2>Fe3+,所以氧化性强弱的顺序为:ClO3->Cl2>Fe3+>I2,B正确;C、反应②2FeCl3+2KI=2FeCl2+2KCl+I2,生成1molI2转移2mol电子,所以每生成127gI2,即0.5mol碘转移的电子数为NA,C错误;D、②2FeCl3+2KI=2FeCl2+2KCl+I2反应中FeCl3中Fe元素化合价由+3降低到+2价为氧化剂,③2FeCl2+Cl2=2FeCl3,FeCl3既是氧化产物又是还原产物,D错误;答案选B。
点睛:本题考查学生氧化还原反应中氧化剂和还原剂强弱的判断以及有关计算等知识,属于综合知识的考查,答题的关键是要抓住化合价变化,从化合价变化的角度去分析、判断和计算。
第II卷(非选择题)
二、填空题
26.有关物质的量的计算填空:
(1)2 mol尿素[CO(NH2)2]含___个H原子,所含氧原子跟___g H2O所含氧原子个数相等。
(2)①标准状况下,22.4L CH4;②1.5mol NH3; ③1.806×1024个H2O;④标准状况下,73gHCl。所含H原子个数由多到少的顺序是_________________。
(3)30.9 g NaR含有Na+ 0.3mol,则NaR的摩尔质量为______________。
(4)100 mL 某Al2(SO4)3溶液中,c(Al3+) = 2.0 mol/L,则其中c(SO42-) = ______mol/L。
(5)工业上利用下列反应进行海水中溴元素的富集:Br2 + SO2 + 2H2O = H2SO4 + 2HBr。若反应中转移了1 mol电子,则消耗SO2的体积(标准状况)是___________L。
【答案】 (1). 8NA或 4.816×1024 (2). 36 (3). ③>②>①>④ (4). 103 g/mol (5). 3 (6). 11.2
【解析】
【分析】
(1)尿素的化学式中含有4个H原子和1个O原子,据此计算出2mol尿素含有H、O原子的物质的量,再根据N=nNA计算出含有H原子数;结合水分子的组成计算出需要水的物质的量及质量;
(2)根据n=V/Vm计算甲烷物质的量,根据n=N/ NA计算水的物质的量,根据n=m/M计算出HCl的物质的量,结合分子式计算含有H原子的物质的量;
(3)NaR的物质的量和Na+的物质的量相等;
(4)结合硫酸铝的化学式组成计算出含有硫酸根离子的物质的量;
(5)Br2+SO2+2H2O=H2SO4+2HBr中,Br元素的化合价由0降低为-1价,S元素的化合价由+4升高为+6价,由反应可知,每消耗1molSO2,转移2mol电子;
【详解】(1)2mol尿素[CO(NH2)2]中含有H的数目为:2mol×4×NAmol-1=8NA;2mol尿素[CO(NH2)2]中含O的物质的量为2mol,氧原子数相同时氧原子的物质的量相等,则需要水的物质的量为:2mol,质量为:18g/mol×2mol=36g,
故答案为:8NA或 4.816×1024;36;
(2)①标准状况下,22.4L CH4为1 mol,H原子为4 mol;②1.5mol NH3中H原子为4.5 mol;③1.806×1024个H2O为3 mol,H原子为6mol;④标准状况下,73gHCl为2 mol,H原子为2mol;所含H原子个数由多到少的顺序是:③>②>①>④,故答案为:③>②>①>④;
(3)30.9 g NaR 含有Na+0.3mol,则NaR物质的量是0.3mol,所以摩尔质量是30.9g÷0.3mol=103g/mol,故答案为: 103 g/mol;
(4)根据n=cV,求出Al3+的物质的量为0.2 mol,Al3+和SO42-的物质的量之比为2:3,所以SO42-为0.3 mol,c(SO42-) =0.3 mol/0.1L=3 mol/L;故答案为:3
(5)Br2+SO2+2H2O=H2SO4+2HBr中,Br元素的化合价由0降低为-1价,S元素的化合价由+4升高为+6价,由反应可知,每消耗1molSO2,转移2mol电子,若反应中转移了1 mol电子,则消耗0.5molSO2,消耗SO2的体积(标准状况)是11.2L,故答案为:11.2。
27.下列A、B、C、D是中学常见的混合物分离或提纯的基本装置。
根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D填入适当的空格中.
(1)除去Ca(OH)2溶液中悬浮的CaCO3 ______;
(2)从碘水中提取碘______;
(3)用自来水制取蒸馏水______;
(4)分离植物油和水______;
(5)与海水晒盐原理相符的是______.
【答案】 (1). A (2). B (3). D (4). B (5). C
【解析】
【分析】
A为过滤;B为萃取、分液;C为蒸发;D为蒸馏,结合混合物的性质的异同选择分离方法;
【详解】(1)碳酸钙不溶于水,过滤即可,答案选A;
(2)单质碘易溶在有机溶剂中,萃取、分液即可,答案选B;
(3)自来水制取蒸馏水,需要通过蒸馏,答案选D。
(4)植物油不溶于水,分液即可,答案选B。
(5)与海水晒盐原理相符的是蒸发,答案选C。
故答案为: A ; B ; D ; B ; C ;
【点睛】萃取适合于溶质在不同溶剂中的溶解性不同而分离的一种方法,结晶法适用于不同溶质的溶解度受温度影响不同而分离的一种方法,分液适用于互不相溶的液体之间的一种分离方法,蒸馏是依据液态混合物中各组分沸点不同而分离的一种方法,适用于除去易挥发、难挥发或不挥发杂质,过滤适用于不溶性固体和液体之间的一种分离方法。
28. 实验室欲用NaOH固体配制1.0 mol/L的NaOH溶液240 mL;
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却 ⑨摇动
其正确的操作顺序为_________。本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、________________。
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如下图所示。烧杯的实际质量为________g,要完成本实验该同学应称出________g NaOH。
(3)使用容量瓶前必须进行的一步操作是________。
(4)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是________。
A.转移溶液时不慎有少量洒到容量瓶外面
B.定容时俯视刻度线
C.未冷却到室温就将溶液转移到容量瓶并定容
D.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
【答案】(1) ②①③⑧⑤⑥⑨⑦④ 250 mL容量瓶、胶头滴管
(2)27.4 10.0 (3)检查容量瓶是否漏液 (4)BC
【解析】
试题分析:(1)实验室中没有240mL的容量瓶,配制时需要选用250mL的容量瓶,配制250mL1.0mol/L的NaOH溶液的步骤为:计算→称量→溶解、冷却→移液→定容→摇匀→装瓶→贴签,一般用天平称量(用到药匙)称量,在烧杯中溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀,所以正确的操作顺序为:②①③⑧⑤⑥⑨⑦④;需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管,还缺少250mL容量瓶,答案为:②①③⑧⑤⑥⑨⑦④;250ml容量瓶、胶头滴管;
(2)根据图示可知,游码的读数为2.6g,结合托盘天平的称量原理可知,图示中,砝码质量=烧杯质量+游码质量,所以烧杯质量=砝码质量-游码质量=20g+10g-2.6g=27.4g;配制250mL1.0mol/L的NaOH溶液,需要氢氧化钠的质量为:0.25L×1mol/L×40g/mol=10.0g,答案为:27.4;10.0;
(3)容量瓶有瓶塞,配制过程中需要摇匀,为了避免液体流出,配制溶液之前需要据此容量瓶是否漏水,答案为:检验容量瓶是否漏水;
(4)A、转移溶液时不慎有少量洒到容量瓶外面,导致配制的溶液中溶质的物质的量偏小,溶液浓度偏低,B、定容时俯视刻度线,导致加入的蒸馏水体积低于容量瓶刻度线,配制的溶液体积偏小,溶液浓度偏高,C、未冷却到室温就将溶液转移到容量瓶并定容,热的溶液体积偏大,冷却后溶液体积变小,导致配制的溶液体积偏小,溶液浓度偏高,D、定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线,导致配制的溶液体积偏大,溶液浓度偏低,答案选BC。
考点:溶液的配制
29.已知As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO42AsH3↑+6ZnSO4+3H2O。
(1)请用双线桥法标出电子转移的方向和数目____________________________________。
(2)As2O3在上述反应中显示出来的性质是____________(填序号)。
A.氧化性 B.还原性 C.酸性 D.碱性
(3)该反应的氧化产物是__________,还原产物是________。
(4)若生成0.2 mol AsH3,则转移的电子数为___________。
【答案】 (1). (2). A (3). ZnSO4 (4). AsH3 (5). 1.2NA
【解析】
(1)在As2O3+6Zn+6H2SO42AsH3↑+6ZnSO4+3H2O中,As的化合价由+3降为−3,共得到6×2=12个电子,Zn的化合价由0升高为+2,共失去2×6=12个电子。
(2)As2O3中As元素的化合价降低,发生还原反应,作氧化剂,所以表现为氧化性。
(3)该反应中Zn被氧化,氧化产物是ZnSO4,As被还原,还原产物是AsH3。
(4)由双线桥可知,生成2 mol AsH3,转移电子12 mol,若生成0.2 mol AsH3,则转移电子的物质的量是1.2 mol,电子数是1.2NA。
30.某固体物质可能由K2SO4、KI、NaCl、CuCl2、CaCl2、Na2CO3中的一种或几种组成。依次进行下列五步实验。观察到的现象如下:
①混合物加水得无色透明溶液;
②向上述溶液中滴加BaCl2溶液,有白色沉淀生成,将该沉淀滤出,并将滤液分成两份;
③上述白色沉淀可完全溶于稀盐酸;
④往一份滤液中滴加氯水并加入CCl4,振荡后静置CCl4层呈无色(氯水能将I-氧化为I2);
⑤往另一份滤液中加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀硝酸。
由此可推断出:
(1)写出③中白色沉淀可完全溶于稀盐酸的化学方程式______________。
(2)写出⑤中生成白色沉淀的离子方程式________。
(3)该固体中一定含有____________;无法确定是否含有的是___________。
(4)确定该物质是否存在的方法是____________。
【答案】 (1). BaCO3+2HCl=BaCl2+H2O+CO2↑ (2). Ag++Cl-=AgCl↓ (3). Na2CO3 (4). NaCl (5). 取①所得溶液,滴加硝酸酸化的硝酸银溶液,若出现白色沉淀,说明原固体中有NaCl,反之则无
【解析】
试题分析:①向混合物中加入适量水全部溶解,溶液无色透明,说明一定不会含有CuCl2,不含有不溶物或反应生成不溶物;②向步骤①溶液中滴加BaCl2溶液生成白色沉淀,则说明该白色沉淀是碳酸钡或是硫酸钡中的至少一种;③取步骤②的白色沉淀,白色沉淀可完全溶于稀盐酸,说明该沉淀不会是硫酸钡,所以一定是碳酸钡;④往一份滤液中滴加氯水并加入CCl4,振荡后静置,CCl4层呈无色,则一定没有碘单质生成,所以可以确定KI一定不存在;⑤另一份滤液中加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀硝酸,说明该白色沉淀一定是氯化银,但无法证明该溶液中的氯离子,是来自于原混合物还是②中加入的氯化钡所致;
(1)③中白色沉淀为碳酸钡,可完全溶于稀盐酸,反应的化学方程式BaCO3+2HCl=BaCl2+CO2↑+H2O;
(2)⑤中生成白色沉淀为AAgCl,反应的离子方程式为Ag++Cl-=AgCl↓,由以上分析可知混合物中肯定含有碳酸钠,无法确定是否含有的是NaCl;
(3)已确定含有碳酸钠,一定不含有K2SO4、KI、CuCl2、CaCl2,如确定是否含有NaCl,可取①所得溶液,滴加硝酸酸化后再滴加硝酸溶液,若出现白色沉淀,说明有原固体中有NaCl,反之则无。
考点:考查无机物的推断。