- 245.50 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
江苏省邗江中学2017——2018学年度第二学期
新疆高二化学期中试卷
命题人:冯小丽
说明:本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,全卷满分120分,考试时间100分钟
可能用到的相对原子量:H 1 N 14 O 16 Cl 35.5 Zn 65 S 32 Fe 56 Ba 137
第Ⅰ卷(选择题 共40分)
一、单项选择题(本题包括10小题,每题2分,共20分,每小题只有一个选项符合题意)
1.“保护环境”是我国的基本国策。下列做法不应该提倡的是
A.生活垃圾分类收集 B.垃圾进行露天焚烧
C.宣传“低碳”出行 D.合理使用化肥农药
2.下列有关化学用语的表示正确的是
A.甲烷分子的球棍模型: B.HClO的结构式:H-Cl-O
C.质子数为53,中子数为78的碘原子:
D.熔融状态下硫酸氢钾的电离方程式:KHSO4 K++H++SO42-
3.为提纯下列物质(括号内物质为杂质),所选用的试剂和分离方法正确的是
物质(杂质)
除杂试剂
分离方法
A
硝酸铜溶液(硝酸银)
铜粉
结晶
B
Cl2(HCl)
NaOH溶液
洗气
C
Br2(H2O)
酒精
萃取
D
铜粉(铁粉)
稀盐酸
过滤
4.下列物质的性质与用途因果关系正确的是
A.铝有较高熔点,可做耐火材料 B.SO2具有漂白性,能使溴水褪色,
C.碳酸氢钠可与盐酸反应,可用于中和胃酸过多
D.钠钾合金比较活泼,可用于快中子反应堆的热交换剂
5.下列实验现象可用同一原理解释的是
A.品红溶液中分别通入SO2和Cl2,品红均褪色
B.向溴水和滴有酚酞的氢氧化钠溶液中通入足量的SO2均褪色
C.向足量的澄清石灰水中分别通入少量SO2和CO2均有固体析出
D.分别加热盛有NH4Cl和单质碘的试管,管口均有固体凝结
6.下列表示对应化学反应的离子方程式正确的是
A.向酸性KMnO4溶液中通入SO2:3SO2+2MnO+4OH-=2MnO2↓+3SO+2H2O
B.醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+=Ca2++CO2↑+H2O
C.向FeBr2溶液中通入足量Cl2:2Fe2++Cl2=2Fe3++2Cl-
D.Cu和稀硝酸反应:3Cu+8H++2NO3- 3Cu2++2NO↑+4H2O
7.下列离子在强酸性溶液中能大量共存的是
A、Fe3+、Ca2+、NO3-、SCN- B、Na+、Fe2+、SO42-、Cl-
C、K+、Mg2+、Cl-、HCO3-、 D、Na+、NH4+、Cl-、SiO32-
8.短周期主族元素X、Y、Z、W原子序数依次增大,X与Z原子序数相差8, Y元素的焰色为黄色,Z元素的最高价为+6。下列叙述正确的是
A.X2-的离子半径大于Y+的离子半径 B.H2Z的沸点高于H2X
C.Z的简单气态氢化物稳定性比W的强
D.Y2X2和Y2Z的晶体类型和化学键类型完全相同
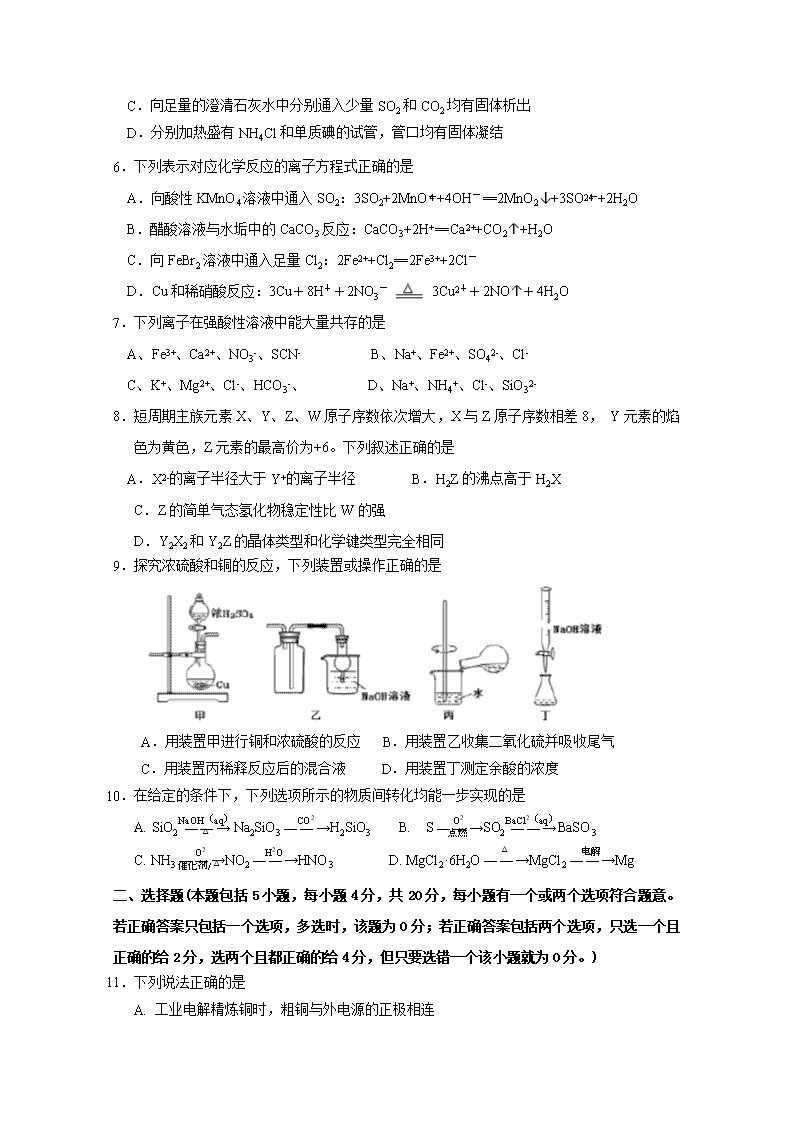
9.探究浓硫酸和铜的反应,下列装置或操作正确的是
A.用装置甲进行铜和浓硫酸的反应 B.用装置乙收集二氧化硫并吸收尾气
C.用装置丙稀释反应后的混合液 D.用装置丁测定余酸的浓度
10.在给定的条件下,下列选项所示的物质间转化均能一步实现的是
A. SiO2Na2SiO3H2SiO3 B. SSO2BaSO3
C. NH3NO2HNO3 D. MgCl2·6H2OMgCl2Mg
二、选择题(本题包括5小题,每小题4分,共20分,每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个该小题就为0分。)
11.下列说法正确的是
A. 工业电解精炼铜时,粗铜与外电源的正极相连
B. 常温下向纯水中加入盐酸,水的离子积不变
C. 其他条件不变时,升高温度,吸热反应的v正增大,v逆减小
D.氯化铝是一种电解质,可用于电解法制铝
12.设NA 为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,2.24 L 水中所含的电子数为NA
B.常温常压下,16 g O3所含的电子数为8NA
C.0.1 mol Na2O2 晶体中所含的离子数为0.3NA
D.1 mol Fe在氧气中充分燃烧失去的电子数为3NA
13.下列说法正确的是
A.氯水加水稀释后,溶液中c(Cl-) /c(ClO-)的值减大
B.AgCl悬浊液中加入少量KI溶液,沉淀转变为黄色,说明Ksp(AgI)>Ksp(AgCl)
C.常温下,2SO2(g)+O2(g)=2SO3(g)能够自发进行,则该反应的△H<0
D.相同条件下,Na2CO3溶液的碱性强于NaClO,说明HClO的酸性强于H2CO3
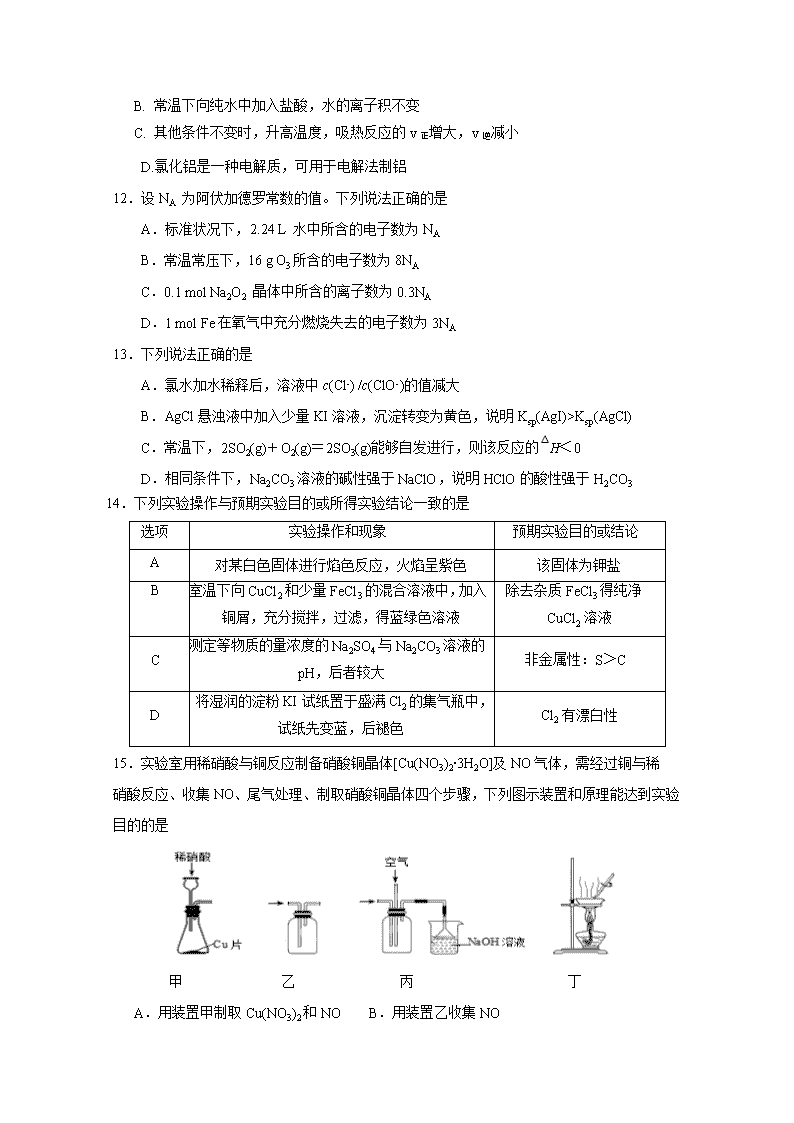
14.下列实验操作与预期实验目的或所得实验结论一致的是
选项
实验操作和现象
预期实验目的或结论
A
对某白色固体进行焰色反应,火焰呈紫色
该固体为钾盐
B
室温下向CuCl2和少量FeCl3的混合溶液中,加入铜屑,充分搅拌,过滤,得蓝绿色溶液
除去杂质FeCl3得纯净CuCl2溶液
C
测定等物质的量浓度的Na2SO4与Na2CO3溶液的pH,后者较大
非金属性:S>C
D
将湿润的淀粉KI试纸置于盛满Cl2的集气瓶中,试纸先变蓝,后褪色
Cl2有漂白性
15.实验室用稀硝酸与铜反应制备硝酸铜晶体[Cu(NO3)2·3H2O]及NO气体,需经过铜与稀 硝酸反应、收集NO、尾气处理、制取硝酸铜晶体四个步骤,下列图示装置和原理能达到实验目的的是
甲 乙 丙 丁
A.用装置甲制取Cu(NO3)2和NO B.用装置乙收集NO
C.用装置丙吸收尾气 D.用装置丁蒸发结晶制Cu(NO3)2·3H2O
第Ⅱ卷(非选择题 共80分)
16.(18分)I.下列各物质的转化关系如下图所示。B、D是气体,其中B是空气的主要成分之一; C是淡黄色固体,常用于供氧剂;E是红棕色固体;F是最常见的无色液体。
回答下列问题:
(1)C的化学式是 , 实验室常将单质A保存在 中。
(2)气体D通入紫色石蕊溶液的现象是 。
(3)写出反应①的离子方程式 。
(4)写出反应②的化学方程式 。
II.下列各物质的转化关系如下图所示,其中A是高熔点物质,B是空气成分之一,D是红棕色固体,G是黄绿色气体,K是红褐色固体。
回答下列问题:
(1)B的化学式是 ,D的化学式是 。
(2)反应①的离子方程式是 。
(3)反应②的化学反应方程式是 。
17.(10分)烧碱、纯碱等都是重要的化工原料。向100 mL 1 mol·L-1烧碱溶液中通入一定量CO2充分反应。
(1)将溶液在低温下蒸干得到白色固体X,X的组成可能有四种情况,按出现的先后顺序分别是: Ⅰ.NaOH、Na2CO3,
Ⅱ.__________________________,
Ⅲ.Na2CO3、NaHCO3,
Ⅳ._________________________。
(2)常温下,将得到的固体X重新溶于水,在所得溶液中加入盐酸,使溶液的pH=7,再将溶液蒸干,得到固体的质量为________ g。
(3)若要验证白色固体X是第Ⅰ种组成,依次加入的试剂为________(填字母序号)。
a.盐酸 b.MgCl2溶液c.BaCl2溶液 d.Ba(OH)2溶液
在验证的过程中,一定需要进行的操作是________(填字母序号)。
a.萃取 b.洗涤 c.过滤 d.分馏
18.(16分)铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
(1)所含铁元素既有氧化性又有还原性的物质是________(用字母代号填)。
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(2)向沸水中逐滴滴加1 mol/L FeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是________nm。
(3)电子工业需要用30 %的FeCl3溶液腐蚀敷在绝缘板上的铜片制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式 。某同学对FeCl3腐蚀铜后所得溶液的组成进行测定:取少量待测溶液,滴入KSCN溶液呈红色,则溶液中所含金属阳离子有___。
(4)若要验证该溶液中含有Fe2+,正确的实验方法是 (用字母代号填)。
A.向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe2+。
B.向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+。
C.向试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,证明含有Fe2+
(5)欲从废液中回收铜,并重新获得FeCl3溶液设计实验方案如下:
① 写出上述实验中有关物质的化学式:A:_____________;B: 。
② 写出通入C的化学方程式__________________________________。
19.(12分)碱式次氯酸镁[Mg2ClO(OH)3·H2O]微溶于水,不吸湿,相对稳定,是一种有开发价值的无机抗菌剂。某研发小组以菱镁矿(MgCO3,含少量FeCO3)为主要原料通过下列流程制备碱式次氯酸镁:
回答下列问题:
(1)酸溶时,矿石需进行粉碎且盐酸过量,其目的是 。
(2)氧化时发生的离子方程式是 。
(3)过滤1得到的滤渣成份 (写化学式)。
(4)混合时NaOH溶液需最后加入且不能过量,其原因是 ;
过滤2的滤液中可回收的主要物质是 (写化学式)。
(5)碱式次氯酸镁能杀菌消毒的原因是 。
20.(14分)以铬铁合金(含少量Co、Ni、C等元素)为原料制备Cr2O3且获得副产品
FeC2O4·2H2O的工艺流程如下:
(1)工业上酸溶通常用硫酸而不用盐酸、硝酸的原因是:硫酸价格便宜、 。
(2)已知25 ℃,Ksp(CoS) = 1.8×10-22,Ksp(NiS) = 2.8×10-21。若滤液中杂质离子浓度小于10-5 mol·L-1,则c(S2-)至少为 mol·L-1。
(3)Fe3+易与C2O形成配合物,残留在溶液中。除铁前,检测滤液中Fe3+和除去Fe3+所需的试剂分别为 、 。
(4)FeC2O4·2H2O与LiH2PO4煅烧,可制备锂电池的电极材料LiFePO4,其他产物以气体形式放出。该反应的化学方程式为 。
(5)已知Cr(OH)3是两性氢氧化物,若沉铬时pH过大,Cr(OH) 3会转化为CrO,其离子方程式为 。证明Cr(OH) 3沉淀洗涤干净的方法是 。
21.(10分)已知:①铜矿矿石中含有Cu2(OH)2CO3及含铁元素的杂质;
②黄铵铁矾的化学式为(NH4)xFey(SO4)m(OH)n,其中铁为+3价。
某兴趣小组利用该铜矿石制黄铵铁矾的流程如下:
(1)以氧化物的形式表示Cu2(OH)2CO3的组成为 ,1 mol Cu2(OH)2CO3与稀H2SO4反应时消耗H2SO4物质的量为 。
(2)该小组为测定黄铵铁矾的组成,进行了如下实验:
a.称取m g样品,加盐酸完全溶解后,将所得溶液分为两等份;
b.向一份中加入足量NaOH溶液并加热,收集到标况下56.00 mL的气体(假设气体全部逸出)。将所得沉淀过滤、洗涤、灼烧至恒重,得到红色粉末0.600 g。
c.向另一份中加足量BaCl2溶液充分反应后,过滤、洗涤、干燥得沉淀1.165 g。
①黄铵铁矾中NH4+与SO42-的个数比为 。
②通过计算确定黄铵铁矾的化学式(写出计算过程)。
江苏省邗江中学2017——2018学年度第二学期
新疆高二化学期中试卷答题纸
第I卷(选择题 共40分)
题 号
1
2
3
4
5
6
7
8
9
10
答 案
题 号
11
12
13
14
15
答 案
第II卷(非选择题 共80分)
16.(18分)
I.(1) , 。
(2) 。
(3) 。
(4) 。
II.(1) , 。
(2) 。
(3) 。
17.(10分)
(1) Ⅱ.__________________________, Ⅳ._________________________。
(2) g。
(3) (填字母序号)。 (填字母序号)。
18.(16分)
(1) (用字母代号填)。
(2) nm。
(3) 。 。
(4) (用字母代号填)。
(5) ① ; 。
② 。
19.(12分)
(1) 。
(2) 。
(3)________________________(写化学式)。
(4) ;
________________________(写化学式)。
(5) 。
20.(14分)
(1) 。
(2)_____________mol·L-1。
(3)__________________、__________________。
(4) 。
(5) 。
。
21.(10分)
(1) , 。
(2)① 。
②通过计算确定黄铵铁矾的化学式(写出计算过程)。