- 331.00 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课时达标作业19 原电池 化学电源
基础题
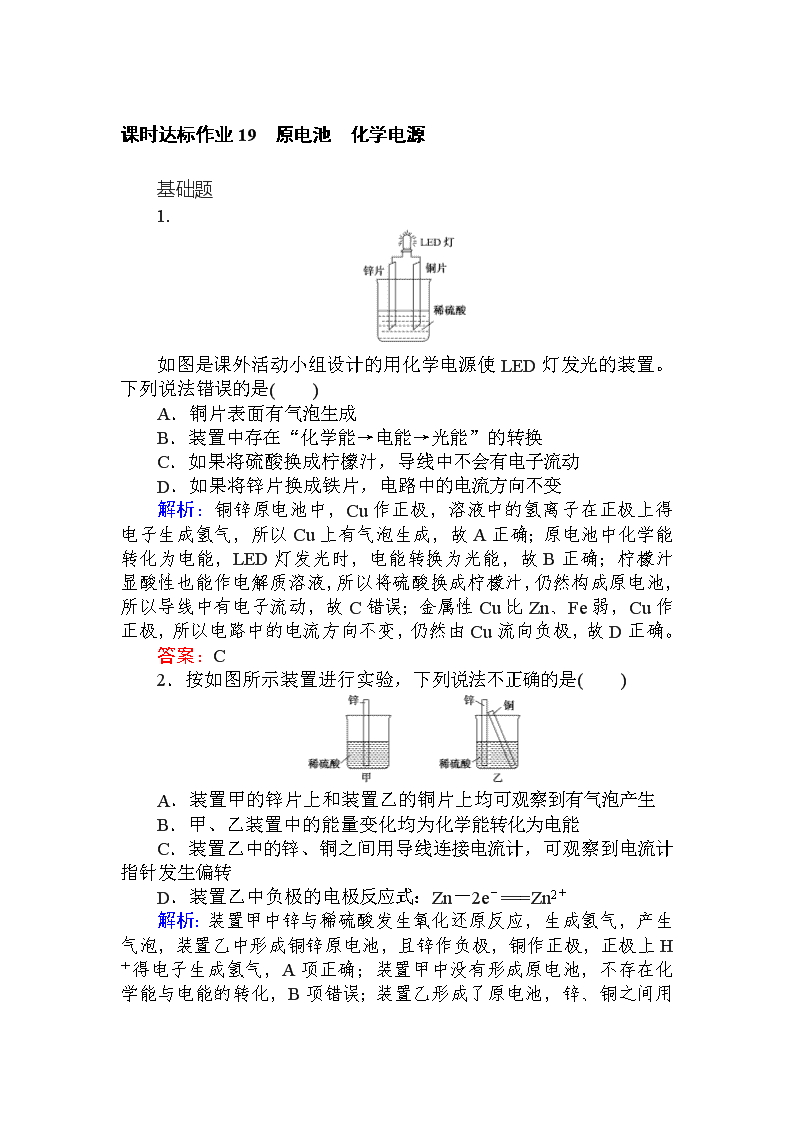
1.
如图是课外活动小组设计的用化学电源使LED灯发光的装置。下列说法错误的是( )
A.铜片表面有气泡生成
B.装置中存在“化学能→电能→光能”的转换
C.如果将硫酸换成柠檬汁,导线中不会有电子流动
D.如果将锌片换成铁片,电路中的电流方向不变
解析:铜锌原电池中,Cu作正极,溶液中的氢离子在正极上得电子生成氢气,所以Cu上有气泡生成,故A正确;原电池中化学能转化为电能,LED灯发光时,电能转换为光能,故B正确;柠檬汁显酸性也能作电解质溶液,所以将硫酸换成柠檬汁,仍然构成原电池,所以导线中有电子流动,故C错误;金属性Cu比Zn、Fe弱,Cu作正极,所以电路中的电流方向不变,仍然由Cu流向负极,故D正确。
答案:C
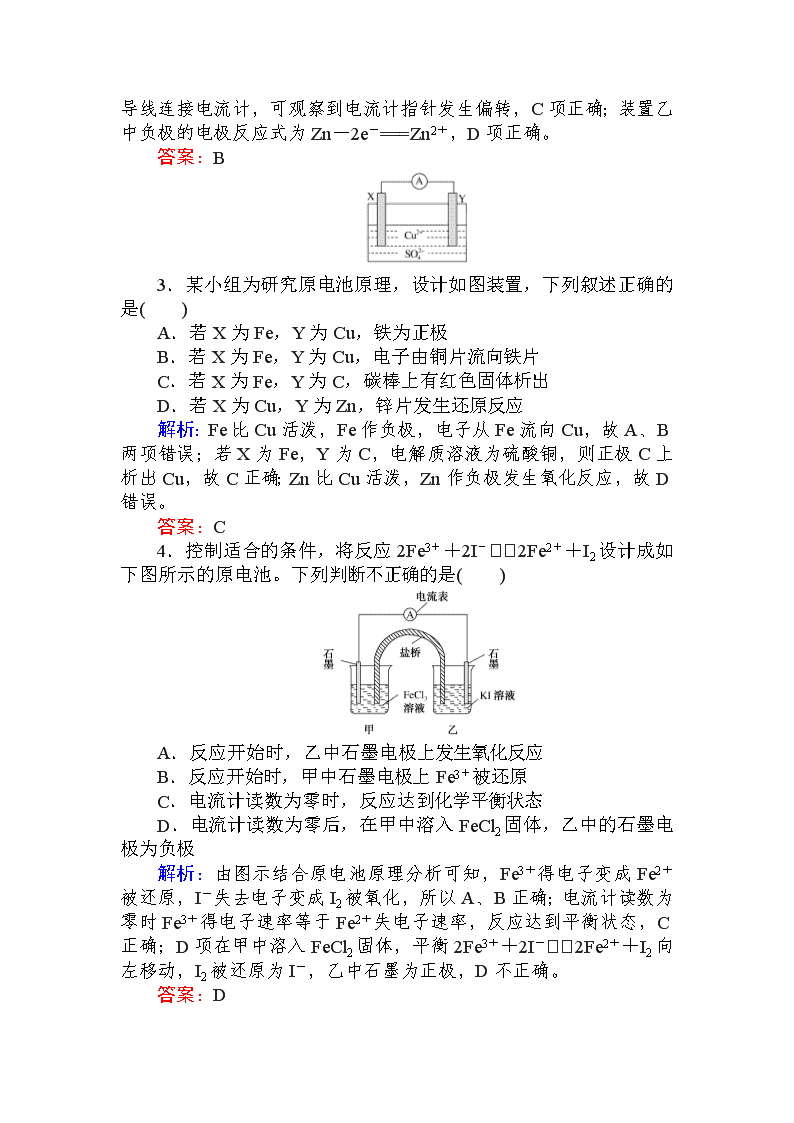
2.按如图所示装置进行实验,下列说法不正确的是( )
A.装置甲的锌片上和装置乙的铜片上均可观察到有气泡产生
B.甲、乙装置中的能量变化均为化学能转化为电能
C.装置乙中的锌、铜之间用导线连接电流计,可观察到电流计指针发生偏转
D.装置乙中负极的电极反应式:Zn-2e-===Zn2+
解析:装置甲中锌与稀硫酸发生氧化还原反应,生成氢气,产生气泡,装置乙中形成铜锌原电池,且锌作负极,铜作正极,正极上H+
得电子生成氢气,A项正确;装置甲中没有形成原电池,不存在化学能与电能的转化,B项错误;装置乙形成了原电池,锌、铜之间用导线连接电流计,可观察到电流计指针发生偏转,C项正确;装置乙中负极的电极反应式为Zn-2e-===Zn2+,D项正确。
答案:B
3.某小组为研究原电池原理,设计如图装置,下列叙述正确的是( )
A.若X为Fe,Y为Cu,铁为正极
B.若X为Fe,Y为Cu,电子由铜片流向铁片
C.若X为Fe,Y为C,碳棒上有红色固体析出
D.若X为Cu,Y为Zn,锌片发生还原反应
解析:Fe比Cu活泼,Fe作负极,电子从Fe流向Cu,故A、B两项错误;若X为Fe,Y为C,电解质溶液为硫酸铜,则正极C上析出Cu,故C正确;Zn比Cu活泼,Zn作负极发生氧化反应,故D错误。
答案:C
4.控制适合的条件,将反应2Fe3++2I-2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是( )
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
解析:由图示结合原电池原理分析可知,Fe3+得电子变成Fe2+被还原,I-失去电子变成I2被氧化,所以A、B正确;电流计读数为零时Fe3+得电子速率等于Fe2+失电子速率,反应达到平衡状态,C正确;D项在甲中溶入FeCl2固体,平衡2Fe3++2I-2Fe2++I2向左移动,I2被还原为I-,乙中石墨为正极,D不正确。
答案:D
5.电化学在日常生活中用途广泛,下图是镁—次氯酸钠燃料电池,电池总反应为:Mg+ClO-+H2O===Cl-+Mg(OH)2↓,下列说法不正确的是( )
A.惰性电极上发生氧化反应
B.镁电极是该电池的负极
C.正极反应式为ClO-+H2O+2e-===Cl-+2OH-
D.进料口加入NaClO溶液,出口为NaCl溶液
解析:由总反应可知镁发生氧化反应,“负氧正还原”,镁为负极,惰性电极上发生还原反应,A项错误,B项正确;负极反应为:Mg-2e-+2OH-===Mg(OH)2↓,正极反应为:ClO-+2e-+H2O===Cl-+2OH-,C、D项正确。
答案:A
6.普通水泥在固化过程中自由水分子减少,并产生Ca(OH)2,溶液呈碱性。根据这一特点,科学家发明了电动势(E)法测水泥初凝时间,此法原理如图所示。反应总方程式为:2Cu+Ag2O===Cu2O+2Ag。
下列有关说法不正确的是( )
A.工业上制备水泥的原料有黏土、石灰石、石膏
B.测量原理装置图中Ag2O/Ag极发生还原反应
C.负极的电极反应式为2Cu+H2O-2e-===Cu2O+2H+
D.在水泥固化过程中,自由水分子减少,溶液中各离子浓度的变化导致电动势变化
解析:工业上制备普通水泥的原料有石灰石、黏土、石膏,故A项正确;根据电池反应式2Cu+Ag2O===Cu2O+2Ag知,Ag2O/Ag极作正极,正极上Ag2O得电子,发生还原反应,故B项正确;根据电池反应式2Cu+Ag2O===Cu2O+2Ag知,铜失电子作负极,负极上的电极反应式为:2Cu+2OH--2e-===Cu2O+H2
O,C项错误;水泥固化过程中,自由水分子减少,导致溶液中各离子浓度发生变化,从而引起电动势变化,故D项正确。
答案:C
7.电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图。下列说法不正确的是( )
A.O2在电极b上发生还原反应
B.溶液中OH-向电极a移动
C.反应消耗的NH3与O2的物质的量之比为4:5
D.负极的电极反应式为2NH3-6e-+6OH-===N2+6H2O
解析:构成的原电池中,通入氧气的电极是正极,发生还原反应,A正确;溶液中阴离子氢氧根离子移向负极a极,B正确;1 mol NH3反应生成氮气转移3 mol电子,1 mol O2反应转移4 mol电子,根据电子守恒,消耗的NH3与O2的物质的量之比为4:3,C错误;负极的电极反应式为2NH3-6e-+6OH-===N2+6H2O,D正确。
答案:C
8.表面介导电池(SMCS)是一种新型充电电池,可使电动汽车的充电时间仅需几分钟,该电池的电极材料为金属锂和氧化石墨烯。下列有关说法中不正确的是( )
A.放电时,氧化石墨烯作正极
B.放电时,负极电极反应式为Li-e-===Li+
C.充电时,该电池是将电能转化为化学能
D.充电时,电解质溶液中的Li+从阴极迁移到阳极
解析:放电时相当于原电池,锂是活泼金属,因此放电时锂作负极,氧化石墨烯作正极,A正确;放电时,Li是负极,负极电极反应式为Li-e-===Li+,B正确;充电时相当于电解池,因此充电时,该电池是将电能转化为化学能,C正确;电解池中阳离子向阴极移动,所以充电时,电解质溶液中的Li+从阳极迁移到阴极,D错误。
答案:D
9.已知:锂离子电池的总反应为:LixC+Li1-xCoO2C+LiCoO2;锂硫电池的总反应为:2Li+SLi2S。
有关上述两种电池说法正确的是( )
A.锂离子电池放电时,Li+向负极迁移
B.锂硫电池充电时,锂电极发生还原反应
C.理论上两种电池的比能量相同
D.如图表示用锂离子电池给锂硫电池充电
解析:锂离子电池放电时Li+(阳离子)向正极迁移,A项错误;锂硫电池放电时负极反应为锂失去电子变为锂离子,发生氧化反应,则充电时,锂电极发生还原反应,B项正确;比能量是指参与电极反应的单位质量的电极材料放出电能的大小,二者的比能量不同,C项错误;充电时原电池的负极与电解池的阴极相连,故应为C与Li相连,D项错误。
答案:B
10.锌—空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH-+2H2O===2Zn(OH)。下列说法正确的是( )
A.充电时,电解质溶液中K+向阳极移动
B.充电时,电解质溶液中c(OH-)逐渐减小
C.放电时,负极反应为:Zn+4OH--2e-===Zn(OH)
D.放电时,电路中通过2 mol电子,消耗氧气22.4 L(标准状况)
解析:A项,充电时,电解质溶液中K+向阴极移动,错误;B项,充电时,总反应方程式为2Zn(OH)2Zn+O2+4OH-+2H2O,所以电解质溶液中c(OH-)逐渐增大,错误;C项,在碱性环境中负极Zn失电子生成的Zn2+将与OH-结合生成Zn(OH),正确;D项,O2~4e-,故电路中通过2 mol电子,消耗氧气0.5 mol,在标准状况体积为11.2 L,错误。
答案:C
11.微生物燃料电池因具有原料广泛、操作条件温和、资源利用率高、对环境无污染等特点而被人们重视,以用葡萄糖作底物的燃料电池为例,其正、负极反应式如下:
正极 6O2+24H++24e-12H2O
负极 C6H12O6+6H2O-24e-6CO2↑+24H+
则下列有关该电池的说法正确的是( )
A.该电池的工作环境是高温条件
B.葡萄糖(C6H12O6)在变化中失去电子,被还原
C.该电池的电解质溶液是强酸性溶液,如浓硫酸等
D.该电池的总反应式为C6H12O6+6O26CO2+6H2O
解析:题目中指出“条件温和”,A错误;葡萄糖(C6H12O6)在变化中失去电子,被氧化,B错误;选项C中浓硫酸会使有机物炭化,C错误;把正极和负极的反应式相加可以得出该电池的总反应式为C6H12O6+6O26CO2+6H2O,D正确。
答案:D
12.金属锂燃料电池是一种新型电池,比锂离子电池具有更高的能量密度。它无电时也无需充电,只需更换其中的某些材料即可,其工作示意图如图,下列说法正确的是( )
A.放电时,空气极为负极
B.放电时,电池反应为4Li+O2===2Li2O
C.有机电解液可以是乙醇等无水有机物
D.在更换锂电极的同时,要更换水性电解液
解析:A.放电时,Li极为负极,错误;B.放电时,电池反应为4Li+O2+2H2O=== 4LiOH,错误;C.因为有锂存在,就不能用乙醇,锂和乙醇反应,错误;D.水性电解液中有沉淀生成,所以在更换锂电极的同时,要更换水性电解液,正确,所以选D。
答案:D
13.一种微生物燃料电池如图所示,下列关于该电池说法正确的是( )
A.a电极发生还原反应
B.H+由右室通过质子交换膜进入左室
C.b电极上的电极反应式为2NO+10e-+12H+===N2↑
+6H2O
D.电池工作时,电流由a电极沿导线流向b电极
解析:在a电极苯酚生成CO2,被氧化,A项错误;阳离子向正极移动,即H+向b电极移动,B项错误;b电极为正极,NO得到电子生成N2,电极反应式为2NO+10e-+12H+===N2↑+6H2O,C项正确;a电极是负极,b电极是正极,电池工作时,电流由b电极沿导线流向a电极,D项错误。
答案:C
能力题
14.锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。回答下列问题:
(1)外电路的电流方向是由________极流向________极(填字母)。
(2)电池正极反应式为__________________________。
(3)是否可用水代替电池中的混合有机溶剂?______(填“是”或“否”),原因是____________________________。
解析:(1)结合所给装置图以及原电池反应原理,可知Li作负极材料,MnO2作正极材料,所以电子流向是从a→b,那么电流方向则是b→a。(2)根据题目中的信息“电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2”,所以正极的电极反应式为MnO2+e-+Li+===LiMnO2。(3)因为负极的电极材料Li是活泼的金属,能够与水发生反应,故不能用水代替电池中的混合有机溶剂。
答案:(1)b a
(2)MnO2+e-+Li+===LiMnO2
(3)否 电极Li是活泼金属,能与水反应
15.(1)PbSO4热激活电池可用作火箭、导弹的工作电源。基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca===CaCl2+Li2SO4+Pb。
①放电过程中,Li+向________填(“负极”或“正极”)移动。
②负极反应式为_______________________________________________。
③电路中每转移0.2 mol电子,理论上生成______g Pb。
(2)氨氧燃料电池具有很大的发展潜力。氨氧燃料电池工作原理如下图所示。
①a电极的电极反应式是________________________。
②一段时间后,需向装置中补充KOH,请依据反应原理解释原因是__________________________。
解析:(1)根据方程式,电路中每转移0.2 mol电子,生成0.1 mol Pb,即20.7 g。
(2)①a电极是通入NH3的电极,失去电子,发生氧化反应,所以该电极作负极,电极反应式是2NH3-6e-+6OH-===N2+6H2O;一段时间后,需向装置中补充KOH,是由于发生4NH3+3O2===2N2+6H2O反应,有水生成,使得溶液逐渐变稀,为了维持碱的浓度不变,所以要补充KOH。
答案:(1)①正极 ②Ca+2Cl--2e-===CaCl2 ③20.7
(2)①2NH3-6e-+6OH-===N2+6H2O
②由于发生4NH3+3O2===2N2+6H2O反应,有水生成,使得溶液逐渐变稀,所以要补充KOH