- 180.51 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
蚌埠田家炳中学2020-2021学年10月月考试卷
高二化学
考试时间:90分钟 试卷分值:100分
一、选择题(本题包括16小题,每小题3分,共48分)
1.“不用开水,不用火电,自热米饭真方便!”这是某品牌“自热米饭”的广告词。加热米饭的热量来自饭盒内贮存的某些特殊物质,当这些物质混合后就会发生剧烈的变化而释放出大量热量,则这些特殊物质最可能是( )
A.浓硫酸和水 B.生石灰和水
C.硝酸铵和水 D.烧碱和水
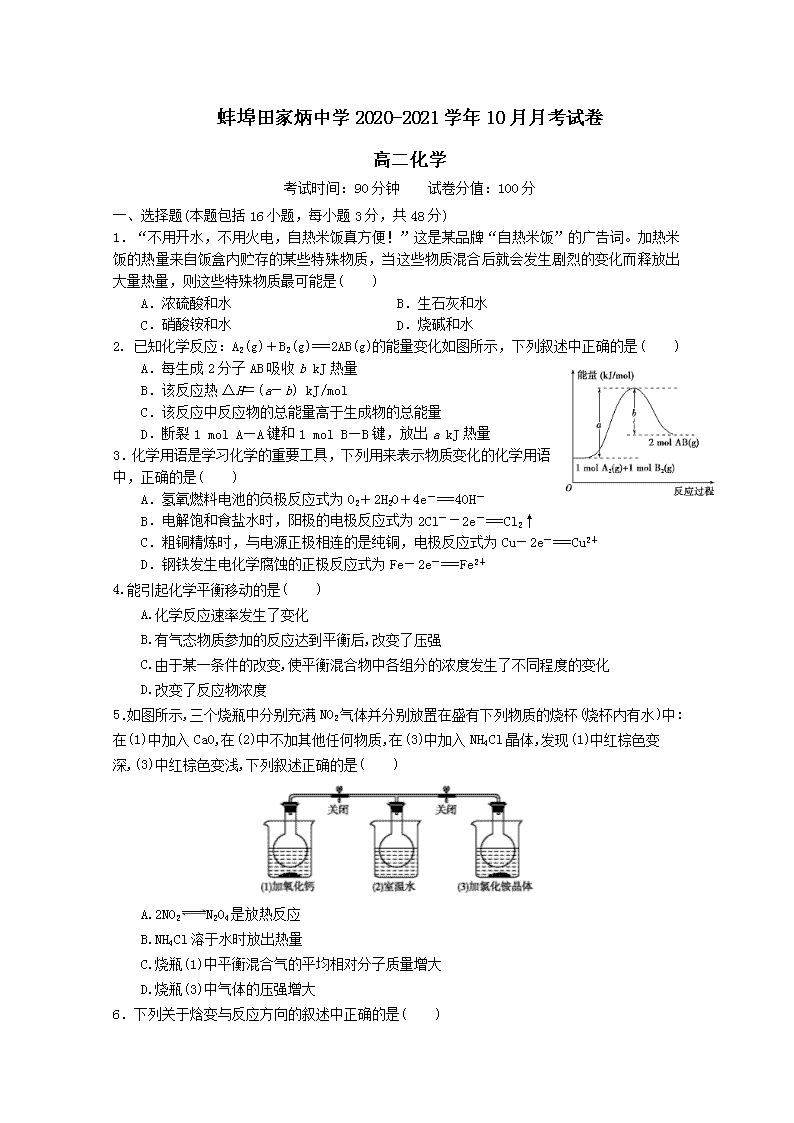
2. 已知化学反应:A2(g)+B2(g)===2AB(g)的能量变化如图所示,下列叙述中正确的是( )
A.每生成2分子AB吸收b kJ热量
B.该反应热ΔH=(a-b) kJ/mol
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A键和1 mol B—B键,放出a kJ热量
3.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.氢氧燃料电池的负极反应式为O2+2H2O+4e-===4OH-
B.电解饱和食盐水时,阳极的电极反应式为2Cl--2e-===Cl2↑
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为Cu-2e-===Cu2+
D.钢铁发生电化学腐蚀的正极反应式为Fe-2e-===Fe2+
4.能引起化学平衡移动的是( )
A.化学反应速率发生了变化
B.有气态物质参加的反应达到平衡后,改变了压强
C.由于某一条件的改变,使平衡混合物中各组分的浓度发生了不同程度的变化
D.改变了反应物浓度
5.如图所示,三个烧瓶中分别充满NO2气体并分别放置在盛有下列物质的烧杯(烧杯内有水)中:在(1)中加入CaO,在(2)中不加其他任何物质,在(3)中加入NH4Cl晶体,发现(1)中红棕色变深,(3)中红棕色变浅,下列叙述正确的是( )
A.2NO2N2O4是放热反应
B.NH4Cl溶于水时放出热量
C.烧瓶(1)中平衡混合气的平均相对分子质量增大
D.烧瓶(3)中气体的压强增大
6.下列关于焓变与反应方向的叙述中正确的是( )
A.反应的方向与化学反应的焓变无关
B.化学反应的焓变直接决定了反应的方向
C.反应焓变为正值时不利于反应自发进行
D.焓变为负值的反应都能自发进行
7.已知:(NH4)2CO3(s)NH4HCO3(s)+NH3(g) ΔH=+74.9 kJ·mol-1,下列说法正确的是( )
A.该反应是吸热反应,因此一定不能自发进行
B.该反应中熵变、焓变皆大于0
C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发
D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应
8.已知常温时红磷比白磷稳定:
4P(白磷,s)+5O2(g)===2P2O5(s)ΔH=-a kJ·mol-1
4P(红磷,s)+5O2(g)===2P2O5(s)ΔH=-b kJ·mol-1
若a、b均大于零,则a和b的关系为( )
A.a<b B.a=b
C.a>b D.无法确定
9.用石墨作为电极电解CuCl2和KCl的混合溶液,电解初期阴极和阳极析出的物质分别是( )
A.H2、Cl2 B.Cu、Cl2
C.H2、O2 D.Cu、O2
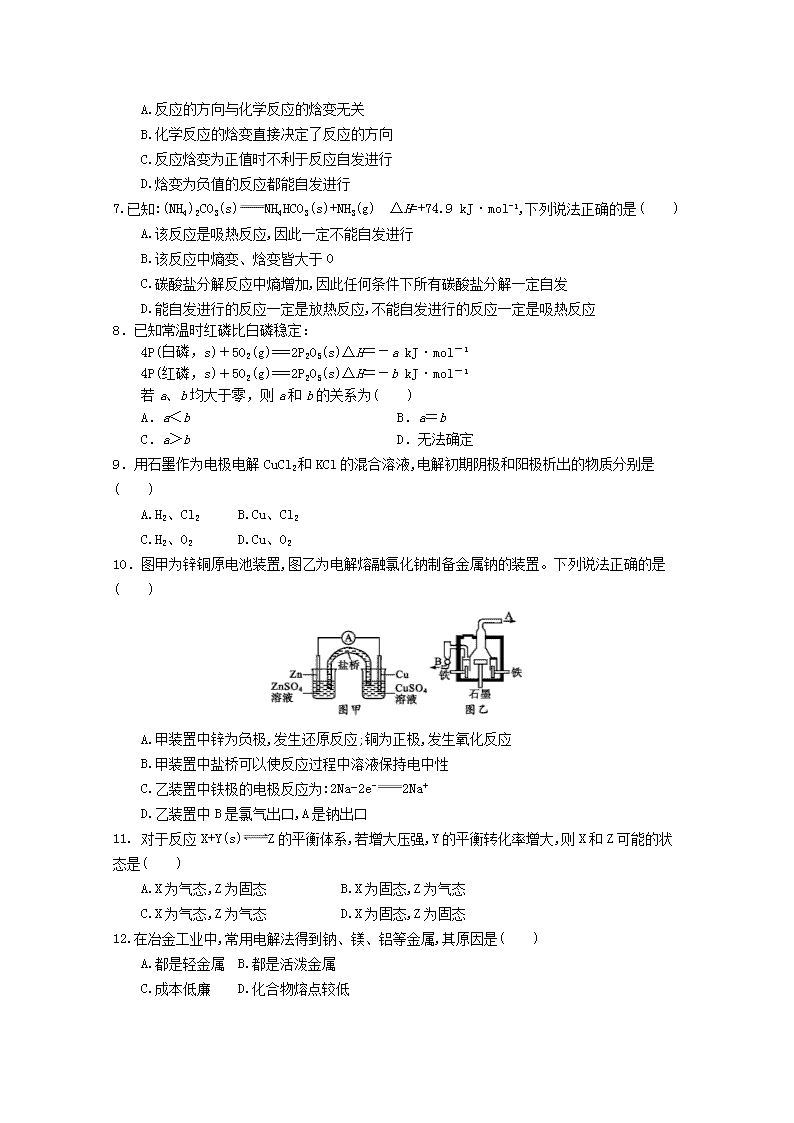
10.图甲为锌铜原电池装置,图乙为电解熔融氯化钠制备金属钠的装置。下列说法正确的是( )
A.甲装置中锌为负极,发生还原反应;铜为正极,发生氧化反应
B.甲装置中盐桥可以使反应过程中溶液保持电中性
C.乙装置中铁极的电极反应为:2Na-2e-2Na+
D.乙装置中B是氯气出口,A是钠出口
11. 对于反应X+Y(s)Z的平衡体系,若增大压强,Y的平衡转化率增大,则X和Z可能的状态是( )
A.X为气态,Z为固态 B.X为固态,Z为气态
C.X为气态,Z为气态 D.X为固态,Z为固态
12.在冶金工业中,常用电解法得到钠、镁、铝等金属,其原因是( )
A.都是轻金属 B.都是活泼金属
C.成本低廉 D.化合物熔点较低
13. 对下列过程的熵变的判断不正确的是( )
A.少量食盐溶解于水中:ΔS>0
B.单质碳和氧气反应生成CO(g):ΔS>0
C.水蒸气变成液态水:ΔS>0
D.CaCO3(s)加热分解为CaO(s)和CO2(g):ΔS>0
14.下列说法不正确的是( )
A.一次电池要回收利用防止污染
B.铅蓄电池是一次电池
C.二次电池又叫蓄电池,它放电后可以再充电使活性物质获得再生
D.燃料电池能量转化率高,活性物质由外界加入,可实现连续不间断供电
15. 下列关于充电电池的叙述,不正确的是( )
A.充电电池的化学反应原理是氧化还原反应
B.充电电池可以无限制地反复放电、充电
C.充电是使放电时的氧化还原反应逆向进行
D.较长时间不使用电器时,最好从电器中取出电池,并妥善存放
16.密闭容器中进行反应:M(g)+N(g)R(g)+2L(?),R的体积百分含量φ(R)随时间的变化情况如图所示,下列叙述正确的是( )
A.正反应吸热,L是气体 B.正反应吸热,L是固体或液体
C.正反应放热,L是气体 D.正反应放热,L是固体或液体
二、非选择题(本题包括5小题,共52分)
17.(6分)碳是形成化合物种类最多的元素,其单质及其化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
ΔH=88.6 kJ/mol
则M、N相比,较稳定的是________。
(2)已知CH3OH(l)的燃烧热为726.5 kJ·mol-1,CH3OH(l)+1/2O2(g)===CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a________726.5(填“>”“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:______________________________________。
18.(10分)依据甲、乙、丙三个图回答下列问题:
(1)甲装置为________,乙装置为________,丙装置为________。(填“原电池”“电镀池”或“精炼池”)
(2)甲、乙两装置中电极反应式分别为______、__________。
19.(12分) 在水溶液中橙红色的Cr2O72-与黄色的CrO42-有下列平衡关系: Cr2O72-+H2O2 CrO42-+2H+。把重铬酸钾(K2Cr2O7)溶于水配成的稀溶液是橙色的。
(1)向上述溶液中加入NaOH溶液,溶液呈 色,因为 。
(2)向已加入NaOH溶液的(1)溶液中再加入过量稀硫酸,则溶液呈 色,因为 。
(3)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡 (填“向左移动”或“向右移动”),溶液颜色将 。
20.(10分) 在密闭容器中投入一定量的A和B,发生反应:m A(g)+n B(g)p C(g)+q D(g)。
(1)若开始时加入A物质m mol,欲使A与B的转化率相等,则加入B物质 mol。
(2)相同的压强下,充入一定量的A、B后,在不同温度下C的体积分数φ(C)与时间的关系如图1所示。则T1 (填“>”“<”或“=”下同)T2,该反应正反应的ΔH 0.
(3) —定条件下,从正反应开始至达到化学平衡的过程中,混合气体的平均相对分子质量随时间的变化如图2所示,测得达到平衡时A、B、C、D的物质的量均为1mol。
①若在恒温、恒容的条件下,向该平衡体系中再通入A、B、C、D各1mol,则体系中气体的平均相对分子质量 (填“增大”“减小”“不变”或“无法确定”)。
②若在恒温、恒压的条件下,向该平衡体系中再通入A、B、C、D各1mol,则体系中气体的密度 (填“增大”“减小”“不变”或“无法确定”)。
21.(14分)(1)根据氧化还原反应2H2+O2===2H2O,设计成燃料电池根据选择电解质溶液的不同,填写下表:
电解质溶液
H2SO4溶液
KOH溶液
负极反应式
正极反应式
溶液的pH变化
(2)若把H2改为CH4,KOH作电解质,则正极反应式为________。
蚌埠田家炳中学2020-2021学年10月月考试卷
高二化学(答案)
一、选择题(本题包括16小题,每小题3分,共48分)
1
2
3
4
5
6
7
8
B
B
B
C
A
C
B
C
9
10
11
12
13
14
15
16
B
B
A
B
C
B
B
C
二、非选择题(本题包括5小题,共52分)
16. (6分) 答案:(1)M (2)< (3)2Cl2(g)+2H2O(g)+C(s)===4HCl(g)+CO2(g) ΔH=-290 kJ·mol-1
17. (10分)答案:(1)原电池 电镀池 精炼池 (2) Zn-2e-===Zn2+ Cu2++2e-===Cu
18. (12分)答案 (1)黄 OH-与H+结合生成水,使平衡向右移动,Cr浓度增大,溶液由橙色变为黄色
(2)橙 H+的浓度增大,平衡向左移动,Cr2的浓度增大,溶液又由黄色变为橙色
(3)向右移动 逐渐变浅,直至无色
19. (10分) 答案: 1.n; 2.>; >; 3.增大; 不变
20. (14分)答案:(1)见下表
电解质溶液
H2SO4溶液
KOH溶液
负极反应式
2H2-4e-===4H+
2H2+4OH--4e-===4H2O
正极反应式
O2+4H++4e-===2H2O
O2+2H2O+4e- ===4OH-
溶液的pH变化
变大
变小
(2)2H2O+O2+4e-===4OH-