- 1.31 MB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
石嘴山三中2020届高三第三次模拟考试
理科综合能力试卷
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,其中第II卷第33—38为选考题,其它题为必考题。考生作答时,将答案答在答题卡上,在本试卷上答题无效。考试结束后,将本试卷和答题卡一并交回。
注意事项:
1、答题前,考生务必先将自己的姓名、准考证号填写在答题卡上,认真核对条形码上的姓名、准考证号,并将条形码粘贴在答题卡指定位置上。
2、选择题答案使用2B铅笔填涂,如需改动,用橡皮擦擦干净后,再选涂其它答案标号;非选择题答案用0.5毫米的黑色中性(签字)笔或碳素笔书写,字体工整、笔迹清楚。
3、请按照题号在各题的答题区域(黑色线框)内作答,超出答题区域书写的答案无效。
4、保持卡面清洁,不折叠,不破损。
5、做选考题时,考生按照题目要求作答,并用2B铅笔在答题卡上把所选题目对应的题号涂黑。
可能用到的相对原子质量: C:12 H:1 O:16 N:14 Fe:56
第I卷(选择题 共126分)
一、选择题:(本题共13小题,每题6分,共78分。每小题只有一项符合题目要求)
7.化学与生产、生活、材料密切相关,下列说法正确的是
A. 食品工业以植物油和氢气为原料生产氢化植物油,发生了取代反应
B. 向鸡蛋清中加入饱和(NH4)2SO4溶液有沉淀析出,加水后沉淀溶解
C. 北斗导航卫星使用的太阳能电池板是将电能转化为化学能
D. 聚乙烯、聚氯乙烯都是高分子化合物,属于纯净物
8.设NA为阿伏加德罗常数的值,下列说法正确的是
A.1 mol白磷(P4)和1 mol甲烷中所含的共价键数均为4NA
B.标准状况下,22.4 L Cl2通入足量的NaOH溶液中,转移的电子数为NA
C.常温下,1 L 0.1 mol·L-1 NH4NO3溶液中所含的氢原子数为4NA
D.25℃时,0.5 mol·L-1 Na2S溶液中含有的阴离子数大于0.5NA
9.1,3二异丙烯基苯是工业上常用的交联剂,可用于制备高性能超分子聚合物,其结构如图所示。下列有关1,3二异丙烯基苯的说法错误的是
A.能发生加聚反应
B.与液溴混合后加入铁粉可发生取代反应
C.分子中所有碳原子可能处于同一平面
D.其一氯代物有6种
10. 短周期主族元素 W、X、Y、Z 的原子序数逐渐增大,四种元素形成的化合物甲的结构如图所示。且 W 与 X、Y、Z 均可形成电子数相等的分子,W 2 Z常温常压下为液体。下列说法正确的是
A. YW 3 分子中的键角为120°
B. W 2 Z 的稳定性大于YW 3
C. 1mol甲分子中存在2mol Y-W键
D. Y 元素的氧化物对应的水化物为强酸
11.我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:
3CO2+4Na 2Na2CO3+C 下列说法错误的是
A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e-=2 CO32-+C
D. 充电时,正极反应为:Na++e- = Na
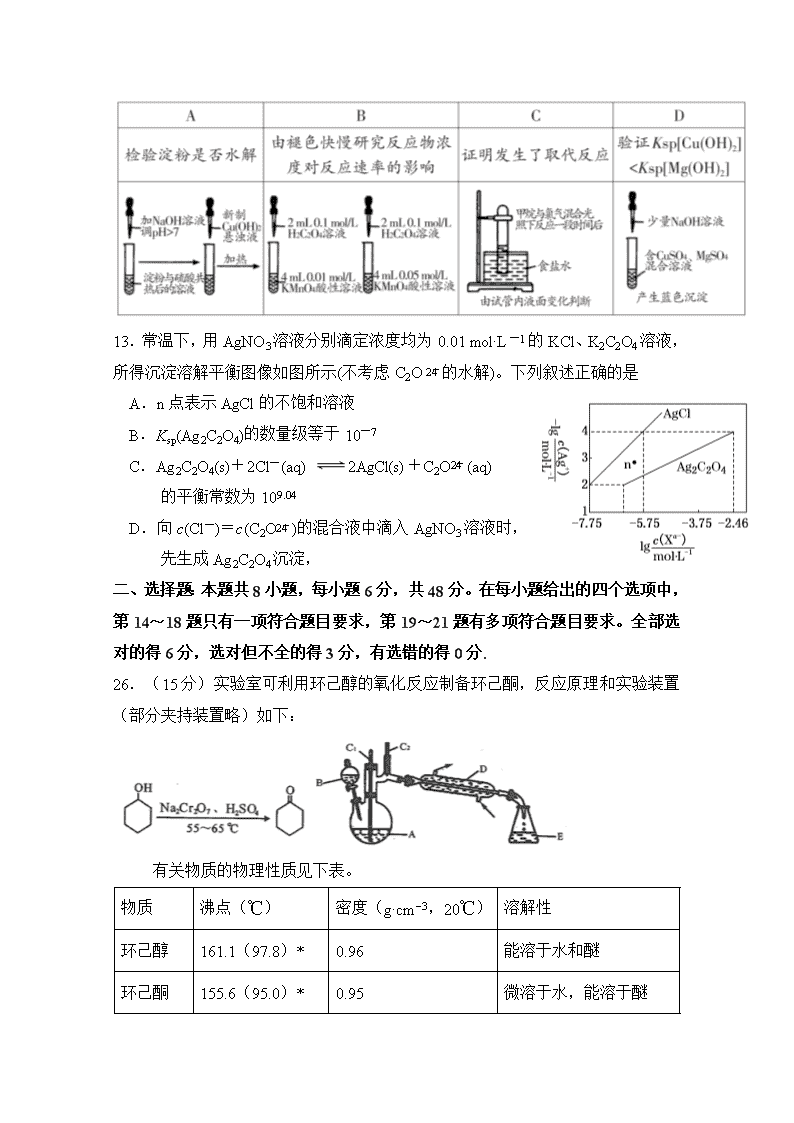
12. 下列方案设计能达到实验目的的是
13.常温下,用AgNO3溶液分别滴定浓度均为0.01 mol·L-1的KCl、K2C2O4溶液,所得沉淀溶解平衡图像如图所示(不考虑C2O的水解)。下列叙述正确的是
A.n点表示AgCl的不饱和溶液
B.Ksp(Ag2C2O4)的数量级等于10-7
C.Ag2C2O4(s)+2Cl-(aq) 2AgCl(s)+C2O(aq)
的平衡常数为109.04
D.向c(Cl-)=c(C2O)的混合液中滴入AgNO3溶液时,
先生成Ag2C2O4沉淀,
二、选择题:本题共8小题,每小题6分,共48分。在每小题给出的四个选项中,第14~18题只有一项符合题目要求,第19~21题有多项符合题目要求。全部选对的得6分,选对但不全的得3分,有选错的得0分.
26.(15分)实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略)如下:
有关物质的物理性质见下表。
物质
沸点(℃)
密度(g·cm−3,20℃)
溶解性
环己醇
161.1(97.8)*
0.96
能溶于水和醚
环己酮
155.6(95.0)*
0.95
微溶于水,能溶于醚
水
100.0
1.0
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验通过装置B将酸性Na2Cr2O7溶液加到盛有10mL环己醇的A中,55~60℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)装置D的名称为____________________________。
(2)酸性Na2Cr2O7溶液氧化环己醇反应的,反应剧烈将导致体系温度迅速上升,副反应增多。
①滴加酸性Na2Cr2O7溶液时反应的离子方程式______________________;
②蒸馏不能分离环己酮和水的原因是_________________________________。
(3)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏、除去乙醚后,收集151~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加入无水MgSO4固体,除去有机物中少量的水
①上述提纯步骤的正确顺序是______________________________________;
②b中水层用乙醚萃取的目的是________________________________;
③上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有_______,操作d中,加入NaC1固体的作用是____________。
(4)恢复至室温时,分离得到纯产品体积为6mL,则环已酮的产率____________。(计算结果精确到0.1%)
27.(14分)三氯化六氨合钴[Co(NH3)6]Cl3 是橙黄色、微溶于水的配合物,是合成其它一些含钴配合物的原料。下图是某科研小组以含钴废料(含少量Fe、Al 等杂质)制取[Co(NH3)6]Cl3 的工艺流程:
回答下列问题:
(1)写出加“适量NaClO3”发生反应的离子方程式______________。
(2)“加Na2CO3 调pH至a”会生成两种沉淀,分别为_________(填化学式)。
(3)操作Ⅰ的步骤包括_________________________、冷却结晶、减压过滤。
(4)流程中NH4Cl除作反应物外,还可防止加氨水时c(OH-) 过大,其原理是________。
(5)“氧化”步骤,甲同学认为应先加入氨水再加入H2O2,乙同学认为试剂添加顺序对产物无影响。你认为___________(填“甲”或“乙”)同学观点正确,理由是_______________。写出该步骤的化学方程式:_________________
(6)通过碘量法可测定产品中钴的含量。将 [Co(NH3)6]Cl3 转化成Co3+后,加入过量KI 溶液,再用Na2S2O3标准液滴定(淀粉溶液做指示剂),反应原理:2Co3++2I-=2Co2++I2,I2+2S2O32-=2I-+S4O62-,实验过程中,下列操作会导致所测钴含量数值偏高的是_______。
a.用久置于空气中的 KI 固体配制溶液
b.盛装Na2S2O3标准液的碱式滴定管未润洗
c.滴定结束后,发现滴定管内有气泡
d.溶液蓝色退去,立即读数
28.(14分)(1)乙基叔丁基醚(以ETBE表示)是一种性能优良的高辛烷值汽油调和剂。用乙醇与异丁烯(以IB表示)在催化剂HZSM-5催化下合成ETBE,反应的化学方程式为:C2H5OH(g)+IB(g) = ETBE(g) △H。回答下列问题:
反应物被催化剂HZSM-5吸附的顺序与反应历程的关系如上图所示,该反应的△H=__________ kJ·mol-1。反应历程的最优途径是________(填C1、C2或C3)。
(2)开发清洁能源是当今化工研究的一个热点问题。二甲醚(CH3OCH3
)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
1. CO(g)+2H2(g)CH3OH(g) ΔH1=-99kJ·mol−1
2. 2CH3OH(g)CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol−1
3. CO(g)+H2O(g)CO2(g)+H2(g) ΔH3=-41.2kJ·mol−1
①在该条件下,若反应1的起始浓度分别为:c(CO)=0.6mol·L−1,c(H2)=1.4mol·L−1,8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为__________。
②在t℃时,反应2的平衡常数为400,此温度下,在1L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
物质
CH3OH
CH3OCH3
H2O
c(mol·L−1)
0.46
1.0
1.0
此时刻v正___v逆(填“>”“<”或“=”),平衡时c(CH3OCH3)的物质的量浓度是___。
③催化反应室的总反应3CO(g)+3H2(g)CH3OCH3(g)+CO2(g),CO的平衡转化率α(CO)与温度、压强的关系如图一所示,图中X代表___(填“温度”或“压强”),且L1___L2(填“>”“<”或“=”)
图一 图二
④在催化剂的作用下同时进行三个反应,发现随着起始投料比的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图二的变化趋势。试解释投料比大于1.0
之后二甲醚产率和甲醇产率变化的原因: 。
29、(10分)为研究CO2浓度对水稻光合作用的影响,某实验小组测定自然环境中的CO2浓度和高浓度CO2对水稻净光合速率的变化如图所示(不考虑高浓度CO2对pH的影响),请回答:
(1)叶绿体是光合作用的场所,因为它内部巨大的膜表面分布_______________________。
(2)图中B应该对应曲线___________。依据是____________________ _________。
(3)比较曲线①和②的9:30 - 11:30的净光合速率,可得出的结论是________________。
(4)温度在一天中会发生变化,若要测定水稻一天中某一时段的光合速率,还要测定水稻的______________,若在白天进行该过程,需采取_____________措施。
30、(9分)人体血糖的相对稳定是神经系统和多种激素共同作用的结果。如图为人进食后,血液中胰岛素和胰高血糖素浓度的变化情况。请回答下列问题:
(1)图中曲线a、b分别表示______、______。
(2)当血糖升高时,下丘脑通过分泌______(填“神经递质”或“激素”)调节胰岛B细胞
的活动。某糖尿病患者体检时,发现体内的胰岛素含量正常,但其体内的血糖浓度却较高,可能的原因是 。
(3)有一种糖尿病,是因为患者体内某种T细胞过度激活为效应T细胞后,选择性地与胰岛B细胞密切接触,导致胰岛B细胞死亡而发病,这种糖尿病属于______病。患者______(填“能”或“不能”)用定期注射胰岛素的方法控制血糖。
(4)与体液调节相比,神经调节的特点有 (至少答2点)。
31、(8分)蝗灾,是指蝗虫引起的灾变。一旦发生蝗灾,大量的蝗虫会吞食禾田,使农产品完全遭到破坏,引发严重的经济损失以致因粮食短缺而发生饥荒。某课题组以新疆地区的某草原进行了相关的研究。回答下列问题:
(1)草原生态系统的结构包括 。
(2)“粉红椋鸟”被称为“草原蝗虫收割机”,主要以蝗虫为食。在蝗虫爆发的2公顷范围内,第一次捕获60只该鸟,全部标记后释放,半个月后进行第二次捕捉,在第二次捕获中,未标记的有80只,带标记的有30只,则该范围内粉红椋鸟的种群密度是___________。
(3)调查土壤中的小动物类群的丰富度常用________________进行采集。
(4)利用性引诱剂杀灭蝗虫属于________(填“化学”、“ 生物”、“ 机械”)防治。蝗虫数量一般______(填“会”或“不会”)影响直接或间接以它为食物的生物的数量,原因是_ ___。
32、(12分)果蝇的性染色体组成为XY型,其中R和r控制果蝇的红眼和白眼,B和b控制果蝇的刚毛和截毛.R、r和B、b两对基因位于性染色体上(如图乙).图甲中Ⅰ表示X和Y染色体的同源区段,在该区段上基因成对存在,Ⅱ和Ⅲ是非同源区段,在Ⅱ和Ⅲ上分别含有X和Y染色体所特有的基因.请回答下列问题。
(1)果蝇的B和b基因位于图甲中的 ______ (填序号)区段,R和r基因位于图甲中的 ______
(填序号)区段。
(2)在减数分裂时,图甲中的X和Y染色体之间有交叉互换现象的是 ______ (填序号)
区段。
(3)已知某一刚毛雄果蝇的体细胞中有B和b两种基因,请写出该果蝇可能的基因型,并设
计实验探究B和b在性染色体上的位置情况。
①可能的基因型: ____ __ 。
②设计实验:让该果蝇与截毛雌果蝇杂交,分析后代的表现型。
③预测结果和结论:
若后代中雌性个体全为刚毛,雄性个体全为截毛,说明 ;
若后代中雌性个体全为截毛,雄性个体全为刚毛,说明 。
(二)选考题:共45分。请考生从给出的2道物理题、2道化学题、2道生物题中每科任选一题作答,并用2B铅笔在答题卡上把所选题目的题号方框图黑。注意所做题目都题号必须与所涂题目的题号一致,在答题卡选定区域指定位置答题。如果不涂、多涂均按所答第一题评分;多答则每学科按所答的第一题评分。
33.[物理—选修3-3] (15分)
(1)(5分)关于热现象,下列说法正确的是________.
A.热量不能自发地从低温物体传到高温物体
B.物体速度增大,则组成物体的分子动能增大
C.物体的温度或者体积变化,都可能引起物体内能变化
D.相同质量的两个物体,升高相同温度,内能增加一定相同
E.绝热密闭容器中一定质量气体的体积增大,其内能一定减少
(2) (10分)如图所示,在粗细均匀的U形管右侧,用水银封闭一段长为L1=19 cm
、温度为T1=280 K的气体,稳定时,左右两管水银面高度差为h=6 cm.已知大气压强为p0=76 cmHg.
①给右管密闭气体缓慢加热,当右管内气体温度为多少时,两管水银面等高.
②若不给右管密闭气体加热,而是向左管缓慢补充水银,也可使两管水银面等高,求需补充水银柱的长度.
34.[物理—选修3-4](15分)
(1)(5分)一列简谐横波在t =0时刻的图象如图甲所示,此时,P、Q两质点的位移均为-1 cm,波上A质点的振动图象如图乙所示,则以下说法正确的是________.
A.这列波沿x轴负方向传播
B.这列波的波速是 m/s
C.从t=0.6 s开始,紧接着的Δt=0.6 s时间内,A质点通过的路程是10 m
D.从t=0开始,质点P比质点Q迟回到平衡位置
E.若该波在传播过程中遇到一个尺寸为10 m的障碍物,不能发生明显衍射现象
(2) (10分)如图所示为用某种透明材料制成的一块柱形棱镜的截面图,圆弧CD为半径为R=0.5 m的四分之一的圆周,圆心为O,已知AD= m,光线从AB面上的某点入射,入射角θ1=45°,它进入棱镜后射向O点,恰好不会从BC面射出.求:
①该棱镜的折射率n;
②光线在该棱镜中传播的时间t(已知光在空气中的传播速度c=3.0×108 m/s).
35.[化学—选修3:物质结构与性质](15分)
铁被称为“第一金属”,铁及其化合物在生产、生活中有广泛用途。
(1)铁原子核外电子发生跃迁时会吸收或X释放不同的光,可以用___________摄取铁元素的原子光谱。
(2)FeCl3的熔点为306℃,沸点为315℃。由此可知 FeCl3属于________晶体。
FeSO4常作净水剂和补铁剂,SO42-的立体构型是____________。
(3)铁氰化钾K3[Fe(CN)6] 是检验Fe2+的重要试剂。
①基态N原子的轨道表示式为___________。
②写出一种与铁氰化钾中配体互为等电子体的极性分子的化学式_______。
③铁氰化钾中,所涉及的元素的第一电离能由大到小的顺序为____________。
④铁氰化钾中,不存在___________(填字母标号)。
A.离子键 Bδ键 C π键 D氢键 E金属键
(4)有机金属配位化合物二茂铁[(C5H5)2Fe]是汽油中的抗震剂。分子中的大 π键可用符号表示,其中m代表参与形成大π键的原子数, n代表参与形成大π键的电子数(如苯分子中的大π键可表示为),则中的大π键应表示为________,其中碳原子的杂化方式为________。
(5)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。 1mol[Fe(CO)5]分子中含_____ molδ键。
(6)某种磁性氮化铁的结构如图所示,N随机排列在Fe构成的正四 面体空隙中。其中铁原子周围最近的铁原子个数为_____;六棱柱底边长为a cm,高为c cm,阿伏加德罗常数的值为NA,则该磁性氮化铁的晶体密度为_________ g/cm3(列出计算式)。
36.[化学—选修5:有机化学基础](15分)
光刻胶是一种应用广泛的光敏材料,其合成路线如下(部分试剂和产物略去):
(1)A的名称为________;羧酸X的结构简式为_______________________。
(2)C可与乙醇发生酯化反应,其化学方程式为___________________,反应中乙醇分子所断裂的化学键是________(填字母)。
a.C—C键 b.C—H键 c.O—H键 d.C—O键
(3)E→F的化学方程式为______________________;F→G的反应类型为________。
(4)写出满足下列条件的B的2种同分异构体:_______________、_____________。
①分子中含有苯环;
②能发生银镜反应;
③核磁共振氢谱峰面积之比为2∶2∶2∶1∶1。
(5)根据已有知识并结合相关信息,写出以CH3CHO为原料制备的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
CH3CH2BrCH3CH2OHCH3COOCH2CH3
37、 [生物——选修1:生物技术实践] (15分)
生物技术实践中会涉及微生物的筛选、物质的提取等内容。回答下列问题:
(1)从土壤中筛选纤维素分解菌时,所用培养基在成分上的特殊之处在于______。鉴别纤维
素分解菌所用的培养基中应加入刚果红染料,纤维素分解菌分泌的______能分解纤维素从而使培养基中出现透明圈。
(2)采用压榨法提取橘皮精油时,为了提高出油率,需要将新鲜的柑橘皮干燥去水,并用石灰水浸泡。其中石灰水的作用是______。将橘皮压榨后可得到糊状液体,为了获得乳状液,可以先用普通布袋______除去固体物和残渣,然后通过______进一步除去质量较小的残留固体物。
(3)使用鸡血提取DNA时,在鸡血细胞液中加入一定量的蒸馏水,目的是______。为了将DNA和蛋白质分离,可利用的原理有______、______(答出两点)。
38、 [生物——选修3:现代生物科技专题] (15分)
分析下列资料,回答问题。
我国全面放开二孩政策可缓解我国低生育率及人口老龄化带来的问题,“试管婴儿技术”可为不孕夫妇重新获得生育的机会。请回答下列问题:
(1)试管婴儿技术主要用到了胚胎工程中的 技术。(答出2项即可)
(2)自然条件下,当在 时,说明卵子已经完成了受精,这是判断
卵子是否受精的标志。为保证有可以移植的、有活力的胚胎,需要对女性进行超数排卵处理,一般需要注射______,使其排出更多的卵子。
(3)早期胚胎可以分为桑椹胚、囊胚以及______三个阶段。囊胚中的内细胞团将来发育成 。
(4)当胚胎发育到适宜阶段时,可将其取出向受体移植。该“试管婴儿”胚胎也可移植到代孕母体子宫中,其可以在代孕母体子宫中存活的关键因素是: 。
(5)如果是用体外受精的方法获得的胚胎,那么受精过程一般情况下都可以在______或专用的受精溶液中完成。早期的胚胎生命力旺盛,______(填“不存在”或“存在”)与细胞凋亡有关的基因。
2020届高三第三次模拟考试生物试题答案
1、D 2、C 3、B 4、A 5、D 6、B
29、(10分) 【答案】
(1)许多吸收光能的色素分子,还有许多进行光合作用所必须的酶(2分)
(2)①(2分) 在一定的光照强度范围内,二氧化碳浓度高,光合作用强度越大(2分) (3)适当提高光照强度和CO2浓度,可以提高净光合速率(2分)
(4)呼吸速率(1分) 遮光或黑暗(处理)(1分)
30、(9分)【答案】除标记外,每空1分
(1)胰高血糖素;胰岛素
(2)神经递质;胰岛素不能与靶细胞上的特异性受体结合(其他说法合理也可得分)(2分)
(3)自身免疫;能
(4)反应速度迅速;作用范围准确、比较局限;作用途径是反射弧;作用时间短暂(2分)
31、(8分)【答案】除标记外,每空1分
(1) 生态系统的组成成分和食物链和食物网(生态系统的营养结构)(2分)
(2)110只/公顷
(3)取样器取样法
(4) 生物;不会;蝗虫在食物链(或网)的位置还可以由(这个营养级的)其他(或多种)生物所代替(或取代)(2分)
32、(12分)【答案】每空2分
(1)Ⅰ;Ⅱ;(2)Ⅰ;
(3)①XBYb或XbYB ③B和b分别位于X和Y染色体上;B和b分别位于Y和X染色体上
37、(15分)[生物——选修1:生物技术实践]
【答案】除标记外,每空2分
(1)以纤维素为唯一碳源(1分) 纤维素酶
(2)破坏细胞结构,分解果胶,防止橘皮压榨时滑脱 过滤 离心
(3)使鸡血细胞破裂 DNA不溶于酒精溶液,而细胞中的某些蛋白质可溶于酒精 DNA和蛋白质在不同浓度的氯化钠溶液中溶解度不同
38、(15分)[生物——选修3:现代生物科技专题]
【答案】除标记外,每空2分
(1)体外受精技术、早期胚胎培养技术、胚胎移植(答出2点即可)
(2)卵细胞膜和透明带的间隙可以观察到两个极体 促性腺激素
(3)原肠胚(1分) 胎儿的各种组织
(4)受体对移入子宫的外来胚胎基本上不发生免疫排斥反应
(5)获能溶液 存在
化学答案
7 B 8B 9 D 10B 11D 12A 13C
26.答案:冷凝管 1分
2分
环己酮和水形成具有固定组成的恒沸物一起蒸发 2分
dbeca 2分
使水层中少量的有机物进一步被提取,提高产品的产量 2分
漏斗、 分液漏斗 2分(各一分)
降低环己酮的溶解度,增加水层的密度,有利于分层 2分
60.6% 2分
27.【答案】6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O 2分
Fe(OH)3 和 Al(OH)3 2分
HCl氛围下蒸发浓缩 2分
NH4Cl溶于水电离出NH4+会抑制后期加入的NH3·H2O的电离 2分
甲 1分 防止Co(OH)3的生成 1分
H2O2+2CoCl2+2NH4Cl+10NH3·H2O=2Co(NH3)6Cl3↓+12H2O 2分
ab 2分
28. 【答案】-4a 2分 C3 1分
0.075mol·L-1·min-1 2分(单位1分)
> 2分 1.2mol·L-1 2分 (单位1分)
温度 1分 > 2分
当投料比大于1时,随着c(H2)增大,反应①被促进,而反应③被抑制,c(H2O增大,最终抑制反应②,因此甲醇的产率继续增大而二甲醚的产率减小
2分
35.【答案】光谱仪; 1分
分子 1分; 正四面体形 1分;
; 1分
; 1分
;2分
;2分
2分; 1分;
;1分 ;。2分
36.
物理答案
14.A 15. C 16.A 17.D 18.C 19.BD 20.CD 21.BD
第Ⅱ卷(非选择题 共174分)
三、非选择题:共174分。第22~32题为必考题,每个试题考生都必须作答。第33~38题为选考题,考生根据要求作答。
(一)必考题:共129分。
22.(5分)【答案】 A 不是
23.(10分)
24.(14分)
【答案】解:由A到C根据机械能守恒定律可得:
解得:
在C点由牛顿第二定律得:
解得:
由牛顿第三定律可得物块经过C点时对轨道的压力大小;
物块滑上木板到刚好没有滑下木板,物块和木板组成的系统,不受外力,取向右为正,根据动量守恒定律可得:
解得:
物块滑上木板到刚好没有滑下木板,根据系统的能量关系得:
代入数据解得:。
25.(18分)【答案】解:设平行金属板M、N间匀强电场的场强为,
则有:
因为离子在金属板方向射入两板间,并做匀速直线运动
则有:
解得平行金属板M、N之间相距的距离为:;
在第一象限的电场中离子做类平抛运动,
则有:,
故离子运动到A点时的速度:
牛顿第二定律:
又
且,
解得离子在电场E中运动到A点所需时间:;
离子的运动轨迹如图:
在磁场中洛伦兹力提供向心力,则有:
解得:,
由几何知识可得,
又,
因此离子第一次离开第四象限磁场区域的位置C与坐标原点的距离为:,
由周期性可知,离子离开第四象限磁场区域位置C与坐标原点距离为:
即其中,1,2,。
答:平行金属板M、N之间相距的距离d为;
离子运动到A点时速度v的大小为,由P点运动到A点所需时间t为;
离子在x轴上离开第四象限磁场区域的位置图中未画出与坐标原点的距离OC为其中,1,2,。
(二)选考题:共45分。请考生从2道物理题、2道化学题、2道生物题中每科任选一题作答。如果多做,则每科按所做的第一题计分。
33.[物理——选修3-3](15分)
答案 (1)ACE (2)①352 K ②9 cm
解析 (1)①测得油膜面积S=260 cm2=2.6×10-2m2,每一滴油酸酒精溶液含有纯油酸的体积为:V=× mL=1.25×10-11 m3,所以油酸分子的直径d== m≈5×10-10 m.
②置于一个敞口容器中,如果时间偏长,酒精挥发,导致油酸浓度增大,因此导致测量值偏小.
(2)①加热前,对于封闭气体有:p1=p0-ρgh=70 cmHg
加热后,右管内气体压强为:p2=p0=76 cmHg
当两管内水银面等高时,右管内水银面下降高度为:=3 cm
由理想气体状态方程得:=
又L2=L1+3 cm=22 cm
代入数据解得:T2=352 K
②设补充水银后,右管内水银面上升x,管内气体长度为L1-x
由玻意耳定律有:p1SL1=p2S(L1-x)
解得:x=1.5 cm
注入水银柱的长度为:y=h+2x=9 cm
34.【选修3-4】(15分)
答案 (1)ABD (2)① ②×10-8 s
解析 (1)由题图乙读出t=0时刻质点A的速度方向为沿y轴正方向,由题图甲判断出波的传播方向为沿x轴负方向,故A正确;由图甲读出波长为λ=20 m,由乙图知周期T=1.2 s则波速为v== m/s= m/s,故B正确;Δt=0.6 s=0.5T,质点做简谐运动时在一个周期内质点A通过的路程为4倍振幅,则经过Δt=0.6 s,A质点通过的路程是:s=2A=4 cm,故C错误;图示时刻质点P沿y轴负方向运动,质点Q沿y轴正方向运动,所以质点P将比质点Q迟
回到平衡位置,将此图象与正弦曲线进行对比可知,P点的横坐标为xP= m,Q点的横坐标xQ= m,根据波形的平移法可知质点P比质点Q迟回到平衡位置时间为:t==0.4 s,故D正确;发生明显衍射现象的条件是障碍物的尺寸比波长小或跟波长差不多,该波的波长为20 m,故E错误.
(2)①光线在BC面上恰好发生全反射,入射角等于临界角C
sin C=
在AB界面上发生折射,折射角θ2=90°-C
由折射定律:n=
由以上几式解得:n=
②光在此棱镜中的速度:v==×108 m/s
路程:s=+R=0.8 m
所以:t==×10-8 s.