- 1.44 MB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
北京专家2020届高考模拟试卷(二)化学部分
1.化学与生活、科技、医药、工业生产均密切相关,下列有关化学叙述正确的是( )
A. 浓硫酸具有强腐蚀性,可用浓硫酸刻蚀石英制艺术品
B. 我国预计2020年发射首颗火星探测器太阳能电池帆板的材料是二氧化硅
C. 《本草经集注》中关于鉴别硝石(KNO3)和朴硝(Na2SO4)的记载:“以火烧之,紫青烟起,乃真硝石也”,该方法应用了焰色反应
D. 误食重金属盐引起的人体中毒,可喝大量的食盐水解毒
【答案】C
【解析】
氢氟酸刻蚀石英制艺术品,故A错误;太阳能电池帆板的材料是晶体硅,故B错误;钾元素的焰色是紫色,所以“以火烧之,紫青烟起,乃真硝石也”,故C正确;误食重金属盐引起的人体中毒,可喝大量的牛奶解毒,故D错误。
2.设表示阿伏加德罗常数的值,下列说法正确的是( )
A. 常温下的溶液中与数目均为
B. 葡萄糖和果糖的混合物中含羟基数目为
C. 与足量反应,生成和的混合物,Na失去个电子
D. 室温下,的溶液中,由水电离的数目为
【答案】B
【解析】
【详解】A.CH3COONH4溶液中CH3COO-与NH4+均要水解,其数目均小于NA,故A错误;
B.葡萄糖为五羟基醛,果糖为五羟基酮,二者互为同分异构体,摩尔质量均为180g/mol,故18g混合物的物质的量为=0.1mol,二者任意比例混合,所含羟基数目都是0.5NA,故B正确;
C.1mol Na与足量O2反应,无论生成什么产物,Na均变为+1价,故1mol钠均失去NA个电子,故C错误;
D.1LpH=13的NaOH溶液中,氢离子浓度为10-13mol/L,溶液中的氢离子由水电离产生,而水电离出的氢离子浓度和水电离出的氢氧根的浓度相同,因此溶液中水电离的
c(OH-)=10-13mol/L,故1L溶液中水电离出的氢氧根的个数为10-13NA个,故D错误;
故选B。
【点睛】本题的易错点为B,要注意葡萄糖和果糖的分子式相同,分子中均含有5个羟基。
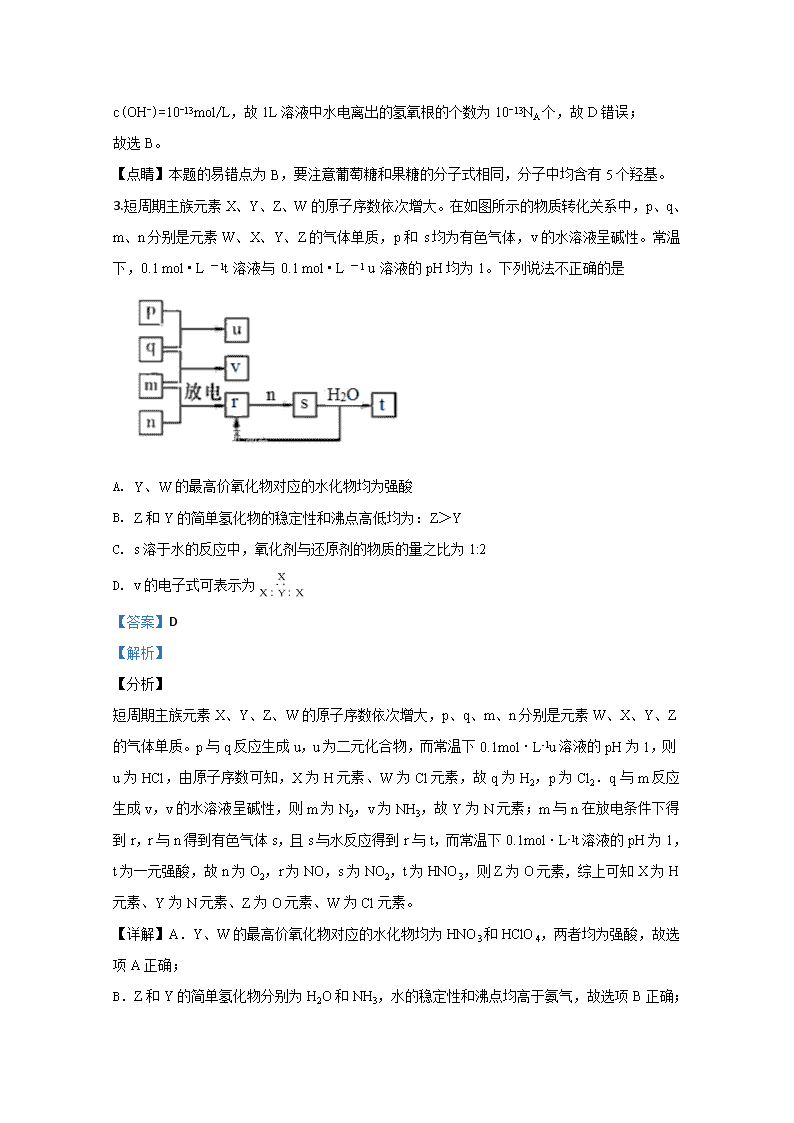
3.短周期主族元素X、Y、Z、W的原子序数依次增大。在如图所示的物质转化关系中,p、q、 m、n分别是元素W、X、Y、Z的气体单质,p和 s均为有色气体,v的水溶液呈碱性。常温下,0.1 mol • L -1t 溶液与 0.1 mol • L -1 u 溶液的pH均为1。下列说法不正确的是
A. Y、W的最高价氧化物对应的水化物均为强酸
B. Z和Y的简单氢化物的稳定性和沸点高低均为:Z>Y
C. s溶于水的反应中,氧化剂与还原剂的物质的量之比为1:2
D. v的电子式可表示为
【答案】D
【解析】
【分析】
短周期主族元素X、Y、Z、W的原子序数依次增大,p、q、m、n分别是元素W、X、Y、Z的气体单质。p与q反应生成u,u为二元化合物,而常温下0.1mol·L-1u溶液的pH为1,则u为HCl,由原子序数可知,X为H元素、W为Cl元素,故q为H2,p为Cl2.q与m反应生成v,v的水溶液呈碱性,则m为N2,v为NH3,故Y为N元素;m与n在放电条件下得到r,r与n得到有色气体s,且s与水反应得到r与t,而常温下0.1mol·L-1t溶液的pH为1,t为一元强酸,故n为O2,r为NO,s为NO2,t为HNO3,则Z为O元素, 综上可知X为H元素、Y为N元素、Z为O元素、W为Cl元素。
【详解】A.Y、W的最高价氧化物对应的水化物均为HNO3和HClO4,两者均为强酸,故选项A正确;
B.Z和Y的简单氢化物分别为H2O和NH3,水的稳定性和沸点均高于氨气,故选项B正确;
C.s为NO2,3NO2+ H2O= 2HNO3+ NO,氧化剂与还原剂的物质的量之比为1:2,故选项C正确;
D.v为NH3,其电子式可表示为 ,故选项D错误;
故选D。
【点睛】本题考查无机物的推断,注意气体的颜色及溶液的pH为推断的突破口,再结合转化关系推断,熟练掌握元素化合物知识。
4.下列关于有机物的说法正确的是
A. 乙醇和丙三醇互为同系物
B. 二环己烷( )的二氯代物有7种结构(不考虑立体异构)
C. 按系统命名法,化合物的名称是2,3,4-三甲基-2-乙基戊烷
D. 环己烯()分子中的所有碳原子共面
【答案】B
【解析】
【详解】A.乙醇和丙三醇所含羟基的个数不同,不是同系物,故选项A错误;
B.二环己烷中有两类氢原子,当一个氯原子定到1号位,二氯代物有3种,当一个氯原子定到2号位,二氯代物有4种,故选项B正确;
C.按系统命名法,化合物的名称是2,3,4,4-四甲基己烷,故选项C错误;
D.环己烯中碳原子有sp2和sp3两种杂化方式,不能满足所有碳原子共面,故选项D错误;
故选B。
5.如图是一种综合处理SO2废气的工艺流程。下列说法正确的是
A. 溶液酸性:A>B>C
B. 溶液B转化为溶液C发生反应的离子方程式为4H++2Fe2++O2 =2Fe3++2H2O
C. 向B溶液中滴加KSCN溶液,溶液可能会变为红色
D. 加氧化亚铁可以使溶液C转化为溶液A
【答案】C
【解析】
【分析】
由流程图可知,A到B过程发生的反应为Fe2(SO4)3+SO2+2H2O= 2FeSO4+ 2H2SO4,B到C发生的反应为4 FeSO4+2H2SO4+O2=4 Fe2(SO4)3+2H2O。
【详解】A.由于A到B过程中生成H2SO4,酸性增强,B到C过程中消耗H+,酸性减弱,溶液酸性B最强,故选项A错误;
B.溶液B转化为溶液C发生反应的离子方程式为4H++4Fe2++O2=4Fe3++2H2O,故选项B错误;
C.溶液A中通入SO2的反应为:Fe2(SO4)3+SO2+2H2O= 2FeSO4+ 2H2SO4,Fe3+没有完全转化,则滴加KSCN溶液,溶液会变为红色,故选项C正确;
D.溶液C中成分为Fe2(SO4)3和H2SO4,加入氧化亚铁,生成产物仍未Fe2+,故选项D错误;
故选C。
6.控制变量是科学研究重要方法。由下列实验现象一定能得出相应结论的是
选项
A
B
C
D
装置图
现象
右边试管产生气泡较快
左边棉球变棕黄色,右边棉球变蓝色
B中产生白色沉淀,C中溶液颜色褪去
试管中液体变浑浊
结论
催化活性:Fe3+>Cu2+
氧化性:Br2>I2
硫酸亚铁铵分解的产物中除NH3外还含有SO3 和SO2
非金属性:C>Si
A. A B. B C. C D. D
【答案】A
【解析】
【详解】A.氯离子浓度相同时,Fe3+浓度小,但产生的气泡速度快,催化活性:Fe3+>Cu2+,故选项A正确;
B.氯气过量条件下,也能与KI溶液反应,无法判断Br2能否与KI溶液反应,故选项B错误;
C.硫酸亚铁铵分解的产物中含有SO2,硫元素化合价降低被还原,由氧化还原反应规律可知,铵根离子中的氮元素化合价升高被氧化,发生还原反应生成氮气,则分解产物中应该含有氮气,故选项C错误;
D.盐酸为挥发性酸,挥发的HCl也能与Na2SiO3溶液反应,干扰二氧化碳与硅酸钠溶液的反应,不能证明非金属性:C>Si,故选项D错误;
故选A。
7.常温下,用溶液分别滴定浓度均为的、溶液,所得的沉淀溶解平衡图像如图所示(不考虑的水解,),下列说法正确的是( )
A. 的数量级等于
B. n点表示的不饱和溶液
C. 向的混合液中滴入溶液时,先生成沉淀
D. 的平衡常数为
【答案】D
【解析】
【详解】A.根据图象,当=4,即c(Ag+)=10-4mol/L时,c(C2O42-)=10-2.46mol/L,Ksp(Ag2C2O4)=c2(Ag+)•c(C2O42-)=(10-4)2×(10-2.46)=10-10.46,数量级为10-11,故A错误;
B.在n点,c(Ag+)大于平衡浓度,故n点的浓度积Qc(AgCl)>Ksp(AgCl),为氯化银的过饱和溶液,将有沉淀析出,故B错误;
C.根据图象可知,当阴离子浓度相同时,生成AgCl沉淀所需的c(Ag+)小,因此向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先析出氯化银沉淀,故C错误;
D.Ag2C2O4+2C1-═2AgCl+C2O42-的平衡常数K=,此时溶液中的c(Ag+)相同,故有:K===109.04,故D正确;
故选D。
【点睛】正确解读图象中的数据是解题的关键。本题的易错点为B,要注意越小,c(Ag+)越大,n点,c(Ag+)大于平衡浓度,不是小于平衡浓度。
8.肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4·H2O)。
已知:N2H4·H2O高温易分解,易氧化
制备原理:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl
【实验一】 制备NaClO溶液(实验装置如图所示)
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外,还有_____(填标号)
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2)锥形瓶中发生反应化学程式是_____________________________。
【实验二】 制取水合肼。(实验装置如图所示)
控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内溶液,收集108-114馏分。
(3)分液漏斗中的溶液是____________(填标号)。
A.CO(NH2)2溶液 B.NaOH和NaClO混合溶液
选择的理由是____________。蒸馏时需要减压,原因是______________。
【实验三】 测定馏分中肼含量。
(4)水合肼具有还原性,可以生成氮气。测定水合肼的质量分数可采用下列步骤:
a.称取馏分5.000g,加入适量NaHCO3固体(保证滴定过程中溶液的pH保持在6.5左右),配制1000mL溶液。
b.移取10.00 mL于锥形瓶中,加入10mL水,摇匀。
c.用0.2000mol/L碘溶液滴定至溶液出现______________,记录消耗碘的标准液的体积。
d.进一步操作与数据处理
(5)滴定时,碘的标准溶液盛放在______________滴定管中(选填:“酸式”或“碱式”)水合肼与碘溶液反应的化学方程式________________________。
(6)若本次滴定消耗碘的标准溶液为8.20mL,馏分中水合肼(N2H4·H2O)的质量分数为______。
【答案】 (1). BD (2). Cl2+2NaOH=NaClO+NaCl+H2O (3). B (4). 如果次氯酸钠溶液装在三颈烧瓶中,生成的水合肼会被次氯酸钠氧化 (5). 减压蒸馏可使产品在较低温度下气化,避免高温分解 (6). 淡黄色且半分钟不消失 (7). 酸式 (8). N2H4·H2O + 2I2 = N2↑+ 4HI + H2O (9). 82.00%
【解析】
【分析】
(1)配制一定质量分数的溶液时,具体步骤是计算、称量、溶解,NaOH固体时需要放在烧杯中称,量取水时需要量筒,溶解时需要烧杯、玻璃棒;
(2)氯气通入到盛有NaOH的锥形瓶中与NaOH发生反应生成氯化钠、次氯酸钠和水;
(3)依据制取水合肼(N2H4·H2O)的反应原理为:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl,结合反应产物和反应物分析判断;水合肼(N2H4·H2O)具有还原性,易被次氯酸钠氧化;
(4)根据反应原理确定反应终点;
(5)根据碘溶液性质确定所用仪器;
(6)根据N2H4·H2O + 2I2 = N2↑+ 4HI + H2O进行计算。
【详解】(1)配制一定质量分数的溶液时,溶解时需要烧杯、玻璃棒,故答案为:BD;
(2)锥形瓶中氯气和NaOH反应生成氯化钠、次氯酸钠和水,反应的化学方程式为Cl2+2NaOH=NaClO+NaCl+H2O,故答案为:Cl2+2NaOH=NaClO+NaCl+H2O;
(3)水合肼(N2H4·H2O)中氮元素为—2价,具有还原性,若次氯酸钠过量,具有强氧化性的次氯酸钠会氧化水合肼,为防止水合肼被氧化,分液漏斗中的溶液应是NaOH和NaClO混合溶液;水合肼高温易分解,减压会降低物质的沸点,则为防止水合肼分解需要减压蒸馏,故答案为:B;如果次氯酸钠溶液装在烧瓶中,反应生成的水合肼会被次氯酸钠氧化;馏分高温易分解,减压会降低物质的沸点;
(4)根据反应N2H4·H2O + 2I2 = N2↑+ 4HI + H2O,终点时碘过量,用0.2000mol/L碘溶液滴定至溶液出现淡黄色且半分钟不消失,记录消耗碘的标准液的体积,故答案为:淡黄色且半分钟不消失;
(5)滴定时,碘具有强氧化性,会腐蚀橡胶管,则碘的标准溶液盛放在酸式滴定管中,故答案为:酸式;
(6)由题意可知,水合肼与碘溶液反应生成氮气、碘化氢和水,反应的化学方程式为N2H2·H2O+2I2=N2↑+4HI+H2O,由方程式可知n(N2H2·H2O)=0.2000mol·L-1×0.0082L×=0.00082mol,250ml溶液中含有的物质的量=0.00082mol× =0.082mol,水合肼(N2H2·H2O)的质量分数= ×100%=82%,故答案为:N2H4·H2O + 2I2 = N2↑+ 4HI + H2O ;82%。
【点睛】水合肼(N2H4·H2O)中氮元素为—2价,具有还原性,若次氯酸钠过量,具有强氧化性的次氯酸钠会氧化水合肼是解答关键,也是易错点。
9.苯乙烯是一种重要的化工原料,可采用乙苯催化脱氢法制备,反应如下: (g) (g)+H2(g) △H=+17.6kJ/mol。
(1)从温度和压强角度分析提高乙苯平衡转化率可采取的措施有___________。
(2)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:4),测得容器总压和乙苯转化率随时间变化结果如图所示。
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实__________。
平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数)
②反应速率V=V正-V逆=k正P乙苯-k逆p苯乙烯p氢气,k正、k逆分别为正逆反应速率常数。计算a处的______。
(3)CO2气氛下乙苯催化脱氢可同时存图1两种途径:
①b=_______kJ/mol。
②途径I的反应历程图所示,下列说法正确的是______________。
a.CO2为氧化剂
b.状态1到状态2形成了O-H键
c.中间产物只有()
d.该催化剂可提高乙苯的平衡转化率
③在相同的容器中,不同p(CO2)的条件下,进行相同的反应时间,p(CO2)与乙苯转化率关系如图,分析,p(CO2)为15kPa时乙苯转化率最高的因____________________。
【答案】 (1). 升温、降压 (2). 乙苯蒸气中掺混水蒸气,可以达到减小乙苯蒸气分压的作用,减压有利于平衡正向移动,可以提高乙苯的平衡转化率 (3). 45 (4). 2.5 (5). 59.2 (6). a、b (7). p(CO2)压强增大,反应速率加快,乙苯转化率增多,当p(CO2)大于15kPa,由于催化剂表面有限,能吸附的乙苯量下降,反应速率减慢,乙苯转化率下降
【解析】
【分析】
(1)(g) (g)+H2(g) △H=+17.6kJ/mol是吸热反应,又是气体体积增大的反应;
(2)气体体积增大的反应,利用减小压强,平衡正向移动;根据反应三段式分析计算;
反应速率v=v正-v逆=k正p乙苯-k逆p苯乙烯p氢气,则v正=k正p乙苯,v逆=k逆p苯乙烯p氢气,平衡时v正=v逆,即k正p乙苯-k逆p苯乙烯p氢气,所以计算;
(3)①由图片可知b=17.6J/mol+41.6J/mol;
②反应过程中CO2转化为CO,C的化合价降低,被还原;状态1到状态2过程中在催化剂表面生成了”HO-C=O“和等中间产物;催化剂可加快反应速率,但不影响反应进程;
③由反应途径I图片可知乙苯催化脱氢被催化剂吸附,在催化剂表面进行,随着CO2压强增大,反应物浓度增大,反应速率加快,但压强过大时,会导致催化剂吸附乙苯的机能降低,乙苯平衡转化率反而降低。
【详解】(1)(g) (g)+H2(g) △H=+17.6kJ/mol是气体体积增大的吸热反应,升高温度和减小压强,平衡向正反应方向移动,则提高乙苯平衡转化率可采取的措施有升温、降压,故答案为:升温、降压;
(2)①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实乙苯蒸气中掺混水蒸气,可以达到减小乙苯蒸气分压的作用,减压有利于平衡正向移动,可以提高乙苯的平衡转化率。
原料气中乙苯和水蒸气的物质的量之比为1:4,根据PV=nRT,其它条件相同时,物质的量之比等于压强比,原料气中P水蒸气=80Kpa,P乙苯=20Kpa,平衡时P乙苯=20Kpa(1-75%)=5Kpa,P苯乙烯=20Kpa×75%=15Kpa,P氢气=20Kpa×75%=15Kpa,平衡常数Kp==45kPa,故答案为:45;
②反应速率V=V正-V逆=k正P乙苯-k逆p苯乙烯p氢气,k正、k逆分别为正逆反应速率常数,a处的,故答案为:2.5;
(3)①由盖斯定律可知b=17.6J/mol+41.6J/mol= 59.2kJ/mol,故答案:59.2;
②a.反应过程中CO2转化为CO,C的化合价降低,被还原,是氧化剂,故a正确;
b.状态1到状态2过程中在催化剂表面生成了”HO-C=O“等中间产物,形成了O-H键,故b正确;
c.状态1到状态2过程中在催化剂表面生成了”HO-C=O“和等中间产物,故c错误;
d.催化剂可加快反应速率,但不影响反应进程,故d错误;
ab正确,故答案为:ab;
③在相同的容器中,不同p(CO2)的条件下,进行相同的反应时间,p(CO2)与乙苯转化率关系如图3,p(CO2)为15kPa时乙苯转化率最高的原因:p(CO2)压强增大,反应速率加快,乙苯转化率增多,当p(CO2)大于15kPa,由于催化剂表面有限,能吸附的乙苯量下降,反应速率减慢,乙苯转化率下降,故答案为:p(CO2)压强增大,反应速率加快,乙苯转化率增多,当p(CO2)大于15kPa,由于催化剂表面有限,能吸附的乙苯量下降,反应速率减慢,乙苯转化率下降。
10.铁、镍及其化合物在工业上有广泛的应用。从某矿渣[成分为NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等]中回收NiSO4的工艺流程如下:
已知(NH4)2SO4在350℃分解生成NH3和H2SO4,回答下列问题:
(1)“浸渣”的成分有Fe2O3、FeO(OH)、CaSO4外,还含有___________(写化学式)。
(2)矿渣中部分FeO焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为_______________。
(3)向“浸取液”中加入NaF以除去溶液中Ca2+(浓度为1.0×10-3mol·L-1),当溶液中c(F-)=2.0×10-3mol·L-1时,除钙率为______________[Ksp(CaF2)=4.0×10-11]。
(4)溶剂萃取可用于对溶液中的金属离子进行富集与分离:。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为______。在___________(填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。
(5)以Fe、Ni为电极制取Na2FeO4的原理如图所示。通电后,在铁电极附近生成紫红色的FeO42-,若pH过高,铁电极区会产生红褐色物质。
①电解时阳极的电极反应式为________________,离子交换膜(b))为______(填“阴”或“阳”)离子交换膜。
②向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。该反应的离子方程式为_____。
【答案】 (1). SiO2 (2). 4FeO+6H2SO4+O2=2Fe2(SO4)3+6H2O (3). 99% (4). 0.25 (5). 强酸性 (6). Fe-6e-+8OH-=FeO42-+4H2O (7). 阴 (8). 2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O
【解析】
【分析】
某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,加入硫酸铵研磨后,600℃焙烧,已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3,在90°C的热水中浸泡过滤得到浸出液,加入NaF除去钙离子,过滤得到滤液加入萃取剂得到无机相和有机相,无机相通过一系列操作得到硫酸镍,有机相循环使用,据此分析解答。
【详解】某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,加入硫酸铵研磨后,600°C焙烧,已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3,在90°C的热水中浸泡过滤得到浸出液,加入NaF除去钙离子,过滤得到滤液加入萃取剂得到无机相和有机相,无机相通过一系列操作得到硫酸镍,有机相循环使用。
(1)矿渣主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,加入硫酸铵加热浸取后的浸渣为不反应和不溶于水的硫酸钙和二氧化硅,“浸渣”的成分除Fe2O3、FeO(OH)、CaSO4外,还含有SiO2;
(2)矿渣中部分FeO焙烧时与H2SO4及空气中的氧气反应生成Fe2(SO4)3和水,反应的化学方程式为4FeO+6H2SO4+O2=2Fe2(SO4)3+6H2O;
(3)当溶液中c(F-)=2.0×10-3mol·L-1时,Ksp(CaF2)=c(Ca2+)×c2(F-)= c(Ca2+)×(2.0×10-3mol·L-1)2=4.0×10-11,故c(Ca2+)=1.0×10-5mol/L,则除钙率为99%;
(4)要求Fe2+萃取率最低,Ni2+的萃取率最高,根据图象,最佳取值为0.25;在强酸性介质中“反萃取”能使有机相再生而循环利用;
(5)①电解时正极连接铁电极,为阳极,阳极上失电子在碱性条件下反应生成FeO42-,电极反应式为Fe-6e-+8OH-=FeO42-+4H2O
;离子交换膜(b))允许氢氧根离子向Ⅲ移动,为阴离子交换膜;
②向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。次氯酸钠将氢氧化铁氧化生成高铁酸钠,反应的离子方程式为2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O。
【点睛】本题考查了物质分离提纯、物质制备、离子方程式书写、溶度积常数计算等知识点,掌握基础是解题关键,题目难度中等。
[化学——选修3:物质结构与性质]
11.大型客机燃油用四乙基铅[Pb(CH2CH3)4])做抗震添加剂,但皮肤长期接触四乙基铅对身体健康有害,可用硫基乙胺(HSCH2CH2NH2)和KMnO4清除四乙基铅。
(1)碳原子核外电子的空间运动状态有______种,基态锰原子的外围电子排布式为___,该原子能量最高的电子的电子云轮廓图形状为________。
(2)N、C和Mn电负性由大到小的顺序为____________。
(3)HSCH2CH2NH2中C的杂化方式为_____,其中NH2-空间构型为____;N和P的价电子相同,但磷酸的组成为H3PO4,而硝酸的组成不是H3NO4,其原因是_______。
(4)Pb(CH2CH3)4是一种难电离且易溶于有机溶剂的配合物,其晶体类型属于_____晶体。已知Pb(CH2CH3)4晶体的堆积方式如下。
Pb(CH2CH3)4]在xy平面上的二维堆积中的配位数是___,A分子的坐标参数为_____;设阿伏加德罗常数为NA/mol,Pb(CH2CH3)4]的摩尔质量为Mg/mol,则Pb(CH2CH3)4]晶体的密度是_____g/cm3 (列出计算式即可)。
【答案】 (1). 6 (2). 3d54s2 (3). 球形 (4). N>C>Mn (5). sp3 (6). V型 (7). N原子半径较小,不能容纳较多的原子轨道,故不能形成H3NO4 (8). 分子 (9). 6 (10). (11).
【解析】
【分析】
(1)原子核外电子运动状态和该原子的核外电子数相等,原子序数为27的锰元素基态原子的外围电子排布式为3d54s2,据此可以得出锰元素在周期表中的位置是第四周期第ⅤⅡB族,能量最高的电子是4s2电子,4s电子的电子云轮廓图为球形;
(2)电负性是金属性与非金属性定量描述的一个物理量,元素的非金属性越强,往往其电负性越大,根据元素周期表中元素非金属性(或电负性)的递变规律,同周期从左到右元素电负性增大;
(3)HSCH2CH2NH2分子中,C形成4个共价键,它们价层电子对数为4对,其杂化方式为sp3,在-NH2中N有两个单键,一对孤对电子和一个单电子,因为单电子也需要占用一个轨道,所以N的价层电子对数依然可以视为4对,其杂化方式也为sp3,考虑配位原子只有两个H,所以其空间构型为平面三角形,N和P为同族元素,其价层电子数相同,通常情况下其成键方式相同,但是由于N原子半径小于P,N原子周围空间无法容纳4个氧原子成键;
(4)题目信息,Pb(CH2CH3)4是一种难电离且易溶于有机溶剂的配合物,可知其晶体类型为分子晶体,这一点也可以从Pb(CH2CH3)4晶体的堆积方式得到结论,Pb(CH2CH3)4晶体堆积方式为六方密堆积,所以在xy平面上的二维堆积中也采取二维最密堆积即配位数为6,由堆积图可知每个晶胞中包含2个Pb(CH2CH3)4分子,所以每一个晶胞的质量为g,再结合晶胞参数,长方体的棱边长度,计算得到晶胞的体积为cm3,则Pb(CH2CH3)4晶体的密度= 。
【详解】(1)碳原子核外电子排布为1s22s22p2,核外电子的空间运动状态有6种,原子序数为27的锰元素基态原子的外围电子排布式为3d54s2,据此可以得出锰元素在周期表中的位置是第四周期第ⅤⅡB族,能量最高的电子是4s2电子,值得注意的是,教材上提供的构造原理是原子填充顺序规则,并不代表电子的能量高低,在金属元素的原子中,最易失去的电子才是该原子能量最高的电子,4s电子的电子云轮廓图为球形,故答案为:6;3d54s2;球形;
(2)电负性是金属性与非金属性定量描述的一个物理量,元素的非金属性越强,往往其电负性越大,根据元素周期表中元素非金属性(或电负性)的递变规律,同周期从左到右元素电负性增大,可以得到电负性大小为N大于C,而Mn为金属元素,其电负性小于非金属性,N、C和Mn三种元素的电负性由大到小的顺序为:N、C、Mn,故答案为:N、C、Mn;
(3)HSCH2CH2NH2分子中,C形成4个共价键,它们价层电子对数为4对,其杂化方式为
sp3,在-NH2中N有两个单键,一对孤对电子和一个单电子,因为单电子也需要占用一个轨道,所以N的价层电子对数依然可以视为4对,其杂化方式也为sp3,考虑配位原子只有两个H,所以其空间构型为平面三角形,N和P为同族元素,其价层电子数相同,通常情况下其成键方式相同,但是由于N原子半径小于P,N原子周围空间无法容纳4个氧原子成键,所以在其最高价含氧酸中,前者为一元酸后者为三元酸,或说H3NO4分子会因为N原子半径小,无法容纳4个氧原子成键,要脱去一个水分子,以HNO3形式存在,故答案为:sp3;平面三角形;N和P为同族元素,其价层电子数相同,通常情况下其成键方式相同,但是由于N原子半径小于P,N原子周围空间无法容纳4个氧原子成键,所以在其最高价含氧酸中,前者为一元酸后者为三元酸,或说H3NO4分子会因为N原子半径小,无法容纳4个氧原子成键,要脱去一个水分子,以HNO3形式存在;
(4)题目信息,Pb(CH2CH3)4是一种难电离且易溶于有机溶剂的配合物,可知其晶体类型为分子晶体,这一点也可以从Pb(CH2CH3)4晶体的堆积方式得到结论,Pb(CH2CH3)4晶体堆积方式为六方密堆积,所以在xy平面上的二维堆积中也采取二维最密堆积即配位数为6,A分子的坐标参数为( )由堆积图可知每个晶胞中包含2个Pb(CH2CH3)4分子,所以每一个晶胞的质量为 g,再结合晶胞参数,可以得到晶胞的体积为cm3,则Pb(CH2CH3)4晶体的密度是g·cm-3,故答案为:分子;6;。
【点睛】Pb(CH2CH3)4是一种难电离且易溶于有机溶剂的配合物,可知其晶体类型为分子晶体是解答关键。
[化学——选修5:有机化学基础]
12.奈必洛尔是一种用于血管扩张的降血压药物,一种合成奈必洛尔中间体G的部分流程如下:
已知:乙酸酐的结构简式为
请回答下列问题:
(1)A的名称是__________;B中所含官能团的名称是__________。
(2)反应⑤的化学方程式为__________________,该反应的反应类型是______________。
(3)G的分子式为________________,乙酸酐共面的原子最多有_________个。
(4)写出同时满足下列条件的E的同分异构体的结构简式:________________。
Ⅰ.苯环上只有三个取代基
Ⅱ.核磁共振氢谱图中只有4组吸收峰
Ⅲ.该物质与足量溶液反应生成
(5)根据已有知识并结合相关信息,写出以和乙酸酐为原料制备的合成路线流程图(无机试剂任选),合成路线流程图示例如下:
__________________________
【答案】 (1). 对氟苯酚或4-氟苯酚 (2). 氟原子、酯基 (3). +H2O (4). 消去反应 (5). C10H9O3F (6). 9 (7). 、 (8).
【解析】
【分析】
A发生取代反应生成B,D发生加成反应生成E,F和氢气发生加成反应生成G,对比E、G的结构可知,F结构简式为:
,可知反应⑤为醇羟基的消去反应,据此分析解答。
【详解】(1)A()的名称是对氟苯酚或4-氟苯酚;B()中所含官能团有氟原子、酯基,故答案为:对氟苯酚或4-氟苯酚;氟原子、酯基;
(2)反应⑤为中醇羟基发生消去反应生成碳碳双键,则该反应的化学方程式为+H2O,故答案为:+H2O;消去反应;
(3)G()的分子式为C10H9O3F;中连接双键的原子共平面,每个甲基上最多有2个原子与含有官能团的原子共平面,乙酸酐共面的原子最多有9个,故答案为:C10H9O3F;9;
(4)E为,E的同分异构体符合下列条件:Ⅰ.苯环上只有三个取代基;Ⅱ.核磁共振氢谱图中只有4组吸收峰,说明含有4种氢原子,Ⅲ.1mol该物质与足量NaHCO3溶液反应生成2molCO2,说明含有2个-COOH;根据不饱和度知,符合条件的结构简式中除了苯环外不含其它环状结构,符合条件的结构有、,故答案为:、;
(5)以和乙酸酐为原料制备,根据逆合成法可知,合成需要得到,结合题中反应原理及反应物为苯酚,则用苯酚与乙酸酐反应生成,在氯化铝存在条件下转化成,在催化剂存在条件下与氢气发生加成反应生成,发生消去反应得到,其合成路线为
,故答案为:。
【点睛】明确反应前后碳链结构变化、官能团变化是解本题关键。本题的易错点和难点为(5),要注意根据目标产物和反应物特点采用知识迁移的方法和逆合成思维的方法思考合成路线的设计。