- 334.00 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课时作业(三十九) 物质的分离和提纯
1.(2019·福建莆田质检)《本草纲目》“烧酒”条目:“自元时始创其法,用浓酒和糟入甑,蒸令气上,其清如水,味极浓烈,盖酒露也。”文中的“法”指( )
A.萃取 B.蒸馏
C.升华 D.干馏
B [由题意可知,蒸令气上,说明利用的是互溶混合物的沸点差异进行分离,该法为蒸馏操作。]
2.海藻灰中含有丰富的碘,这些碘以I-的形式存在。如图是实验室从海藻灰中提取碘的部分操作流程:
则操作①、②、③的名称分别是( )
A.萃取、过滤、蒸发 B.萃取、蒸馏、蒸发
C.过滤、萃取、过滤 D.过滤、萃取、蒸馏
D [①是过滤,从海藻灰悬浊液中得到含碘离子的溶液和残渣;②是萃取;③从碘的有机溶液中提取出碘,是蒸馏操作。]
3.(2019·江苏徐州调研)下列实验中,所采取的分离方法与对应原理都正确的是( )
选项
目的
分离方法
原理
A
除去KCl中的MnO2
蒸发结晶
溶解度不同
B
除去碘中的NaCl
加热、升华
NaCl的熔点高,碘易升华
C
分离KNO3和NaCl
重结晶
KNO3的溶解度大于NaCl
D
分离食用油和汽油
分液
食用油和汽油的密度不同
答案 B
4.(2019·江西赣州模拟)下列除杂方法不正确的是( )
A.除去NH4Cl溶液中的FeCl3,可向溶液中加入氨水调节pH
B.除去金属离子Cu2+、Hg2+,可向溶液中加入Na2S、H2S等沉淀剂
C.除去某溶液中的SO可向溶液中加入镁盐
D.除去ZnCl2溶液中的Fe3+可向溶液中加入Zn(OH)2
C [A项,氨水可与氯化铁反应生成氢氧化铁沉淀,同时生成氯化铵,不引入新的杂质,正确;B项,加入Na2S、H2S等物质,Cu2+、Hg2+易转化为CuS、HgS等沉淀,可用于除杂,正确;C项,硫酸镁易溶于水,无法沉淀SO,应加入钡盐除杂,错误;D项,Zn(OH)2能消耗溶液中H+,提高溶液的pH,促进Fe3+的水解,使其生成氢氧化铁沉淀,正确。]
- 6 -
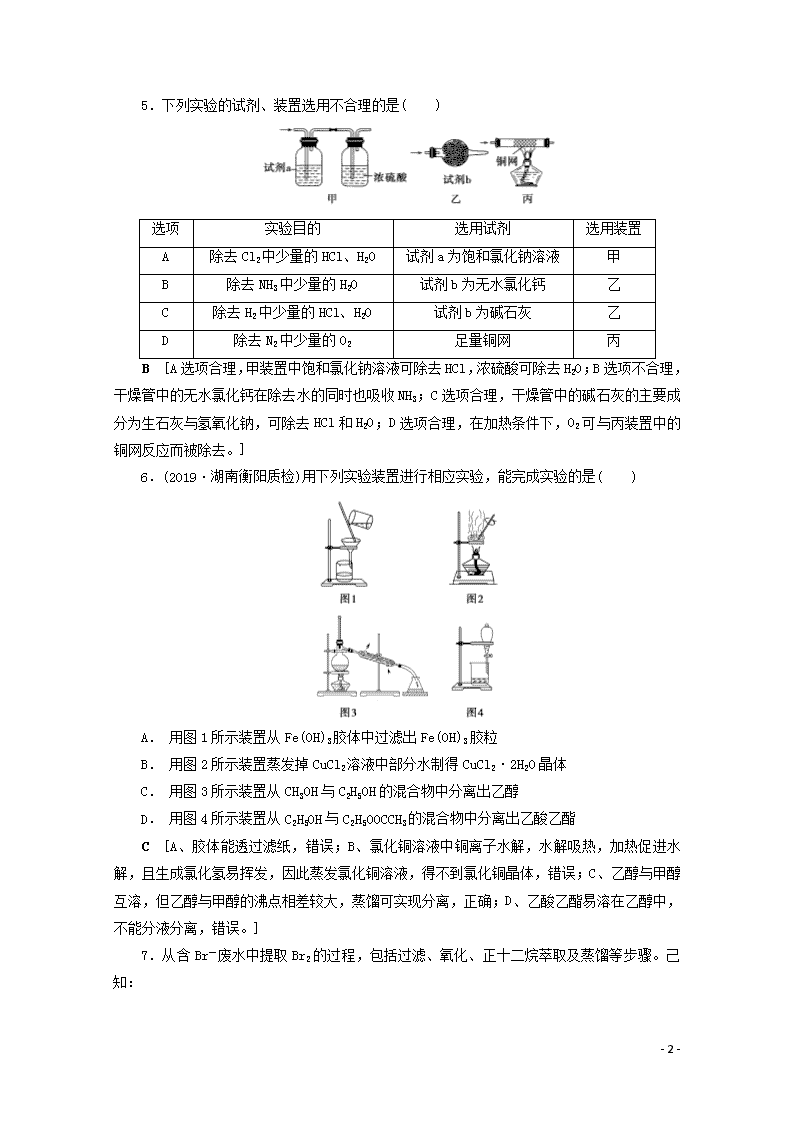
5.下列实验的试剂、装置选用不合理的是( )
选项
实验目的
选用试剂
选用装置
A
除去Cl2中少量的HCl、H2O
试剂a为饱和氯化钠溶液
甲
B
除去NH3中少量的H2O
试剂b为无水氯化钙
乙
C
除去H2中少量的HCl、H2O
试剂b为碱石灰
乙
D
除去N2中少量的O2
足量铜网
丙
B [A选项合理,甲装置中饱和氯化钠溶液可除去HCl,浓硫酸可除去H2O;B选项不合理,干燥管中的无水氯化钙在除去水的同时也吸收NH3;C选项合理,干燥管中的碱石灰的主要成分为生石灰与氢氧化钠,可除去HCl和H2O;D选项合理,在加热条件下,O2可与丙装置中的铜网反应而被除去。]
6.(2019·湖南衡阳质检)用下列实验装置进行相应实验,能完成实验的是( )
A. 用图1所示装置从Fe(OH)3胶体中过滤出Fe(OH)3胶粒
B. 用图2所示装置蒸发掉CuCl2溶液中部分水制得CuCl2·2H2O晶体
C. 用图3所示装置从CH3OH与C2H5OH的混合物中分离出乙醇
D. 用图4所示装置从C2H5OH与C2H5OOCCH3的混合物中分离出乙酸乙酯
C [A、胶体能透过滤纸,错误;B、氯化铜溶液中铜离子水解,水解吸热,加热促进水解,且生成氯化氢易挥发,因此蒸发氯化铜溶液,得不到氯化铜晶体,错误;C、乙醇与甲醇互溶,但乙醇与甲醇的沸点相差较大,蒸馏可实现分离,正确;D、乙酸乙酯易溶在乙醇中,不能分液分离,错误。]
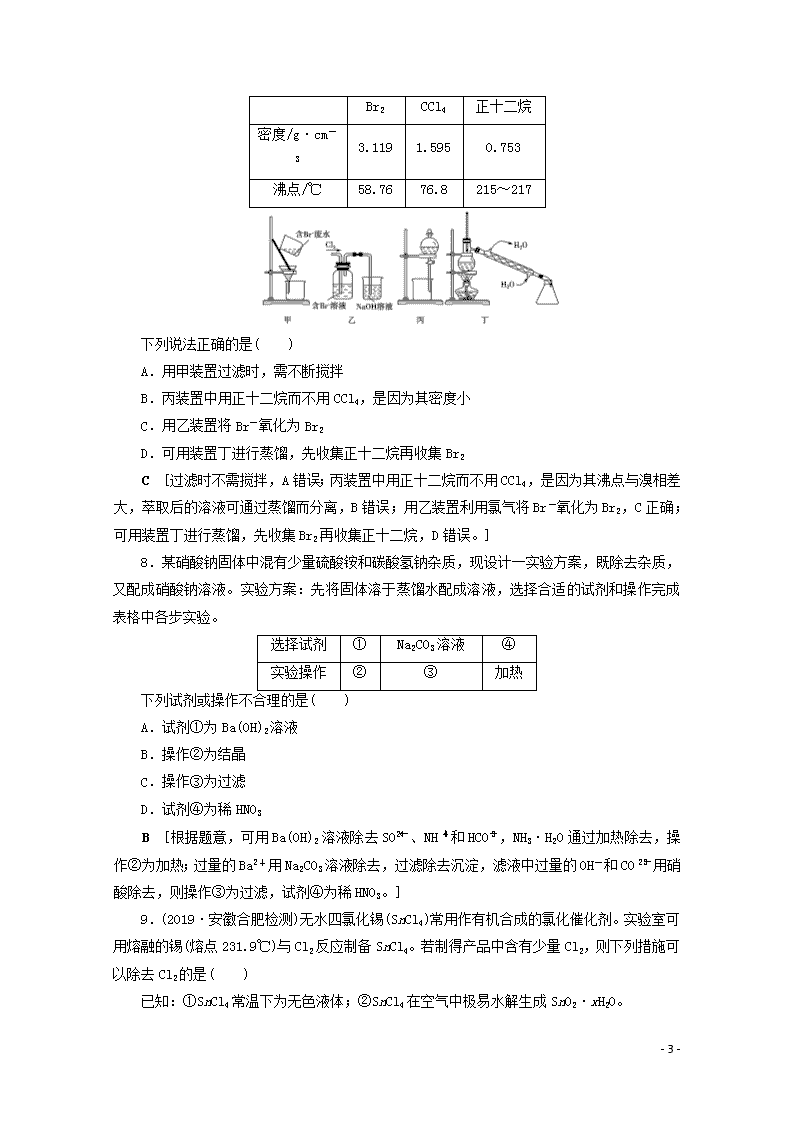
7.从含Br-废水中提取Br2的过程,包括过滤、氧化、正十二烷萃取及蒸馏等步骤。己知:
- 6 -
Br2
CCl4
正十二烷
密度/g·cm-3
3.119
1.595
0.753
沸点/℃
58.76
76.8
215~217
下列说法正确的是( )
A.用甲装置过滤时,需不断搅拌
B.丙装置中用正十二烷而不用CCl4,是因为其密度小
C.用乙装置将Br-氧化为Br2
D.可用装置丁进行蒸馏,先收集正十二烷再收集Br2
C [过滤时不需搅拌,A错误;丙装置中用正十二烷而不用CCl4,是因为其沸点与溴相差大,萃取后的溶液可通过蒸馏而分离,B错误;用乙装置利用氯气将Br-氧化为Br2,C正确;可用装置丁进行蒸馏,先收集Br2再收集正十二烷,D错误。]
8.某硝酸钠固体中混有少量硫酸铵和碳酸氢钠杂质,现设计一实验方案,既除去杂质,又配成硝酸钠溶液。实验方案:先将固体溶于蒸馏水配成溶液,选择合适的试剂和操作完成表格中各步实验。
选择试剂
①
Na2CO3溶液
④
实验操作
②
③
加热
下列试剂或操作不合理的是( )
A.试剂①为Ba(OH)2溶液
B.操作②为结晶
C.操作③为过滤
D.试剂④为稀HNO3
B [根据题意,可用Ba(OH)2溶液除去SO、NH和HCO,NH3·H2O通过加热除去,操作②为加热;过量的Ba2+用Na2CO3溶液除去,过滤除去沉淀,滤液中过量的OH-和CO用硝酸除去,则操作③为过滤,试剂④为稀HNO3。]
9.(2019·安徽合肥检测)无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用熔融的锡(熔点231.9℃)与Cl2反应制备SnCl4。若制得产品中含有少量Cl2,则下列措施可以除去Cl2的是( )
已知:①SnCl4常温下为无色液体;②SnCl4在空气中极易水解生成SnO2·xH2O。
- 6 -
A.加入NaOH溶液萃取分液
B.加入足量锡再加热蒸馏
C.加入碘化钾冷凝过滤
D.加入饱和食盐水萃取
B [A.NaOH不仅吸收Cl2,而且能与SnCl4反应,不能采用;B.加入足量锡与Cl2反应,再加热蒸馏,能采用;C.碘化钾与Cl2反应生成KCl和I2,产品中混有I2,不能采用;D.加入饱和食盐水,不能吸收Cl2,SnCl4水解成SnO2·xH2O,不能采用。]
10.海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下图:
(1)实验室灼烧海藻,需要下列仪器中的________(填字母)。
a.试管 b.烧杯 c.坩埚 d.泥三角 e.铁三脚架 f.酒精灯
(2)指出提取碘的过程中有关的实验操作名称:①________,③__________。
(3)提取碘的过程中,可选择的有机试剂是________(填字母)。
A.甲苯、酒精 B.四氯化碳、苯
C.汽油、乙酸 D.汽油、甘油
(4)为使海藻灰中碘离子转化为碘的有机溶液,实验室有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器有__________、________。
(5)小组用CCl4萃取碘水中的碘,在图中的分液漏斗中,下层液体呈________色;他们打开分液漏斗活塞,却未见液体流下,原因可能是_________________________________。
(6)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,指出下列实验装置图中的错误之处:
- 6 -
①________________;②__________________;③________________。
(7)进行上述蒸馏操作时,使用水浴加热的原因是_____________________________
________________________________________________________________________,
最后晶态碘在________里聚集。
答案 (1)cdef (2)过滤 萃取分液 (3)B (4)分液漏斗
普通漏斗 (5)紫红 分液漏斗上口活塞小孔未与空气相通
(6)①缺石棉网 ②温度计插到了液体中 ③冷凝管进出水的方向颠倒 (7)使蒸馏烧瓶受热均匀,控制加热温度不至过高 蒸馏烧瓶
11.(2018·河北邢台二模)工业品MnCl2溶液中含有杂质,利用锰粉、草酸、硫酸锰分别依次除去Pb2+、Ca2+、Mg2+制得纯净的MnCl2。工艺流程如下:
已知:①草酸为二元弱酸,其钠盐、钾盐易溶于水,钙盐难溶于水。
②硫酸镁晶体、硫酸锰的溶解度曲线如下图:
回答下列问题:
(1)过滤所需的玻璃仪器主要有________________,加热搅拌的作用是____________。
(2)弃渣Ⅰ、Ⅱ、Ⅲ的主要成分分别为____________、________、__________。反应①的离子方程式为_______________________________________________________________。
(3)反应②的离子方程式为__________________________________________________。
(4)③加热搅拌、静置过滤时,所选择的温度的范围是______。
a.0~20 ℃ b.20~40 ℃ c.40~60 ℃ d.80~90 ℃
- 6 -
(5)④加入氯化钡溶液主要是为了除去________,检验该离子是否除尽的方法为_______________________________________________________________________。
(6)已知MnCl2溶液呈弱酸性,操作X为________(填字母)。
a.蒸发结晶 b.降温结晶 c.萃取分液 d.蒸馏
解析 (1)过滤所需的玻璃仪器主要有漏斗、烧杯、玻璃棒,加热搅拌的作用是加快反应速率。
(2)根据题意,结合流程图知,反应①为除Pb2+,则弃渣Ⅰ为铅及少量锰粉;反应③除镁离子,则弃渣Ⅱ为硫酸镁晶体;反应④为除去引入的硫酸根离子,则弃渣Ⅲ为硫酸钡。
(3)草酸与Ca2+反应生成草酸钙沉淀,注意草酸为弱酸,不能拆写成离子。
(4)根据硫酸锰与硫酸镁晶体的溶解度曲线,可知在80~90 ℃的范围内二者溶解度差别最大,且硫酸镁晶体的溶解度最小。
(6)MnCl2溶液呈弱酸性,是因为Mn2+水解,不能用蒸发结晶的方法,而用蒸发浓缩、冷却结晶(即降温结晶)的方法。
答案 (1)漏斗、烧杯、玻璃棒 加快反应速率
(2)铅及少量锰粉 MgSO4·7H2O 硫酸钡(或BaSO4)
Mn+Pb2+===Mn2++Pb (3)H2C2O4+Ca2+===CaC2O4↓+2H+ (4)d (5)SO 取少量上层澄清溶液于试管中,滴加BaCl2溶液,如无沉淀出现则说明SO已除尽,反之则没有除尽 (6)b
- 6 -