- 4.52 MB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
题型五 水溶液中的化学平衡
-
2
-
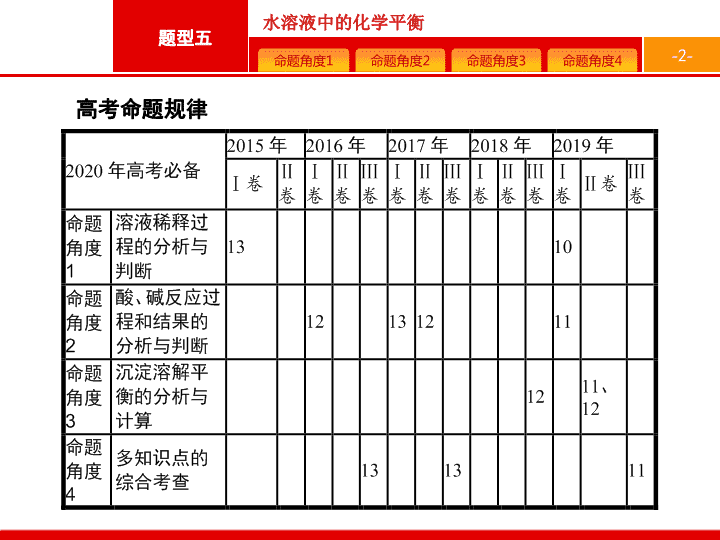
高考命题
规律
-
3
-
高考真题体验
典题演练提能
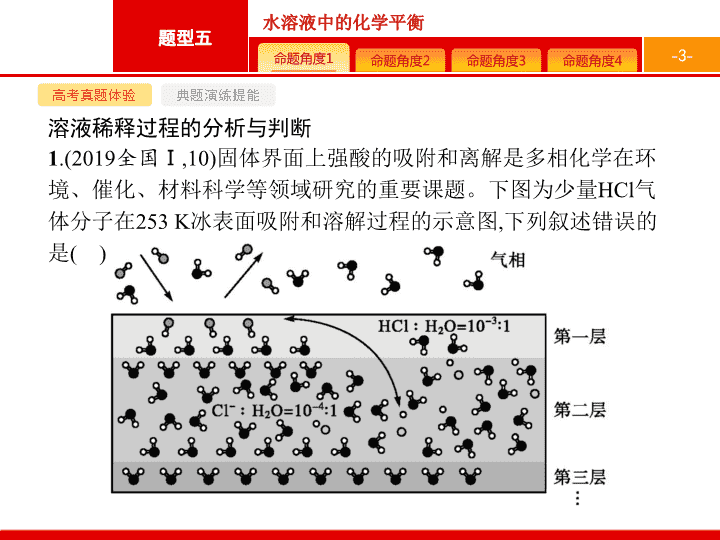
溶液稀释过程的分析与判断
1
.(2019
全国
Ⅰ
,10)
固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。下图为少量
HCl
气体分子在
253 K
冰表面吸附和溶解过程的示意图
,
下列叙述错误的是
(
)
-
4
-
高考真题体验
典题演练提能
A.
冰表面第一层中
,HCl
以分子形式存在
B.
冰表面第二层中
,H
+
浓度为
5×10
-3
mol·L
-1
(
设冰的密度为
0.9 g·cm
-3
)
C.
冰表面第三层中
,
冰的氢键网络结构保持不变
D.
冰表面各层之间
,
均存在可逆反应
HCl H
+
+Cl
-
答案
:
D
-
5
-
高考真题体验
典题演练提能
2
.(2019
天津
,5)
某温度下
,HNO
2
和
CH
3
COOH
的电离常数分别为
5.0×10
-4
和
1.7×10
-5
。将
pH
和体积均相同的两种酸溶液分别稀释
,
其
pH
随加水体积的变化如图所示。下列叙述正确的是
(
)
A.
曲线
Ⅰ
代表
HNO
2
溶液
B.
溶液中水的电离程度
: b
点
>c
点
C.
从
c
点到
d
点
,
溶液
中
保持
不变
(
其中
HA
、
A
-
分别代表相应的酸和酸根离子
)
D.
相同体积
a
点的两溶液分别与
NaOH
恰好中和后
,
溶液中
n
(Na
+
)
相同
-
6
-
高考真题体验
典题演练提能
答案
:
C
解析
:
A
项
,
根据两种酸的电离常数可知
,
酸性
:HNO
2
>CH
3
COOH,pH
相同的两种酸稀释相同倍数
,pH
变化大的是相对较强的酸
,
即曲线
Ⅱ
表示
HNO
2
溶液的稀释
,
错误
;B
项
,pH
越小酸性越强
,
对水电离的抑制程度越大
,
因此溶液中水的电离程度
:b
点
HB,C
项错误
;
根据图像看出
,
当
lg
c
=0
时
,
c
(HB)=1
mol·L
-1
,2pH=5,
则
pH=2.5,
c
(H
+
)=1×10
-2.5
mol·L
-1
,HB
的电离平衡
常数
=
1×10
-5
,p
K
a
=-lg
K
a
=-lg(1×10
-5
)=5,D
项错误。
-
11
-
高考真题体验
典题演练提能
2
.(2019
湖南怀化二模
)
常温下
,
将
V
0
mL 1 mol·L
-1
HClO
2
和
V
0
mL 1 mol·L
-1
HMnO
4
两种酸溶液分别加水稀释
,
稀释后溶液体积为
V
,
稀释液
pH
与其体积变化的关系如图所示。下列说法正确的是
(
)
A.HClO
2
和
HMnO
4
均为一元弱酸
B.
在
0
≤
pH
≤
5
时
,HClO
2
溶液满足
pH
=
C.
分别往
M
、
N
两点对应溶液中滴加
1 mol·L
-1
NaOH
溶液至恰好完全反应
,
消耗
NaOH
溶液的体积相等
D.
常温下
,
浓度均为
0.1 mol·L
-1
的
NaClO
2
和
NaMnO
4
溶液
,
溶液
pH:NaMnO
4
>NaClO
2
-
12
-
高考真题体验
典题演练提能
答案
:
C
解析
:
由题图可知
,1
mol·L
-1
HClO
2
溶液的
pH>1,1
mol·L
-1
HMnO
4
的
pH=0,
说明
HClO
2
是弱酸
,HMnO
4
为强酸
,A
项错误
;
因为
HClO
2
为弱酸
,
稀释促进其电离
,
在
0
≤
pH
≤
5
时
,
不能满足
pH
=
的
关系
,HMnO
4
是强酸
,
在
0
≤
pH
≤
5
时能满足
pH
=
的
关系
,B
项错误
;
同体积同浓度
HClO
2
、
HMnO
4
中和
1
mol·L
-1
的
NaOH
溶液的能力相同
,C
项正确
;
酸性
:HClO
2
7,NaMnO
4
不水解溶液显中性
,D
项错误。
-
13
-
高考真题体验
典题演练提能
3
.(2019
江西南昌二模
)
常温时
,1 mol·L
-1
的
HA
和
1 mol·L
-1
的
HB
两种酸溶液
,
起始时的体积均为
V
0
,
分别向两溶液中加水进行稀释
,
所得变化关系如图所示
(
V
表示溶液稀释后的体积
)
。下列说法错误的是
(
)
A.
K
a
(HA)
约为
10
-4
B.
当两溶液均稀释
至
+
1=4
时
,
溶液中
c
(A
-
)>
c
(B
-
)
C.
中和等体积
pH
相同的两种酸所用
n
(NaOH):HA>HB
D.
等体积、等物质的量浓度的
NaA
和
NaB
溶液中离子总数前者小于后者
-
14
-
高考真题体验
典题演练提能
答案
:
B
解析
:
根据图示
,
当
+
1=1
时
,
即
V=V
0
,
溶液中尚未加水
,1
mol·L
-1
的
HA
溶液
pH=2,
即
HA
为弱酸
,HA
在溶液中部分电离
;1
mol·L
-1
的
HB
溶液
pH=0,
即
HB
为强酸
,HB
在溶液中全部电离。因为起始两溶液浓度和体积均相等
,
故起始两溶液中所含一元酸的物质的量相等。
-
15
-
高考真题体验
典题演练提能
1
mol·L
-1
的
HA
溶液的
pH
为
2,
c
(A
-
)=
c
(H
+
)=0.01
mol·L
-1
,
c
(HA)≈1
mol·L
-1
,
则
HA
的电离常数约为
10
-4
,A
项正确。由电荷守恒有
:
c
(H
+
)=
c
(A
-
)+
c
(OH
-
),
c
(H
+
)=
c
(B
-
)+
c
(OH
-
),
当两溶液均稀释
至
+
1=4
时
,HB
溶液
pH=3,HA
溶液
pH>3,
则有
c
(A
-
)<
c
(B
-
),B
项错误。
HA
为弱酸
,HB
为强酸
,
等体积
pH
相同的两种酸所含一元酸的物质的量
n
(HA)>
n
(HB),
故分别用
NaOH
溶液中和时
,
消耗的
NaOH
物质的量
:HA>HB,C
项正确。等体积、等物质的量浓度的
NaA
和
NaB
溶液
,Na
+
数目相同
;HA
为弱酸
,
盐溶液中
A
-
发生水解
,NaA
溶液呈碱性
,NaA
溶液中的电荷守恒为
c
(Na
+
)+
c
(H
+
)=
c
(A
-
)+
c
(OH
-
);HB
为强酸
,
盐溶液中
B
-
不发生水解
,NaB
溶液呈中性
,NaB
溶液中的电荷守恒为
c
(Na
+
)+
c
(H
+
)=
c
(B
-
)+
c
(OH
-
);NaA
溶液中
c
(H
+
)
c
(Y
-
)>
c
(HY)>
c
(H
+
)>
c
(OH
-
)
-
19
-
高考真题体验
典题演练提能
答案
:
B
解析
:
根据图像可知
1
mol·L
-1
HX
溶液的
pH=0,
说明
HX
全部电离
,
为强电解质
;
当
HX
溶液被无限稀释时
pH
接近
7,A
项错误。根据图像可知
,1
mol·L
-1
HY
溶液的
pH=2,
溶液中氢离子浓度是
0.01
mol·L
-1
,
所以该温度下
HY
的电离常数
为
≈
1.0×10
-4
,B
项正确。酸或碱抑制水电离
,
酸溶液中氢离子浓度越小其对水电离抑制的程度越小
,
根据图像可知
,b
溶液中氢离子浓度小
,
则水电离程度
a
c
(Na
+
)>
c
(HY)>
c
(H
+
)>
c
(OH
-
),D
项错误。
-
20
-
高考真题体验
典题演练提能
酸、碱反应过程和结果的分析与判断
1
.(2019
全国
Ⅰ
,11)NaOH
溶液滴定邻苯二甲酸氢钾
(
邻苯二甲酸
H
2
A
的
K
a1
=1.1×10
-3
,
K
a2
=3.9×10
-6
)
溶液
,
混合溶液的相对导电能力变化曲线如图所示
,
其中
b
点为反应终点。下列叙述错误的是
(
)
A.
混合溶液的导电能力与离子浓度和种类有关
B.Na
+
与
A
2-
的导电能力之和大于
HA
-
的
C.b
点的混合溶液
pH=7
D.c
点的混合溶液中
,
c
(Na
+
)>
c
(K
+
)>
c
(OH
-
)
-
21
-
高考真题体验
典题演练提能
答案
:
C
解析
:
随着
NaOH
溶液的加入
,
混合溶液中离子浓度和种类发生变化
,
因此混合溶液的导电能力与离子浓度和种类有关
,A
项正确
;a
点的混合溶液中能导电的离子主要为
HA
-
和
K
+
,b
点为反应终点
,
因此
b
点的混合溶液中能导电的离子主要为
A
2-
、
K
+
、
Na
+
,
故
Na
+
与
A
2-
的导电能力之和大于
HA
-
的
,B
项正确
;b
点的混合溶液中含有的
A
2-
能发生水解反应而使溶液呈碱性
,C
项错误
;b
点为反应终点
,
因此
b
点的混合溶液中
c
(Na
+
)=
c
(K
+
)>
c
(OH
-
),
继续加入氢氧化钠溶液后
,c
点的混合溶液中
c
(Na
+
)>
c
(K
+
)>
c
(OH
-
),D
项正确。
-
22
-
高考真题体验
典题演练提能
2
.(2017
全国
Ⅰ
,13)
常温下
,
将
NaOH
溶液滴加到己二酸
(H
2
X)
溶液中
,
混合溶液的
pH
与离子浓度变化的关系如图所示。下列叙述错误的是
(
)
A.
K
a2
(H
2
X)
的数量级为
10
-6
C.NaHX
溶液中
c
(H
+
)>
c
(OH
-
)
D.
当混合溶液呈中性时
,
c
(Na
+
)>
c
(HX
-
)>
c
(X
2-
)>
c
(OH
-
)=
c
(H
+
)
-
23
-
高考真题体验
典题演练提能
答案
:
D
-
24
-
高考真题体验
典题演练提能
3
.(2017
全国
Ⅱ
,12)
改变
0.1 mol·L
-1
二元弱酸
H
2
A
溶液的
pH,
溶液中
H
2
A
、
HA
-
、
A
2-
的物质的量分数
δ
(X)
随
pH
的变化如图所示
[
已知
下列
叙述错误的是
(
)
A.pH=1.2
时
,
c
(H
2
A)=
c
(HA
-
)
B.lg[
K
2
(H
2
A)]=-4.2
C.pH=2.7
时
,
c
(HA
-
)>
c
(H
2
A)=
c
(A
2-
)
D.pH=4.2
时
,
c
(HA
-
)=
c
(A
2-
)=
c
(H
+
)
-
25
-
高考真题体验
典题演练提能
答案
:
D
解析
:
A
项
,
根据图像
,pH=1.2
时
,H
2
A
和
HA
-
物质的量分数相同
,
则有
c
(H
2
A)=
c
(HA
-
),A
正确
;B
项
,
根据
pH=4.2
点
,
K
2
(H
2
A
)= =
c
(H
+
)=10
-4.2
,B
正确
;C
项
,
根据图像
,pH=2.7
时
,HA
-
物质的量分数最大
,H
2
A
和
A
2-
物质的量分数基本相同
,
则有
c
(HA
-
)>
c
(H
2
A)=
c
(A
2-
),C
正确
;D
项
,
根据
pH=4.2
时
,
c
(HA
-
)=
c
(A
2-
),
且物质的量分数约为
0.48,
而
c
(H
+
)=10
-4.2
mol·L
-1
,
可知
c
(HA
-
)=
c
(A
2-
)>
c
(H
+
),D
错误。
-
26
-
高考真题体验
典题演练提能
4
.(2016
全国
Ⅰ
,12)298 K
时
,
在
20.0 mL 0.10 mol·L
-1
氨水中滴入
0.10 mol·L
-1
的盐酸
,
溶液的
pH
与所加盐酸的体积关系如图所示。已知
0.10 mol·L
-1
氨水的电离度为
1.32%,
下列有关叙述正确的是
(
)
A.
该滴定过程应该选择酚酞作为指示剂
B.M
点对应的盐酸体积为
20.0 mL
C.M
点处的溶液中
c
( )=
c
(Cl
-
)=
c
(H
+
)=
c
(OH
-
)
D.N
点处的溶液中
pH<12
-
27
-
高考真题体验
典题演练提能
答案
:
D
解析
:
氨水与盐酸中和生成氯化铵
,
氯化铵属于强酸弱碱盐
,
溶液显酸性
,
应选择在酸性范围变色的指示剂
,
指示剂可以为甲基橙
,A
选项错误
;
盐酸若为
20
mL,
二者恰好中和
,
此时溶液为酸性
,
若溶液
pH=7,
则盐酸体积必然小于
20
mL,B
选项错误
;M
点处溶液呈中性
,
c
( )=
c
(Cl
-
),
c
(H
+
)=
c
(OH
-
),
但
c
(Cl
-
)
要远大于
c
(H
+
),C
选项错误
;
由于
N
点为
0.1
mol·L
-1
的氨水
,
根据电离度为
1.32%,
c
(OH
-
)=0.1
mol·L
-1
×1.32%=0.00
132
mol·L
-1
,
故
pH<12,D
选项正确。
-
28
-
高考真题体验
典题演练提能
5
.(2016
天津
,6)
室温下
,
用相同浓度的
NaOH
溶液
,
分别滴定浓度均为
0.1 mol·L
-1
的三种酸
(HA
、
HB
和
HD)
溶液
,
滴定曲线如图所示
,
下列判断错误的是
(
)
A.
三种酸的电离常数关系
:
K
HA
>
K
HB
>
K
HD
B.
滴定至
P
点时
,
溶液中
:
c
(B
-
)>
c
(Na
+
)>
c
(HB)>
c
(H
+
)>
c
(OH
-
)
C.pH=7
时
,
三种溶液中
:
c
(A
-
)=
c
(B
-
)=
c
(D
-
)
D.
当中和百分数达
100%
时
,
将三种溶液混合后
:
c
(HA)+
c
(HB)+
c
(HD)=
c
(OH
-
)-
c
(H
+
)
-
29
-
高考真题体验
典题演练提能
答案
:
C
解析
:
A
项
,
题给三种酸均为一元酸
,
浓度相同时
,pH
越小
,
说明对应酸越强
,
电离常数越大
,
因此根据未发生中和反应时三种酸的
pH
大小可知
A
项正确
;B
项
,P
点时
,HB
反应一半
,
溶液中溶质为
NaB
和
HB,
且物质的量浓度相等
,
此时溶液呈酸性
,
说明
HB
的电离程度大于
NaB
的水解程度
,
则溶液中
c
(B
-
)>
c
(Na
+
)>
c
(HB)>
c
(H
+
)>
c
(OH
-
),
正确
;C
项
,
对于任何一种酸
HX,
加
NaOH
反应达到中性时
,
酸越弱
,
需要的
NaOH
越少
,
c
(Na
+
)
越小
,
溶液中存在电荷守恒
:
c
(Na
+
)+
c
(H
+
)=
c
(OH
-
)+
c
(X
-
),
由于
c
(H
+
)=
c
(OH
-
),
则
c
(Na
+
)=
c
(X
-
),
由于酸性
HA>HB>HD,
故达中性时三种溶液中
c
(A
-
)>
c
(B
-
)>
c
(D
-
),
错误
;D
项
,
完全中和并混合后
,
溶液中溶质有
NaA
、
NaB
、
NaD,
水电离的
H
+
部分被
A
-
、
B
-
、
D
-
结合生成
HA
、
HB
、
HD,
所以根据质子守恒有
c
(H
+
)+
c
(HA)+
c
(HB)+
c
(HD)=
c
(OH
-
),
正确。
-
30
-
高考真题体验
典题演练提能
6
.(2015
山东
,13)
室温下向
10 mL 0.1 mol·L
-1
NaOH
溶液中加入
0.1 mol·L
-1
的一元酸
HA,
溶液
pH
的变化曲线如图所示。下列说法正确的是
(
)
A.a
点所示溶液中
c
(Na
+
)>
c
(A
-
)>
c
(H
+
)>
c
(HA)
B.a
、
b
两点所示溶液中水的电离程度相同
C.pH=7
时
,
c
(Na
+
)=
c
(A
-
)+
c
(HA)
D.b
点所示溶液中
c
(A
-
)>
c
(HA)
-
31
-
高考真题体验
典题演练提能
答案
:
D
解析
:
a
点表示
HA
与
NaOH
恰好完全反应
,
得到
NaA
溶液并且溶液
pH=8.7,
说明
HA
为弱酸
,A
-
发生水解反应
:A
-
+
H
2
O HA+OH
-
,
则
a
点所示溶液中
c
(Na
+
)>
c
(A
-
)>
c
(OH
-
)>
c
(HA)>
c
(H
+
),A
项错误
;a
点为
NaA
溶液
,
由于
A
-
发生水解
,
促进水的电离
,
而
b
点是
HA
和
NaA
的混合溶液
,HA
抑制水的电离
,
水的电离程度比
a
点时的小
,B
项错误
;
根据电荷守恒可知
:
c
(Na
+
)+
c
(H
+
)=
c
(OH
-
)+
c
(A
-
),pH=7
时
c
(Na
+
)=
c
(A
-
),C
项错误
;b
点所示溶液为等物质的量浓度的
HA
和
NaA
的混合溶液
,
由于溶液的
pH=4.7,
说明
HA
的电离程度大于
A
-
的水解程度
,
故
c
(A
-
)>
c
(HA),D
项正确。
-
32
-
高考真题体验
典题演练提能
1
.(2019
河南部分示范性高中联考
)
常温下
,
向
10 mL 1 mol·L
-1
一元酸
HA
溶液中
,
不断滴加
1 mol·L
-1
的
NaOH
溶液
,
所加碱溶液的体积与
-lg
c
水
(H
+
)
的关系如图所示。
c
水
(H
+
)
为溶液中水电离的
c
(H
+
)
。下列说法不正确的是
(
)
A.
常温下
,
K
a
(HA)
的数量级为
10
-4
B.a
、
b
两点
pH
均为
7
C.
从
a
点到
b
点
,
水的电离程度先增大后减小
D.
反应开始至反应完全范围内
,
溶液的导电性逐渐增强
-
33
-
高考真题体验
典题演练提能
答案
:
B
解析
:
由起点溶液中
-lg
c
水
(H
+
)=12
可知
,
c
水
(H
+
)=
c
(OH
-
)=1×10
-12
mol·L
-1
,
则酸电离的
c
(H
+
)=10
-2
mol·L
-1
,
故
K
a
(HA)=10
-4
,A
项正确
;
由
1
mol·L
-1
HA
溶液中
c
(H
+
)=10
-2
mol·L
-1
可知
,HA
是弱酸
,
曲线的最高点为
NaA
溶液
,b
点溶液中的溶质是
NaA
和
NaOH,
溶液呈碱性
,pH>7,B
项错误
;a
点到
b
点
,
先是发生酸碱中和反应生成可水解的盐
,
然后碱过量
,
所以水的电离程度先增大后减小
,C
项正确
;
不断加入
NaOH
溶液
,
溶液中的离子总浓度不断增大
,
溶液的导电性逐渐增强
,D
项正确。
-
34
-
高考真题体验
典题演练提能
2
.(2019
辽宁辽阳二模
)
常温下
,
将
NaOH
溶液滴入某一元酸
(HA)
溶液中
,
测得混合溶液的
pH
与离子浓度变化关系如图所示
[
已知
:
A.
K
a
(HA)
的数量级为
10
-5
C.m
点所示溶液中
:
c
(H
+
)+
c
(Na
+
)=
c
(HA)+
c
(OH
-
)
D.n
点所示溶液中
:
c
(Na
+
)=
c
(A
-
)+
c
(HA)
-
35
-
高考真题体验
典题演练提能
答案
:
D
-
36
-
高考真题体验
典题演练提能
3
.(2019
湖南衡阳三中模拟
)
类比
pH
的定义
,
对于稀溶液可以定义
p
c
=-lg
c
,p
K
a
=-lg
K
a
。常温下
,
某浓度
H
2
A
溶液在不同
pH
下
,
测得
p
c
(H
2
A)
、
p
c
(HA
-
)
、
p
c
(A
2-
)
变化如图所示。下列说法正确的是
(
)
A.pH=3.50
时
,
c
(H
2
A)>
c
(HA
-
)>
c
(A
2-
)
B.
将等浓度等体积的
Na
2
A
与
H
2
A
溶液混合后
,
溶液显碱性
C.
随着
HCl
的通
入
先
减小后增大
D.pH
从
3.00
到
5.30
时
,
c
(H
2
A)+
c
(HA
-
)+
c
(A
2-
)
先增大后
减小
-
37
-
高考真题体验
典题演练提能
答案
:
C
-
38
-
高考真题体验
典题演练提能
4
.(2019
河南平顶山一轮质量检测
)
常温下
,
二甲胺
[(CH
3
)
2
NH·H
2
O]
是一元弱碱
,
其电离常数
K
b
=1.6×10
-4
。
10 mL
c
mol·L
-1
二甲胺溶液中滴加
0.1 mol·L
-1
盐酸
,
混合溶液的温度与盐酸体积的关系如图所示。下列说法不正确的是
(
)
A.
二甲胺溶液的浓度为
0.2 mol·L
-1
B.
在
Y
和
Z
点之间某点溶液
pH=7
C.Y
点存在
:
c
(Cl
-
)>
c
[(
CH
3
)
2
]>
c
(H
+
)>
c
(OH
-
)
D.
常温下
,(CH
3
)
2
NH
2
Cl
水解常数
K
h
≈6.25×10
-11
-
39
-
高考真题体验
典题演练提能
答案
:
B
-
40
-
高考真题体验
典题演练提能
5
.(2019
湖南湘潭二模
)
常温下
,HNO
2
的电离平衡常数为
K
=4.6×10
-4
(
已知
=
2.14),
向
20 mL 0.01 mol·L
-1
HNO
2
溶液中逐滴加入相同浓度的
NaOH
溶液
,
测得混合液的
pH
随
NaOH
溶液体积的变化如图所示
,
下列判断正确的是
(
)
A.
X
=20
B.a
、
b
、
c
、
d
四点对应的溶液中水的电离程度逐渐减小
C.a
点溶液中
c
(H
+
)=2.14×10
-3
mol·L
-1
D.b
点溶液中微粒浓度的大小关系为
c
(Na
+
)>
c
( )>
c
(H
+
)>
c
(OH
-
)
-
41
-
高考真题体验
典题演练提能
答案
:
C
-
42
-
高考真题体验
典题演练提能
6
.(2019
湖北名校联盟第三次模拟
)
常温下
,
向
10.0 mL 0.10 mol·L
-1
某二元酸
H
2
R
溶液中滴入同物质的量浓度的
NaOH
溶液
,
测得溶液的
pH
随
NaOH
溶液体积的变化如图所示。下列说法中正确的是
(
)
A.HR
-
的电离能力大于水解能力
B.
曲线上
m
点时溶液中
c
(Na
+
)>
c
(HR
-
)>
c
(R
2-
)>
c
(H
+
)
C.
无法判断
H
2
R
是强酸还是弱酸
D.
溶液中
c
(Na
+
)+
c
(H
+
)=
c
(HR
-
)+
c
(R
2-
)+
c
(OH
-
)
-
43
-
高考真题体验
典题演练提能
答案
:
A
解析
:
由于
m
点溶质为
NaHR,
溶液呈酸性
,
故
HR
-
的电离能力大于水解能力
,A
项正确
;m
点溶质为
NaHR,HR
-
电离出
R
2-
和
H
+
,
水也电离出
H
+
,
所以溶液中
c
(Na
+
)>
c
(HR
-
)>
c
(H
+
)>
c
(R
2-
),B
项错误
;0.10
mol·L
-1
H
2
R
溶液的
pH
大于
2,
可知
H
2
R
是弱酸
,C
项错误
;
根据电荷守恒
,
溶液中
c
(Na
+
)+
c
(H
+
)=
c
(HR
-
)+2
c
(R
2-
)+
c
(OH
-
),D
项错误。
-
44
-
高考真题体验
典题演练提能
7
.(2019
安徽黄山二模
)
常温时
,
用
0.100 0 mol·L
-1
NaOH
溶液滴定
25.00 mL 0.100 0 mol·L
-1
某一元酸
HX
溶液
,
滴定过程中
pH
变化曲线如图所示。下列说法正确的是
(
)
A.HX
为强酸
B.
在
A
点
,
c
(HX)>
c
(X
-
)>
c
(Na
+
)>
c
(H
+
)>
c
(OH
-
)
C.
在
B
点
,
两者恰好完全反应
D.
在
C
点
,
c
(X
-
)+
c
(HX)=0.1 mol·L
-1
-
45
-
高考真题体验
典题演练提能
答案
:
B
解析
:
根据图像可知
,0.100
0
mol·L
-1
HX
溶液的
2
c
(X
-
)>
c
(Na
+
)>
c
(H
+
)>
c
(OH
-
),B
项正确
;
在
B
点
,pH=7,
加入的
NaOH
溶液体积小于
25.00
mL,
没有恰好完全反应
,C
项错误
;
在
C
点
,
溶液的总体积为
50
mL,
由物料守恒可知
:
c
(X
-
)+
c
(HX
)=
-
46
-
高考真题体验
典题演练提能
-
47
-
高考真题体验
典题演练提能
答案
:
D
-
48
-
高考真题体验
典题演练提能
-
49
-
高考真题体验
典题演练提能
9
.(2019
河北中原名校联盟
)25
℃
时
,
向
10 mL 0.1 mol·L
-1
一元弱碱
XOH
溶液中逐滴滴加
0.1 mol·L
-1
的
HCl
溶液
,
溶液的
AG[AG
=
变化
如图所示
(
溶液混合时体积变化忽略不计
)
。下列说法不正确的是
(
)
A.
若
a=-8,
则
K
b
(XOH)≈10
-5
B.M
点表示盐酸和
XOH
恰好完全反应
C.R
点溶液中可能存在
c
(X
+
)+
c
(XOH)=
c
(Cl
-
)
D.M
点到
N
点
,
水的电离程度先增大后减小
-
50
-
高考真题体验
典题演练提能
答案
:
B
解析
:
a
点表示
0.1
mol·L
-1
一元弱碱
XOH
溶液
,
若
a=-8,
则
c
(OH
-
)=10
-3
mol·L
-1
,
所以
K
b
(XOH)
≈ =
10
-5
,A
项正确。两者恰好反应完全时
,
生成强酸弱碱盐
,
溶液显酸性
;M
点
AG=0,
即溶液中
c
(H
+
)=
c
(OH
-
),
溶液呈中性
,
所以
M
点盐酸不足
,B
项错误。若
R
点恰好为
XCl
溶液时
,
根据物料守恒可得
c
(X
+
)+
c
(XOH)=
c
(Cl
-
),C
项正确。
M
点的溶质为
XOH
和
XCl,
继续加入盐酸
,
直至
XOH
恰好全部反应
,
该过程水的电离程度逐渐增大
;
然后继续向
XCl
溶液中加入盐酸
,
水的电离程度就会逐渐减小
,
即从
M
点到
N
点
,
水的电离程度先增大后减小
,D
项正确。
-
51
-
高考真题体验
典题演练提能
10
.(2019
四省名校第三次大联考
)
草酸
(H
2
C
2
O
4
)
是一种二元弱酸
,
在菠菜、苋菜、甜菜等植物中含量较高。
25
℃
时
,
向
H
2
C
2
O
4
溶液中滴加
NaOH
溶液
,
混合溶液中
lg
X
[
X
表示
]
随
pH
的变化关系如图所示。下列说法不正确的是
(
)
-
52
-
高考真题体验
典题演练提能
答案
:
C
解析
:
二元弱酸的电离平衡常数
K
a1
>
K
a2
,
直线
Ⅰ
表示的
X
与
c
(H
+
)
的乘积等于
1×10
-1.22
,
则
H
2
C
2
O
4
的
K
a1
=1×10
-1.22
;
直线
Ⅱ
表示
X
与
c
(H
+
)
的乘积等于
1×10
-4.19
,
则
H
2
C
2
O
4
的
K
a2
=1×10
-4.19
。
直线
Ⅰ
表示的
X
与
c
(H
+
)
的乘积等于
1×10
-1.22
,
所以直线
Ⅰ
中
X
表示的
是
,
A
项正确
;
直线
Ⅰ
表示的
X
与
c
(H
+
)
的乘积等于
1×10
-1.22
,lg
X
=pH-1.22;
直线
Ⅱ
表示
X
与
c
(H
+
)
的乘积等于
1×10
-4.19
,lg
X
=pH-4.19,
所以直线
Ⅰ
、
Ⅱ
的斜率均为
1,B
项正确
;
-
53
-
高考真题体验
典题演练提能
-
54
-
高考真题体验
典题演练提能
11
.(2019
广东广州综合测试一
)
常温下
,
用
0.10 mol·L
-1
NaOH
溶液滴定
0.10 mol·L
-1
HA
溶液
,
滴定曲线如图
a
所示
,
混合溶液的
pH
与离子浓度变化的关系如图
b
所示。下列叙述错误的是
(
)
A.
K
a
(HA)
的数量级为
10
-5
C.P~Q
过程中
,
水的电离程度逐渐增大
D.
当滴定至溶液呈中性时
,
c
(A
-
)>
c
(HA)
-
55
-
高考真题体验
典题演练提能
答案
:
B
-
56
-
高考真题体验
典题演练提能
沉淀溶解平衡的分析与计算
1
.(2019
全国
Ⅱ
,11)
下列化学方程式中
,
不能正确表达反应颜色变化的是
(
)
-
57
-
高考真题体验
答案
:
C
典题演练提能
-
58
-
高考真题体验
2
.(2019
全国
Ⅱ
,12)
绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉
(CdS)
是一种难溶于水的黄色颜料
,
其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是
(
)
A.
图中
a
和
b
分别为
T
1
、
T
2
温度下
CdS
在水中的溶解度
B.
图中各点对应的
K
sp
的关系为
:
K
sp
(m)=
K
sp
(n)<
K
sp
(p)<
K
sp
(q)
C.
向
m
点的溶液中加入少量
Na
2
S
固体
,
溶液组成由
m
沿
mpn
线向
p
方向移动
D.
温度降低时
,q
点的饱和溶液的组成由
q
沿
qp
线向
p
方向移动
典题演练提能
-
59
-
高考真题体验
答案
:
B
解析
:
CdS
在水中存在沉淀溶解平衡
:CdS(s
) Cd
2
+
(aq)+S
2-
(aq),
电离出的
S
2-
浓度与
Cd
2+
浓度相同
,A
项正确
;
沉淀溶解平衡常数只与温度有关
,
温度相同
,
K
sp
相同
,
所以
m
、
p
、
n
三点的
K
sp
相同
,B
项错误
;
在
T
1
温度下
,
向
m
点的溶液中加入少量
Na
2
S
固体
,S
2-
浓度增大
,
但由于
K
sp
不变
,
所以
Cd
2+
浓度必然减小
,
因此溶液组成由
m
沿
mpn
线向
p
方向移动
,C
项正确
;
温度降低
,CdS
的
K
sp
减小
,
但
S
2-
浓度与
Cd
2+
浓度仍然相等
,
所以
q
点饱和溶液的组成由
q
沿
qp
线向
p
方向移动
,D
项正确。
典题演练提能
-
60
-
高考真题体验
3
.(2018
全国
Ⅲ
,12)
用
0.100 mol·L
-1
AgNO
3
滴定
50.0 mL 0.050 0 mol·L
-1
Cl
-
溶液的滴定曲线如图所示。下列有关描述错误的是
(
)
典题演练提能
-
61
-
高考真题体验
A.
根据曲线数据计算可知
K
sp
(AgCl)
的数量级为
10
-10
B.
曲线上各点的溶液满足关系式
c
(Ag
+
)·
c
(Cl
-
)=
K
sp
(AgCl)
C.
相同实验条件下
,
若改为
0.040 0 mol·L
-1
Cl
-
,
反应终点
c
移到
a
D.
相同实验条件下
,
若改为
0.050 0 mol·L
-1
Br
-
,
反应终点
c
向
b
方向移动
答案
:
C
解析
:
相同实验条件下
,
若改为
0.040
0
mol·L
-1
Cl
-
,
恰好反应时
,0.040
0
mol·L
-1
×50.0
mL=0.100
mol·L
-1
·
V
,
V
=20
mL,
故反应终点横坐标应为
20,C
项描述错误
;
相同实验条件下
,
若改为
0.050
0
mol·L
-1
Br
-
,
反应终点横坐标不变
,
由于
K
sp
(AgCl)>
K
sp
(AgBr),
故反应终点纵坐标变大
,
故
D
项描述正确。
典题演练提能
-
62
-
高考真题体验
典题演练提能
1
.(2019
湖北武汉调研
)
常温下
,
向
10 mL 0.1 mol·L
-1
CuCl
2
溶液中滴加
0.1 mol·L
-1
Na
2
S
溶液
,
滴加过程中
-lg
c
(Cu
2+
)
与
Na
2
S
溶液体积
(
V
)
的关系如图所示。下列说法错误的是
(
)
A.
K
sp
(CuS)
的数量级为
10
-35
B.
曲线上的各点均满足关系式
c
(S
2-
)·
c
(Cu
2+
)=
K
sp
(CuS)
C.a
、
b
、
c
三点中
,
由水电离的
c
(H
+
)
和
c
(OH
-
)
的积最小的为
b
点
D.c
点溶液中
:
c
(Na
+
)>
c
(Cl
-
)>
c
(S
2-
)>
c
(OH
-
)>
c
(H
+
)
-
63
-
高考真题体验
典题演练提能
答案
:
A
-
64
-
高考真题体验
典题演练提能
a
点
Cu
2+
过量
,c
点
S
2-
过量
,b
点恰好完全反应生成
CuS
和
NaCl,a
点溶液中
Cu
2+
浓度远大于
b
点
,c
点溶液中
S
2-
浓度远大于
b
点
,Cu
2+
、
S
2-
水解促进水的电离
,
则
b
点水电离的
c
(H
+
)
和
c
(OH
-
)
的积最小
,C
项正确
;c
点为
Na
2
S
、
NaCl
按物质的量比
1
∶
2
混合的溶液
,
其中
CuS
处于沉淀溶解平衡状态
,
根据物料守恒及物质的溶解性
,
可知
c
(Na
+
)>
c
(Cl
-
)>
c
(S
2-
),S
2-
水解消耗水电离产生
H
+
,
使溶液中
c
(OH
-
)>
c
(H
+
),
但水电离产生的离子浓度远小于盐电离产生的离子浓度
,
故
c
(S
2-
)>
c
(OH
-
),
因此该溶液中微粒浓度大小关系为
:
c
(Na
+
)>
c
(Cl
-
)>
c
(S
2-
)>
c
(OH
-
)>
c
(H
+
),D
项正确。
-
65
-
高考真题体验
典题演练提能
-
66
-
高考真题体验
典题演练提能
答案
:
B
-
67
-
高考真题体验
典题演练提能
-
68
-
高考真题体验
典题演练提能
3
.(2019
湘赣十四校联考第一次考试
)25
℃
时
,Fe(OH)
2
和
Cu(OH)
2
的饱和溶液中
,
金属阳离子的物质的量浓度的负对数
[-lg
c
(M
2+
)]
与溶液
pH
的变化关系如图所示
,
已知该温度下
K
sp
[Cu(OH)
2
]<
K
sp
[Fe(OH)
2
]
。下列说法不正确的是
(
)
A.
K
sp
[Cu(OH)
2
]
的数量级为
10
-20
B.
当
Fe(OH)
2
和
Cu(OH)
2
沉淀共存时
,
溶液中
c
(Fe
2+
)
∶
c
(Cu
2+
)=10
4.6
∶
1
C.
除去
CuSO
4
溶液中含有的少量
Fe
2+
,
可加入适量
CuO
D.
向
Z
点对应的饱和溶液中加入少量
NaOH
固体
,
可转化为
Y
点对应的溶液
-
69
-
高考真题体验
典题演练提能
答案
:
C
解析
:
25
℃
时
,
由
K
sp
[Cu(OH)
2
]<
K
sp
[Fe(OH)
2
]
可知溶液
pH
相同时
,
饱和溶液中
c
(Fe
2+
)>
c
(Cu
2+
),
则曲线
a
表示
Cu(OH)
2
饱和溶液中金属阳离子的物质的量浓度的负对数与溶液
pH
的变化关系
,
曲线
b
表示
Fe(OH)
2
饱和溶液中金属阳离子的物质的量浓度的负对数与溶液
pH
的变化关系
。
-
70
-
高考真题体验
典题演练提能
曲线
a
表示
Cu(OH)
2
饱和溶液中金属阳离子的物质的量浓度的负对数与溶液
pH
的变化关系
,
由图可知
,
当
pH=10
时
,-lg
c
(M
2+
)=11.7,
则
K
sp
[Cu(OH)
2
]=
c
(Cu
2+
)
c
2
(OH
-
)=10
-11.7
×(10
-4
)
2
=10
-19.7
,A
项正确
;
当
Fe(OH)
2
和
Cu(OH)
2
沉淀共存时
,
溶液中
c
(OH
-
)
相同
,
当
pH=10
时
,
溶液中
c
(Fe
2+
)
∶
c
(Cu
2+
)=10
-7.1
∶
10
-11.7
=10
4.6
∶
1,B
项正确
;
由该温度下
K
sp
[Cu(OH)
2
]<
K
sp
[Fe(OH)
2
]
可知
,Cu(OH)
2
比
Fe(OH)
2
更难溶
,
加入适量
CuO
调节溶液
pH,
先沉淀的是
Cu
2+
,
无法达到除去少量
Fe
2+
的目的
,C
项错误
;
向
Z
点对应的饱和溶液中加入少量
NaOH
固体
,
溶液中
c
(OH
-
)
增大
,
温度不变
K
sp
[Fe(OH)
2
]
不变
,
c
(Fe
2+
)
减小
,
可能由
Z
点转化为
Y
点
,D
项正确。
-
71
-
高考真题体验
典题演练提能
4
.(2019
广东揭阳二模
)
室温下
,
将尿酸钠
(NaUr)
悬浊液静置
,
取上层清液
,
再通入
HCl,
溶液中尿酸的浓度
c
(HUr)
与
pH
的关系如图所示。已知
:
K
sp
(NaUr)=4.9×10
-5
,
K
a
(HUr)=2.0×10
-6
。下列说法正确的是
(
)
A.
上层清液中
,
c
(Ur
-
)=7.0×10
-2
mol·L
-1
B.
在
M→N
的变化过程中
,
c
(Na
+
)
、
c
(Ur
-
)
将逐渐减小
C.
当
c
(HUr)=
c
(Ur
-
)
时
,
c
(Cl
-
)>
c
(Ur
-
)
D.
当
pH=7
时
,2
c
(Na
+
)=
c
(Ur
-
)+
c
(Cl
-
)
-
72
-
高考真题体验
典题演练提能
答案
:
C
解析
:
上层清液为
NaUr
的饱和溶液
,
则
c
(Ur
-
)= =
7.0×10
-3
mol·L
-1
,A
项错误
;M→N
的变化过程中
,
由于
溶液总体积
几乎不变
,
故
c
(Na
+
)
不会减小
,B
项错误
;
溶液中存在电荷守恒
:
c
(Na
+
)+
c
(H
+
)=
c
(Cl
-
)+
c
(OH
-
)+
c
(Ur
-
),
根据物料守恒
:
c
(Na
+
)=
c
(Ur
-
)+
c
(HUr),
则有
c
(HUr)+
c
(H
+
)=
c
(Cl
-
)+
c
(OH
-
),
当
c
(HUr)=
c
(Ur
-
)
时
,
K
a
(HUr)=
c
(H
+
)=2.0×10
-6
>
c
(OH
-
),
所以
c
(Cl
-
)>
c
(HUr)=
c
(Ur
-
),C
项正确
;pH=7
时
,
溶液中
c
(H
+
)=
c
(OH
-
),
根据溶液中的电荷守恒
:
c
(Na
+
)+
c
(H
+
)=
c
(Cl
-
)+
c
(OH
-
)+
c
(Ur
-
),
则
c
(Na
+
)=
c
(Ur
-
)+
c
(Cl
-
),D
项错误。
-
73
-
高考真题体验
典题演练提能
5
.(2019
福建毕业班质量检查
)
常温下
,
用
0.1 mol·L
-1
MgSO
4
和
0.05 mol·L
-1
Al
2
(SO
4
)
3
溶液进行实验
:
①
各取
25 mL,
分别滴加
0.5 mol·L
-1
NaOH
溶液
,
测得溶液的
pH
与
V
(NaOH)
的关系如图
1
所示
;
②
将两种溶液等体积混合后
,
取出
25 mL,
逐滴加入上述
NaOH
溶液
,
观察现象。下列判断正确的是
(
)
-
74
-
高考真题体验
典题演练提能
A.
图
1
中的曲线
Ⅱ
表示
MgSO
4
与
NaOH
反应的关系
B.
根据图
1
可得
K
sp
[Al(OH)
3
]
的值大于
1.0×10
-32
D
.
图
2
可以表示实验
②
中
n
(
沉淀
)
与
V
(NaOH)
的关系
答案
:
C
解析
:
从图
1
中可以获得以下信息
:
溶液
pH
变化呈现的第一个平台就是
Mg
2+
或
Al
3+
的沉淀过程
,
当
pH
发生突跃时
,
表明沉淀反应基本完成
;
又因为
Mg
2+
、
Al
3+
物质的量相等
,
完全沉淀时所需碱溶液体积比为
2
∶
3,
据此可以判断曲线
Ⅰ
、
Ⅱ
分别为
Mg
2+
、
Al
3+
与碱反应的关系曲线。或从反应起点时溶液
pH
相对大小也可进行判断
:Mg
2+
水解程度小于
Al
3+
,
所以等离子浓度的两种溶液的
pH,
前者大于后者
,
据此也可判定
A
项错误。
-
75
-
高考真题体验
典题演练提能
曲线
Ⅱ
中坐标点
(5,3.5)
处于平台上
,
表明铝离子已经开始沉淀
,
存在沉淀溶解平衡
;
此时溶液中
c
(OH
-
)=10
-10.5
mol·L
-1
,
c
(Al
3+
)<0.1
mol·L
-1
,
故
K
sp
[Al(OH)
3
]=
c
3
(OH
-
)×
c
(Al
3+
)<
c
3
(OH
-
)×0.1=10
-32.5
,
故
B
项错误。
C
项分析思路如下
:
当
Mg
2+
尚未开始沉淀时
,
,
随着
NaOH
溶液加入
,
c
(OH
-
)
增大
,
两种离子浓度比值增大
,C
项正确。依据图
1
可知
,Al
3+
完全沉淀时溶液的
pH
约为
8.9,Mg
2+
开始沉淀时溶液
pH
约为
9,
说明两种离子共存且浓度相等时
,
只有当
Al
3+
几乎沉淀完全后
,Mg
2+
才开始沉淀
;
又因为两种离子沉淀时所需要的
OH
-
物质的量是不相同的
,
故产生沉淀时不应是一条直线
,
故
D
项错误。
-
76
-
高考真题体验
典题演练提能
多知识点的综合考查
1
.(2019
全国
Ⅲ
,11)
设
N
A
为阿伏加德罗常数值。关于常温下
pH=2
的
H
3
PO
4
溶液
,
下列说法正确的是
(
)
A.
每升溶液中的
H
+
数目为
0.02
N
A
C
.
加水稀释使电离度增大
,
溶液
pH
减小
D.
加入
NaH
2
PO
4
固体
,
溶液酸性增强
-
77
-
高考真题体验
典题演练提能
答案
:
B
-
78
-
高考真题体验
典题演练提能
2
.(2019
北京
,12)
实验测得
0.5 mol·L
-1
CH
3
COONa
溶液、
0.5 mol·L
-1
CuSO
4
溶液以及
H
2
O
的
pH
随温度变化的曲线如图所示。下列说法正确的是
(
)
A.
随温度升高
,
纯水中
c
(H
+
)>
c
(OH
-
)
B.
随温度升高
,CH
3
COONa
溶液的
c
(OH
-
)
减小
C.
随温度升高
,CuSO
4
溶液的
pH
变化是
K
W
改
变
与水解平衡移动共同作用的结果
D.
随水温升高
,CH
3
COONa
溶液和
CuSO
4
溶液
的
pH
均降低
,
是因为
CH
3
COO
-
、
Cu
2+
水解平衡移动方向不同
-
79
-
高考真题体验
典题演练提能
答案
:
C
解析
:
随温度升高
,
K
W
增大
,
但纯水中的
c
(H
+
)
仍然等于
c
(OH
-
),A
错误
;
随温度升高
,CH
3
COONa
水解平衡和水的电离平衡均会正向移动
,
c
(OH
-
)
增大
,
图中
pH
略有减小
,
应是水的电离平衡正向移动所致
,B
错误
;
随温度升高
,CuSO
4
水解程度增大
,
c
(H
+
)
增大
,pH
减小
,
而且升温也会导致水的电离平衡正向移动
,
K
W
增大
,C
正确
;D
项
,
随水温升高
,CH
3
COO
-
、
Cu
2+
水解平衡均正向移动
,D
错误。
-
80
-
高考真题体验
典题演练提能
3
.(2017
全国
Ⅲ
,13)
在湿法炼锌的电解循环溶液中
,
较高浓度的
Cl
-
会腐蚀阳极板而增大电解能耗。可向溶液中同时加入
Cu
和
CuSO
4
,
生成
CuCl
沉淀从而除去
Cl
-
。根据溶液中平衡时相关离子浓度的关系图
,
下列说法错误的是
(
)
-
81
-
高考真题体验
典题演练提能
答案
:
C
-
82
-
高考真题体验
典题演练提能
4
.(2016
全国
Ⅲ
,13)
下列有关电解质溶液的说法正确的是
(
)
-
83
-
高考真题体验
典题演练提能
答案
:
D
-
84
-
高考真题体验
典题演练提能
1
.(2019
山西运城模拟
)25
℃
条件下
,
部分弱酸的电离常数如下表所示。下列有关说法不正确的是
(
)
B
.
相同
pH
的
HCOONa
和
NaClO
溶液中离子总浓度前者大
C.
等浓度等体积的
Na
2
S
溶液和
HCOOH
溶液混合后
:
c
(Na
+
)=2
c
(HCOO
-
)+2
c
(HCOOH)
D.
向
NaClO
溶液中通入
H
2
S,
发生的反应为
:H
2
S+NaClOHClO+NaHS
答案
:
D
-
85
-
高考真题体验
典题演练提能
解析
:
由表中电离常数可知
,
酸性强弱顺序为
:HCOOH>H
2
S>HClO>HS
-
,
则对应离子的水解程度由大到小顺序为
:S
2-
>ClO
-
>HS
-
>HCOO
-
。要注意
NaClO
具有强氧化性
,
与
H
2
S
在溶液中发生氧化还原反应
,
不能发生复分解反应。
由
电离常数可知
HCOOH
比
HClO
易电离
,
则等体积、等浓度的
HCOONa
和
NaClO
溶液中
ClO
-
水解程度更大
,NaClO
溶液的
pH
大
,
所以
pH
相同时
c
(HCOONa)>
c
(NaClO),
即
HCOONa
溶液中离子总浓度大于
NaClO
溶液中离子总浓度
,B
项正确
;
等物质的量的
Na
2
S
和
HCOOH
混合后生成等物质的量的
NaHS
和
HCOONa,
物料守恒关系为
c
(Na
+
)=2
c
(HCOO
-
)+2
c
(HCOOH),C
项正确
;
向
NaClO
溶液中通入
H
2
S,
因
NaClO
具有强氧化性
,
与
H
2
S
在溶液中发生氧化还原反应
,
并不是发生复分解反应
,D
项错误。
-
86
-
高考真题体验
典题演练提能
2
.(2019
安徽合肥第二次教学质量检测
)
常温下
,
用
0.10 mol·L
-1
盐酸分别滴定
20.00 mL
浓度均为
0.1 mol·L
-1
CH
3
COONa
溶液和
NaCN
溶液
,
所得滴定曲线如下图所示。下列说法正确的是
(
)
A.
①
点所示溶液中
:
c
(Cl
-
)>
c
(HCN)>
c
(CN
-
)>
c
(OH
-
)
B.
②
点所示溶液中
:
c
(Na
+
)>
c
(Cl
-
)>
c
(CH
3
COO
-
)>
c
(CH
3
COOH)
C.
阳离子物质的量浓度之和
:
②
点与
③
点所示溶液中相等
D.
④
点所示溶液中
:
c
(CH
3
COOH)+
c
(H
+
)-
c
(OH
-
)=0.05 mol·L
-1
-
87
-
高考真题体验
典题演练提能
答案
:
D
解析
:
①
点为向
0.1
mol·L
-1
20.00
mL
NaCN
溶液中加入
0.1
mol·L
-1
10.00
mL
盐酸
,
反应后得到等物质的量浓度的
NaCl
、
HCN
和
NaCN
的混合液
,
由于溶液呈碱性
,
故
c
(OH
-
)>
c
(H
+
),NaCN
的水解程度大于
HCN
的电离程度
,
则溶液中
c
(HCN)>
c
(Cl
-
)>
c
(CN
-
)>
c
(OH
-
),A
项错误
;
②
点为向
0.1
mol·L
-1
20.00
mL
CH
3
COONa
溶液中加入
0.1
mol·L
-1
盐酸且加入盐酸的体积小于
10.00
mL,
所得溶液含等物质的量浓度
CH
3
COOH
和
NaCl,
溶液中剩余
CH
3
COONa
且
CH
3
COONa
的浓度大于
NaCl,
溶液呈酸性
,
故
c
(CH
3
COO
-
)>
c
(Cl
-
),B
项错误
;
-
88
-
高考真题体验
典题演练提能
②
点和
③
点中
c
(H
+
)
相等
,
但加入的盐酸体积不相等
,
溶液中
c
(Na
+
)
不相等
,
故
②
点与
③
点所示溶液中阳离子物质的量浓度之和不相等
,C
项错误
;
④
为向
0.1
mol·L
-1
20.00
mL
CH
3
COONa
溶液中加入
0.1
mol·L
-1
20.00
mL
盐酸
,
两者恰好完全反应得到物质的量浓度均为
0.05
mol·L
-1
的
CH
3
COOH
和
NaCl
的混合液
,
由于
c
(Na
+
)=
c
(Cl
-
),
故溶液中电荷守恒可表示为
c
(H
+
)=
c
(OH
-
)+
c
(CH
3
COO
-
),
由物料守恒
:
c
(CH
3
COOH)+
c
(CH
3
COO
-
)=0.05
mol·L
-1
,
两式合并得
c
(CH
3
COOH)+
c
(H
+
)-
c
(OH
-
)=0.05
mol·L
-1
,D
项正确。
-
89
-
高考真题体验
典题演练提能
3
.(2019
河南郑州一模
)25
℃
时
,
向一定浓度的
Na
2
X
溶液中滴入盐酸
,
溶液的
pH
与离子浓度变化关系如图所示
。
B.
K
a2
(H
2
X)=1.0×10
-10.3
C.NaHX
溶液中
c
(H
+
)>
c
(OH
-
)
D.
当溶液呈中性时
,
c
(Na
+
)=
c
(HX
-
)+2
c
(X
2-
)+
c
(Cl
-
)
-
90
-
高考真题体验
典题演练提能
答案
:
C
-
91
-
高考真题体验
典题演练提能
-
92
-
高考真题体验
典题演练提能
4
.(2019
湖北龙泉中学、随州一中、天门中学三校联考
)
取三份浓度均为
0.1 mol·L
-1
,
体积均为
1 L
的醋酸钠溶液
,
分别加入氯化铵固体、醋酸铵固体、氯化氢气体后所得溶液
pH
变化曲线如图
(
溶液体积变化忽略不计
)
。下列说法不正确的是
(
)
A.
曲线
a
、
b
、
c
分别代表加入醋酸铵、氯化铵、氯化氢
B.
由图可知
K
a
(CH
3
COOH)=
K
b
(NH
3
·H
2
O)=1×10
-7
C.A
点处
c
(CH
3
COO
-
)>
c
(Na
+
)>
c
( )>
c
(OH
-
)>
c
(H
+
)
D.C
点处
c
(CH
3
COO
-
)+
c
(Cl
-
)+
c
(OH
-
)>0.1 mol·L
-1
-
93
-
高考真题体验
典题演练提能
答案
:
B
解析
:
醋酸钠为强碱弱酸盐
,
因醋酸根离子水解
,
溶液呈碱性。往溶液中加入氯化铵固体
,
由于铵根离子水解呈酸性
,
故随着氯化铵的加入
,
溶液将由碱性逐渐变为酸性
,
由于水解微弱
,
所得溶液酸性较弱
,
符合的曲线为
b;
往溶液中通入氯化氢气体
,
随着气体的通入溶液由碱性转变为酸性
,
由于氯化氢为强酸
,
通入量较大时
,
溶液的酸性较强
,
符合的曲线为
c;
加入醋酸铵固体所对应的变化曲线为
a,
据此结合电荷守恒及盐的水解原理进行分析。
-
94
-
高考真题体验
典题演练提能
根据分析可知
,
曲线
a
代表醋酸铵、曲线
b
代表氯化铵、曲线
c
代表氯化氢
,A
项正确
;
当加入固体的物质的量为
0.1
mol
时
,
曲线
b
对应的
pH
等于
7,
说明等浓度的醋酸根离子的水解程度与铵根离子相同
,
即
K
a
(CH
3
COOH)=
K
b
(NH
3
·H
2
O),
但无法计算其电离平衡常数
,B
项错误
;A
点对应溶液中含有的溶质为
0.1
mol
CH
3
COONa
与
0.1
mol
CH
3
COONH
4
,
溶液的
pH>7,
则
c
(OH
-
)>
c
(H
+
),
醋酸根离子的水解程度较小
,
则
c
(CH
3
COO
-
)>
c
(Na
+
),
铵根离子部分水解
,
则
c
(Na
+
)>
c
( ),
溶液中离子浓度的大小关系为
:
c
(CH
3
COO
-
)>
c
(Na
+
)>
c
( )>
c
(OH
-
)>
c
(H
+
),C
项正确
;C
点通入
0.1
mol
HCl,
与
0.1
mol
醋酸钠反应生成
0.1
mol
CH
3
COOH
与
0.1
mol
NaCl,
c
(Cl
-
)=
c
(Na
+
)=0.1
mol·L
-1
,
则
c
(CH
3
COO
-
)+
c
(Cl
-
)+
c
(OH
-
)>0.1
mol·L
-1
,D
项正确。
-
95
-
高考真题体验
典题演练提能
5
.(2019
河北唐山第一次模拟
)
下列说法错误的是
(
)
C.25
℃
时
,
浓度均为
0.1 mol·L
-1
NaOH
和
NH
3
·H
2
O
混合溶液中
c
(OH
-
)>
c
(Na
+
)=
c
(NH
3
·H
2
O)
D.0.2 mol·L
-1
CH
3
COOH
溶液与
0.1 mol·L
-1
NaOH
溶液等体积混合
:2
c
(H
+
)-2
c
(OH
-
)=
c
(CH
3
COO
-
)-
c
(CH
3
COOH)
-
96
-
高考真题体验
典题演练提能
答案
:
C
-
97
-
高考真题体验
典题演练提能
6
.(2019
河北石家庄教学质量检测
)
常温下
,
分别向可水解的
NaA
溶液和
MCl
溶液中加入盐酸和
NaOH
溶液
,
混合溶液
pH
与离子浓度变化关系如下图所示。下列说法不正确的是
(
)
B.
K
a
(HA
)=1×10
-5.5
C.a
点时两溶液中水的电离程度相同
D.0.01 mol·L
-1
MA
溶液中存在
:
c
(M
+
)>
c
(A
-
)>
c
(OH
-
)>
c
(H
+
)
答案
:
C
-
98
-
高考真题体验
典题演练提能