- 113.52 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第三章有机化学知识点总结 第
三章有机化学知识点总结
高一化学知识总结 第 - 1 - 页 共 13 页
第三章 有机化合物知识点
绝大多数含碳的化合物称为有机化合物,简称有机物。像 CO、CO2、碳酸、碳酸盐、金属碳
化物等少数化合物,它们属于无机化合物。
一、烃
1、烃的定义: 仅含碳和氢两种元素的有机物称为碳氢化合物,也称为烃。
2、甲烷、乙烯和苯的性质比较:
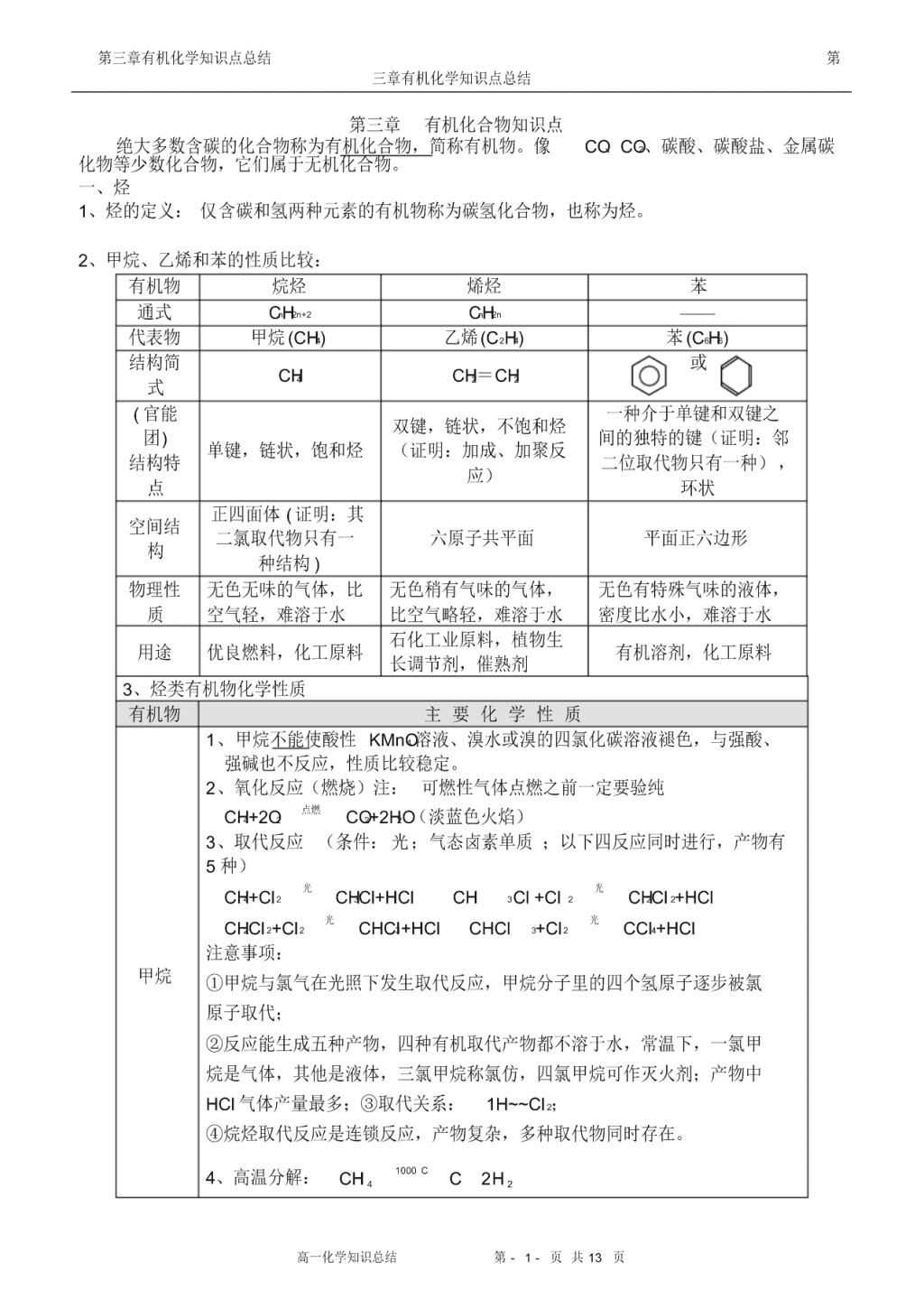
有机物 烷烃 烯烃 苯
通式 CnH2n+2 CnH2n ——
代表物 甲烷 (CH4) 乙烯 (C2H4) 苯 (C6H6)
结构简
式 CH4 CH2=CH2
或
( 官能
团 )
结构特
点
单键,链状,饱和烃
双键,链状,不饱和烃
(证明:加成、加聚反
应)
一种介于单键和双键之
间的独特的键(证明:邻
二位取代物只有一种) ,
环状
空间结
构
正四面体 ( 证明:其
二氯取代物只有一
种结构 )
六原子共平面 平面正六边形
物理性
质
无色无味的气体,比
空气轻,难溶于水
无色稍有气味的气体,
比空气略轻,难溶于水
无色有特殊气味的液体,
密度比水小,难溶于水
用途 优良燃料,化工原料 石化工业原料,植物生
长调节剂,催熟剂 有机溶剂,化工原料
3、烃类有机物化学性质
有机物 主 要 化 学 性 质
甲烷
1、甲烷不能使酸性 KMnO4 溶液、溴水或溴的四氯化碳溶液褪色,与强酸、
强碱也不反应,性质比较稳定。
2、氧化反应(燃烧)注: 可燃性气体点燃之前一定要验纯
CH4+2O2
点燃 CO2+2H2O(淡蓝色火焰)
3、取代反应 (条件: 光 ;气态卤素单质 ;以下四反应同时进行,产物有
5 种)
CH4+Cl 2
光 CH3Cl+HCl CH 3Cl +Cl 2
光 CH2Cl 2+HCl
CH2Cl 2+Cl 2
光 CHCl3+HCl CHCl 3+Cl 2
光 CCl4+HCl
注意事项:
①甲烷与氯气在光照下发生取代反应,甲烷分子里的四个氢原子逐步被氯
原子取代;
②反应能生成五种产物,四种有机取代产物都不溶于水,常温下,一氯甲
烷是气体,其他是液体,三氯甲烷称氯仿,四氯甲烷可作灭火剂;产物中
HCl 气体产量最多;③取代关系: 1H~~Cl 2;
④烷烃取代反应是连锁反应,产物复杂,多种取代物同时存在。
4、高温分解: 2
1000
4 2HCCH C
第三章有机化学知识点总结 第
三章有机化学知识点总结
高一化学知识总结 第 - 2 - 页 共 13 页
乙烯
1.氧化反应
I .燃烧
C2H4+3O2
点燃 2CO2+2H2O(火焰明亮,伴有黑烟)
II .能被酸性 KMnO4 溶液氧化为 CO2,使酸性 KMnO4 溶液褪色。
2.加成反应
CH2=CH2+Br2 CH2Br-CH2Br(能使溴水或溴的四氯化碳溶液褪色)
在一定条件下,乙烯还可以与 H2、Cl 2、HCl、H2O等发生加成反应
CH2=CH2+H2
催化剂
△ CH3CH3
CH2=CH2+HCl
催化剂
△ CH3CH2Cl(氯乙烷 :一氯乙烷的简称)
CH2=CH2+H2O 高温高压
催化剂 CH3CH2OH(工业制乙醇)
3.加聚反应 nCH2=CH2
催化剂
△ (聚乙烯)
注意:①乙烯能使酸性 KMnO4 溶液、溴水或溴的四氯化碳溶液褪色。常利
用该反应 鉴别 烷烃和烯烃,如鉴别甲烷和乙烯。②常用溴水或溴的四氯化
碳溶液来 除去 烷烃中的烯烃,但是不能用酸性 KMnO4 溶液,因为会有二氧
化碳生成引入新的杂质。
苯
难氧化
易取代
难加成
1.不能使酸性高锰酸钾褪色,也不能是溴水发生化学反应褪色,说明苯
的化学性质比较稳定。但可以通过萃取作用使溴水颜色变浅,液体分层,
上层呈 橙红色 。
2.氧化反应(燃烧)
2C6H6+15O2
点燃 12CO2+6H2O(现象:火焰明亮,伴有 浓 烟,说明含碳
量高)
3.取代反应
(1)苯的溴代 :
(溴苯)+ Br 2
FeBr 3 + HBr (只发生单取代反应,取代一
个 H)
①反应条件:液溴(纯溴) ;FeBr3、FeCl3 或铁单质做催化剂
②反应物必须是液溴,不能是溴水。 (溴水则萃取,不发生化学反应)
③溴苯是一种 无 色 油 状液体,密度比水 大 , 难 溶于水
④溴苯中溶解了溴时显褐色,用氢氧化钠溶液除去溴,操作方法为 分
液 。
(2)苯的硝化:
+ HO -NO 2
浓 H 2SO 4
55℃~60 ℃
-NO 2 + H 2O
①反应条件:加热(水浴加热)、浓硫酸(作用: 催化剂、吸水剂)
②浓硫酸和浓硝酸的混合:将浓硫酸沿烧杯内壁慢慢倒入浓硝酸中,边
加边搅拌
③硝基苯是一种 无 色 油 状液体,有 苦杏仁 气味, 有 毒,
密度比水 大 ,难 溶于水。
④硝基苯中溶解了硝酸时显黄色,用氢氧化钠溶液除去硝酸,操作方法
为分液 。
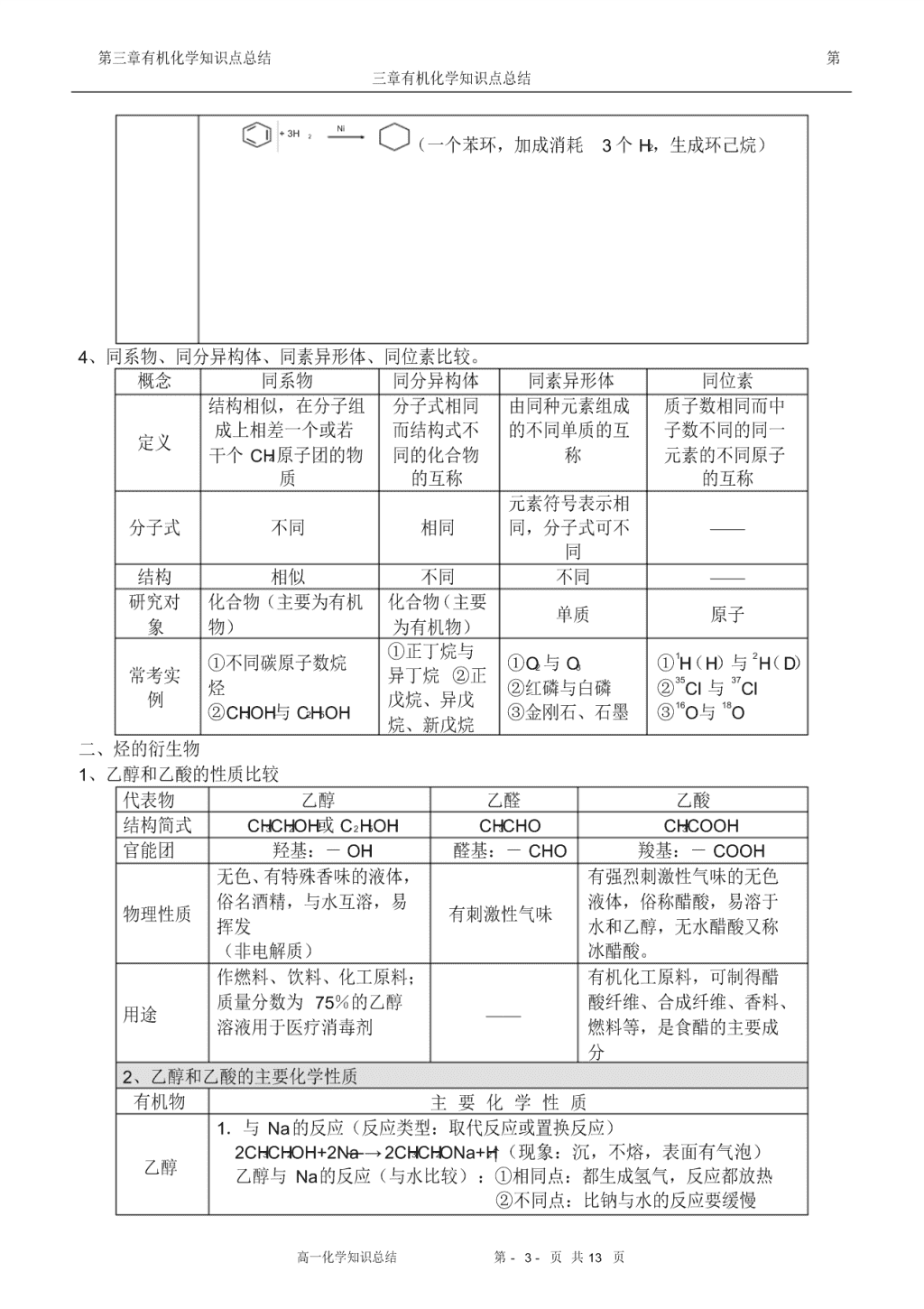
(3)加成反应 (苯具有不饱和性,在一定条件下能和氢气发生加成反应)
第三章有机化学知识点总结 第
三章有机化学知识点总结
高一化学知识总结 第 - 3 - 页 共 13 页
+ 3H 2
Ni
(一个苯环,加成消耗 3 个 H2,生成环己烷)
4、同系物、同分异构体、同素异形体、同位素比较。
概念 同系物 同分异构体 同素异形体 同位素
定义
结构相似, 在分子组
成上相差一个或若
干个 CH2 原子团的物
质
分子式相同
而结构式不
同的化合物
的互称
由同种元素组成
的不同单质的互
称
质子数相同而中
子数不同的同一
元素的不同原子
的互称
分子式 不同 相同
元素符号表示相
同,分子式可不
同
——
结构 相似 不同 不同 ——
研究对
象
化合物 (主要为有机
物)
化合物 (主要
为有机物) 单质 原子
常考实
例
①不同碳原子数烷
烃
②CH3OH与 C2H5OH
①正丁烷与
异丁烷 ②正
戊烷、异戊
烷、新戊烷
①O2 与 O3
②红磷与白磷
③金刚石、石墨
①1H(H)与 2H(D)
②35Cl 与 37Cl
③16O与 18O
二、烃的衍生物
1、乙醇和乙酸的性质比较
代表物 乙醇 乙醛 乙酸
结构简式 CH3CH2OH或 C2H5OH CH3CHO CH3COOH
官能团 羟基:- OH 醛基:- CHO 羧基:- COOH
物理性质
无色、有特殊香味的液体,
俗名酒精,与水互溶,易
挥发
(非电解质)
有刺激性气味
有强烈刺激性气味的无色
液体,俗称醋酸,易溶于
水和乙醇,无水醋酸又称
冰醋酸。
用途
作燃料、 饮料、 化工原料;
质量分数为 75%的乙醇
溶液用于医疗消毒剂 ——
有机化工原料,可制得醋
酸纤维、合成纤维、香料、
燃料等,是食醋的主要成
分
2、乙醇和乙酸的主要化学性质
有机物 主 要 化 学 性 质
乙醇
1.与 Na的反应(反应类型:取代反应或置换反应)
2CH3CH2OH+2Na―→ 2CH3CH2ONa+H2↑(现象:沉,不熔,表面有气泡)
乙醇与 Na的反应(与水比较) :①相同点:都生成氢气,反应都放热
②不同点:比钠与水的反应要缓慢
第三章有机化学知识点总结 第
三章有机化学知识点总结
高一化学知识总结 第 - 4 - 页 共 13 页
结论: ①乙醇分子羟基中的氢原子没有水分子中的氢原子活泼; ②1mol
乙醇与足量 Na 反应产生 0.5mol H 2,证明乙醇分子中有一个氢原子与其
他的氢原子不同;
③2 —HO~~~~H2,两个羟基对应一个 H2;④单纯的— OH可与 Na反应,但
不能与 NaHCO3 发生反应。
2.氧化反应
(1)燃烧(淡蓝色火焰,放出大量的热)
CH3CH2OH+3O2
点燃 2CO2+3H2O 可作燃料,乙醇汽油
(2)在铜或银催化条件下:可以被 O2 氧化成乙醛( CH3CHO)
2CH3CH2OH+O2 2CH3CHO+2H2O(总反应)
现象:红亮的铜丝在酒精灯上加热后变为 黑 色,将黑色的氧化铜伸
入乙醇中又变为红色;并且可以闻到有刺激性气味气体产生(乙醛)
①反应断键情况:
②Cu或 Ag,作催化剂,反应前后质量保持不变。
(3)乙醇可以使紫红色的酸性高锰酸钾溶液褪色, 与之相似的物质有 乙
烯 ;
可以使 橙 色的重铬酸钾溶液变为 绿 色,该反应可用于检验酒
后驾驶。
总结: 燃烧反应时的断键位置: 全断
与钠反应时的断键位置: ①
在铜催化氧化时的断键位置: ①、③
(4)检验乙醇中是否含有水,用无水硫酸铜;除去乙醇中的水得到无水
乙醇,加生石灰,蒸馏。
乙酸
1. 具有酸的通性: CH3COOH CH3COO-+H+( 一元弱酸 )
①可使酸碱指示剂变色,如使紫色石蕊试液变红(变色是反应生成了有
色物质) ;
②与活泼金属(金属性 H之前),碱( Cu(OH)2),弱酸盐反应,如 CaCO3、
Na2CO3
③酸性比较: CH3COOH > H2CO3
2CH3COOH+CaCO3―→ 2(CH3COO)2Ca+CO2↑+ H2O(强酸制弱酸)
2. 酯化反应(实质:酸去羟基,醇去氢——同位素标记法)
CH3COOH+HO-C2H5 CH3COOC2H5+H2O
反应类型: 酯化反应,属于取代反应;是可逆反应
反应有一定限度,乙酸乙酯产率不可能达到 100%
(1) 试管 a 中药品加入顺序是 :
乙醇 3 mL、浓硫酸( 催化剂、吸水剂 )、乙酸各 2 mL
(2) 为了防止试管 a 中的液体发生暴沸,加热前应采取的措施是:加碎瓷
片(或沸石)
(3) 实验中加热试管 a 的目的是:①加快反应速率 ②蒸出乙酸乙酯,提
高产率
(4) 长导管的作用是:导气,冷凝回流;不伸入饱和碳酸钠溶液中:防止
倒吸
(5) 试管 b 中加有饱和 Na2CO3 溶液,其作用是( 3 点) :
①中和乙酸,②溶解乙醇,③降低乙酸乙酯的溶解度,利于分层
(6) 反应结束后,振荡试管 b,静置。观察到的现象是:饱和碳酸钠溶液
上面有油状液滴生成,且能闻到香味。
第三章有机化学知识点总结 第
三章有机化学知识点总结
高一化学知识总结 第 - 5 - 页 共 13 页
三、烷烃
1、烷烃的概念:碳原子间都以碳碳单键结合成链状,剩余价键均与氢原子结合,使每个碳原子
的化合价都达到“饱和”的饱和 链烃 ,或称烷烃。 呈锯齿状 。
2、烷烃物理性质:
状态: 一般情况下, 1-4 个碳原子烷烃为气态, 5-16 个碳原子为液态, 16 个碳原子以上为固态。
溶解性:烷烃都难溶于水,易溶于有机溶剂。
熔沸点:随着碳原子数的递增,熔沸点逐渐逐渐升高;相同碳原子数时,支链越多,熔沸点越
低。
密度:随着碳原子数的递增,密度逐渐增大,但都比水的密度小。
3、烷烃的化学性质
①一般比较稳定,在通常情况下跟酸、碱和高锰酸钾等都不反应。②氧化反应:在点燃条件下,
烷烃能燃烧;③取代反应( 烷烃特征反应 ):在光照条件下能跟卤素发生取代反应。
一、选择题
1.下列生活中的化学小实验不合理的是 ( )
A.用灼烧并闻气味的方法区分化纤织物与纯毛织物
B.用食用醋除去热水瓶中积存的水垢
C.用纯碱溶液洗涤沾有油污的器具
D.用米汤检验加碘盐中的碘酸钾
2.下列关于有机物分子结构说法不正确的是 ( )
A.苯的邻位二溴代物只有一种能证明苯分子中不存在碳碳单、双键交替的排布
B.乙烯容易与溴水发生加成反应,且 1 mol 乙烯完全加成消耗 1 mol 溴单质能证明乙烯分
子里含有一个碳碳双键
C.甲烷的一氯代物只有一种可证明甲烷为正四面体结构
D.1 mol 乙醇与足量的钠反应生成 0.5 mol 氢气,可证明乙醇分子中只有一个羟基
3.下列叙述错误的是 ( )
A.乙烯和苯都能使溴水褪色,褪色的原因相同
B.淀粉、油脂、蛋白质都能水解,但水解产物不同
C.煤油可由石油分馏获得,可用作燃料和保存少量金属钠
D.乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和 Na2CO3
溶液除去
4.生活中常遇到一些涉及化学知识的问题,下列叙述正确的是 ( )
A.某品牌八宝粥不含糖类,糖尿病患者可放心食用