- 76.00 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2018-2019学年青海省西宁市第四高级中学高一上学期第三次(12月)月考化学试题
相对原子质量:H: 1 C: 12 O :16 Na:23 S:32 Cl : 35.5 Mg:24 Fe:56 Al:27
一、选择题(每小题只有一个选项符合题意,每小题2分,共44分)
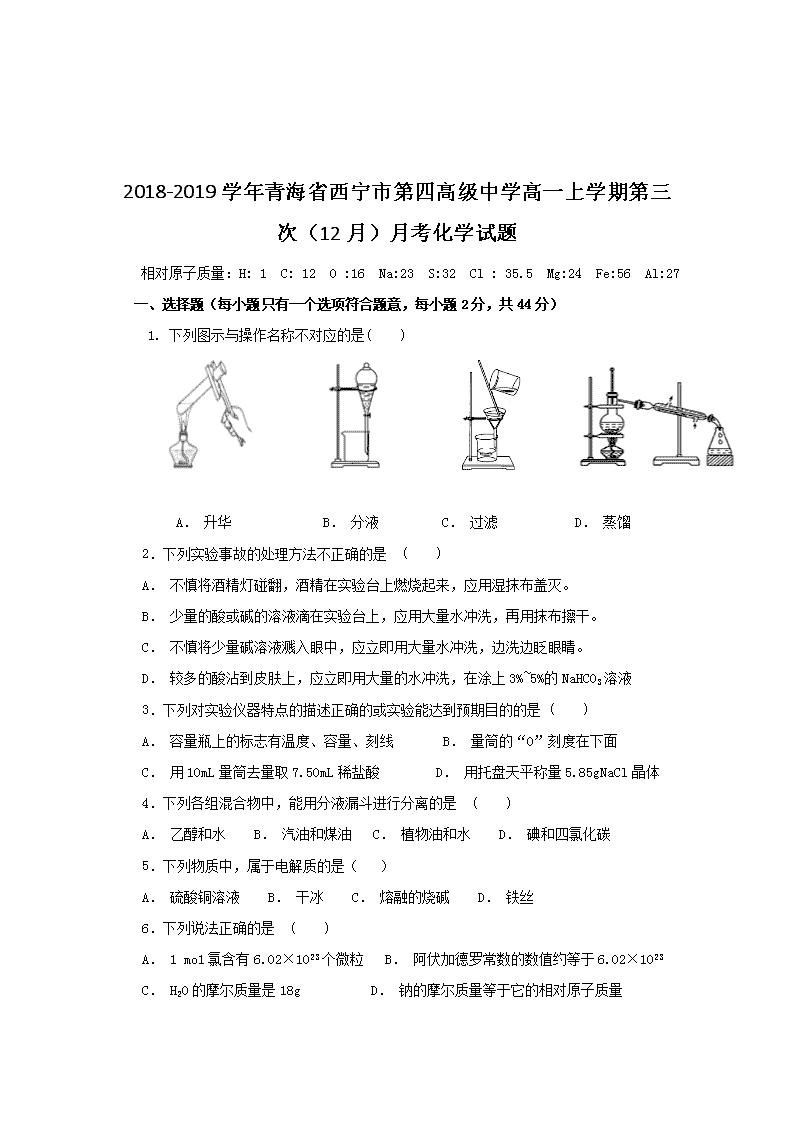
1. 下列图示与操作名称不对应的是( )
A. 升华 B. 分液 C. 过滤 D. 蒸馏
2.下列实验事故的处理方法不正确的是 ( )
A. 不慎将酒精灯碰翻,酒精在实验台上燃烧起来,应用湿抹布盖灭。
B. 少量的酸或碱的溶液滴在实验台上,应用大量水冲洗,再用抹布擦干。
C. 不慎将少量碱溶液溅入眼中,应立即用大量水冲洗,边洗边眨眼睛。
D. 较多的酸沾到皮肤上,应立即用大量的水冲洗,在涂上3%~5%的NaHCO3溶液
3.下列对实验仪器特点的描述正确的或实验能达到预期目的的是 ( )
A. 容量瓶上的标志有温度、容量、刻线 B. 量筒的“0”刻度在下面
C. 用10mL量筒去量取7.50mL稀盐酸 D. 用托盘天平称量5.85gNaCl晶体
4.下列各组混合物中,能用分液漏斗进行分离的是 ( )
A. 乙醇和水 B. 汽油和煤油 C. 植物油和水 D. 碘和四氯化碳
5.下列物质中,属于电解质的是( )
A. 硫酸铜溶液 B. 干冰 C. 熔融的烧碱 D. 铁丝
6.下列说法正确的是 ( )
A. 1 mo1氯含有6.02×1023个微粒 B. 阿伏加德罗常数的数值约等于6.02×1023
C. H2O的摩尔质量是18g D. 钠的摩尔质量等于它的相对原子质量
7.下列各物质所含原子数目,按由大到小顺序排列的是 ( )
①0.5mol NH3 ②标准状况下22.4L He ③4℃ 9mL 水 ④0.2mol H2SO4
A. ①③④② B. ④③②① C ②③④① D.①④③②
8.下列溶液中c(Cl—)与120 mL 2mol·L—1KCl溶液中c(Cl—)相等的是 ( )
A. 60mL 1mol·L—1MgCl2溶液 B. 60mL 2mol·L—1ZnCl2溶液
C. 40mL 2mol·L—1AlCl3溶液 D. 480mL 1mol·L—1NaCl溶液
9.铁与稀硫酸反应的离子方程式书写正确的是 ( )
A. 2Fe + 6H+ = 2Fe3+ + 3H2↑ B. Fe + 2H+ = Fe2+ + H2↑
C. Fe + 2H+ + SO42- = FeSO4↓+ H2↑ D. 2Fe + 6H+ + 3SO42- = Fe2(SO4)3↓+ 3H2↑
10.能用H++OH-=H2O来表示的化学反应是 ( )
A. 氢氧化镁和稀盐酸反应 B. Ba(OH)2溶液滴入稀硫酸中
C. 澄清石灰水和稀硝酸反应 D. 氢氧化钠和稀醋酸反应
11.下列反应的离子方程式不正确的是 ( )
A. 澄清石灰水与Na2CO3溶液混合:Ca2+ + CO32- = CaCO3↓
B. 碳酸钠与足量的醋酸反应:CO32- + 2H+ = H2O + CO2↑
C. 少量金属钠加到冷水中:2Na + 2H2O = 2Na++2OH- + H2↑
D. 氢氧化铜加到盐酸中:Cu(OH)2 + 2H+ = Cu2+ + 2H2O
12.在下列变化中,需要加入合适的氧化剂才能实现的是 ( )
A. KMnO4→O2 B. CO2→CO C. Br-→Br2 D. Fe2O3→Fe
13.下列反应中属于氧化还原反应,但不属于四种基本反应类型的是 ( )
A. CuO + H2 Cu + H2O B. 2KMnO4 K2MnO4 + MnO2+O2↑
C. Fe2O3 + 3CO 2Fe + 2CO2 D. NaOH + HCl = NaCl + H2O
14.氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用不相同的是 ( )
①2Na2O2+2H2O=4NaOH+O2↑;②2F2+2H2O=4HF+O2;
③4NO2+O2+2H2O=4HNO3; ④2Na+2H2O=2NaOH+H2↑
A.①③ B. ②③ C. ③④ D. ②④
15.氨的催化氧化是工业制硝酸的重要反应:4NH3+5O24NO+6H2O,对于该反应判断正确的是 ( )
A. O2被氧化
B. 该反应是置换反应
C. NH3是氧化剂
D. 若有17 g NH3参加反应,则反应中转移的电子数为5 mol
16.下列说法正确的是 ( )
A. 切开的金属Na暴露在空气中,光亮表面逐渐变暗:2Na+O2 ═ Na2O2
B. 钠与盐酸反应的离子方程式:2Na + 2H+ ═ 2Na+ + H2↑
C. 常温下Na与足量O2反应生成Na2O , 随着与氧气的接触最终生成Na2O2
D. Na的金属活动性比Mg强,故可用Na与MgCl2溶液反应制Mg
17.常温下,下列物质可以用铝制容器存放的是 ( )
A. 浓盐酸 B. 浓硫酸 C. 稀硝酸 D. 氢氧化钠溶液
18.可用于治疗胃酸过多的物质是 ( )
A. 碳酸氢钠 B. 氯化钠 C. 氯化钾 D. 氢氧化钠
19.将0.2mol钠、镁、铝、 铁分别放入100ml1 mol·L—1的盐酸中,产的气体体积比是(同温同压下)( )
A. 1:2:3:2 B. 6:3:2:3 C. 1:1:1:1 D. 2:1:1:1
20.把镁粉中混有的少量铝粉除去,应选用的试剂是 ( )
A. 稀盐酸 B. 烧碱溶液 C. 硫酸铝溶液 D. 硫酸镁溶液
21.做焰色反应实验用的铂丝,每试验一种样品后都必须 ( )
A. 用水洗涤2~3次后再使用
B. 用滤纸擦干后才可使用
C. 用盐酸洗涤后,经蒸馏水冲洗,方可使用
D. 用盐酸洗涤后,再在酒精灯火焰上灼烧到没有颜色,才可使用
22.碳酸氢钠受热容易分解为碳酸钠。现加热5.00g的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了0.93g,则原混合物中碳酸钠的质量为 ( )
A. 2.48g B. 2.58g C. 4.16g D. 4.41g
二、填空题((每空2分,共56分)
23.(共14分)实验室用密度为1.25g/mL,质量分数为36.5%浓盐酸配制250mL 0.5mol/L的稀盐酸,请填空并回答下列问题:
(1)浓盐酸的物质的量浓度为_________________
(2)配制250mL 0.5mol/L的稀盐酸用量筒量取浓盐酸的体积____________mL,应选用容量瓶的规格_________mL
(3)配制时,其正确的操作顺序是_________________(用下列字母表示,每个字母只能用一次)
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡。
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀。
C.将已冷却的盐酸沿玻璃棒注入容量瓶中。
D.将容量瓶盖紧,振荡,摇匀。
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切。
F.继续往容量瓶内小心加水,直到液面接近刻度线1—2cm处。
(4)操作A中,将洗涤液都移入容量瓶,其目的是____________________________________,
若实验过程E中加蒸馏水时不慎超过了刻度线,该如何处理?_____________________。
(5)向容量瓶中转移溶液时不慎有液滴掉在容量瓶外面,则浓度_______(偏大、偏小、不影响)。
24.(共12分)设NA为阿伏加德罗常数的数值,完成下列填空:
(1)1molCH4含 碳原子________mol,含氢原子___________ mol。
(2)标准状况下,0.5mol CO2分子所占有的体积为________。
(3)标准状况下,33.6LH2所含的分子数目为________。
(4)34g H2O2的物质的量为________; 0.5molH2SO4的质量为________________。
25.(共8分)写出下列反应的离子方程式:
(1)二氧化碳通入碳酸钠溶液中:________________________________________________
(2)在硫酸铝溶液中滴加氨水制备氢氧化铝 :_____________________________________
(3)氢氧化钡与硫酸铜溶液反应:________________________________________________
(4)金属钠与水反应:________________________________
26. (共10分) 根据反应Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O,回答下列问题:
(1)用“双线桥法”标出电子转移的方向和数目________________。
(2)请用化学式写出该反应中的还原剂是__________;氧化剂是__________;
氧化产物是__________。
(3)还原剂和还原产物物质的量之比__________。
27. (共12分)某银白色金属单质A在空气中加热燃烧时发出黄色火焰,得到淡黄色固体B,A暴露在空气中足够长时间变为C,B和酸性气体D能生成C,A和B都能与水生成E,E和D也能生成C。回答下列问题。
(1)写出下列物质的化学式:C_____________,D_____________,E_____________。
(2)写出下列反应的化学方程式:
①A和水生成E:______________________________________________________;
②B和D生成C:______________________________________________________;
③A在空气中加热:___________________________________________________ 。
西宁市第四高级中学2018-2019学年第一学期第三次月考
高 一 化 学 参考答案
一.选择题:
1-5 ABACC ; 6-10 BAABC ; 11-_15 BCCDD ; 16-20 BBADB; 21-22 DA
二 非选择题:
23(14分,每空2分)
(1) 12.5mol/L (2) 10.0 ;250 (3) B、C、A、F、E、D
(4)保证溶质全部转入容量瓶,减小误差; 重新配制
(5)偏小
24(12分,每空2分)
(1)1 ;4 (2)11.2L (3)1.5NA (4)1mol;49g
25(8分,每空2分)
(1) CO2 + CO32- + H2O = 2HCO3-
(2)Al3+ + 3NH3﹒H2O = Al(OH)3 ↓ + 3 NH4+
(3)Ba2++2OH-+Cu2++SO42-=BaSO4↓+Cu(OH)2↓
(4)2Na+2H2O=2Na++2OH-+H2↑
26(10分,每空2分)
(1)
(2)Cu ; H2SO4 ; CuSO4
(3)1:1
27(12分,每空2分)
(1)Na2CO3 CO2 NaOH
(2)① 2Na+2H2O═2NaOH+H2↑
② 2Na2O2+2CO2═2Na2CO3+O2
③ 2Na+2O2Na2O2