- 225.84 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
一、选择题(每小题5分,共25分)
1.下列关于金属及金属键的说法正确的是
A.金属键具有方向性与饱和性
B.金属键是金属阳离子与自由电子间的相互作用
C.金属导电是因为在外加电场作用下产生自由电子
D.金属具有光泽是因为金属阳离子吸收并放出可见光
解析 A项,金属键是金属离子和自由电子之间的作用,自由电子属于整个晶体,不具有方向性和饱和性;C项,金属导电是因为在外加电场作用下,自由电子的定向移动;D项,金属具有光泽的原因是电子吸收并放出可见光。
答案 B
2.下表给出几种氯化物的熔点和沸点:
NaCl
MgCl2
AlCl3
SiCl4
熔点/℃
801
714
190
-70
沸点/℃
1 413
1 412
180
57.57
有关表中所列四种氯化物的性质,有以下叙述:①氯化铝在加热时能升华,②四氯化硅在晶态时属于分子晶体,③氯化钠晶体中微粒之间以范德华力结合,④氯化铝晶体是典型的离子晶体。其中与表中数据一致的是
A.①② B.②③
C.①②④ D.②④
解析 氯化铝的熔、沸点都很低,其晶体应该是分子晶体,并且沸点比熔点还低,加热时容易升华;四氯化硅是共价化合物,并且熔、沸点很低,应该属于分子晶体;氯化钠是离子晶体,以离子键结合。
答案 A
3.下列化合物中,含有非极性共价键的离子化合物是
A.CaC2 B.N2H4
C.Na2S2 D.NH4NO3
解析 N2H4是共价化合物,NH4NO3中不含非极性共价键。
答案 AC
4.下列变化需克服相同类型作用力的是
A.碘和干冰的升华 B.硅和C60的熔化
C.氯化氢和氯化钾的溶解 D.溴和汞的气化
解析 A项变化克服的都是分子间作用力,正确,硅和C60的融化分别克服的是共价键,分子间作用力,B项错误,氯化氢和氯化钾的溶解分别克服的是共价键,离子键,C项错误,溴和汞的气化分别克服的是分子间作用力,金属键,D项错误。
答案 A
5.氮氧化铝(AlON)属原子晶体,是一种超强透明材料,下列描述错误的是
A.AlON和石英的化学键类型相同
B.AlON和石英晶体类型相同
C.AlON和Al2O3的化学键类型不同
D.AlON和Al2O3晶体类型相同
解析 AlON与石英(SiO2)均为原子晶体,所含化学键均为共价键,故A、B项正确;Al2O3是离子晶体,晶体中含离子键,不含共价键,故C项正确、D项错误。
答案 D
二、非选择题(共75分)
6.(15分)硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)硅主要以硅酸盐、____________等化合物的形式存在于地壳中。
(2)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以________相结合,其晶胞中共有8个原子,其中在面心位置贡献________个原子。
(3)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为______________________________________。
(4)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
化学键
C—C
C—H
C—O
Si—Si
Si—H
Si—O
键能/ (kJ·mol-1)
356
413
336
226
318
452
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是________________________________________________________________________。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是________________________________
________________________________________________________________________。
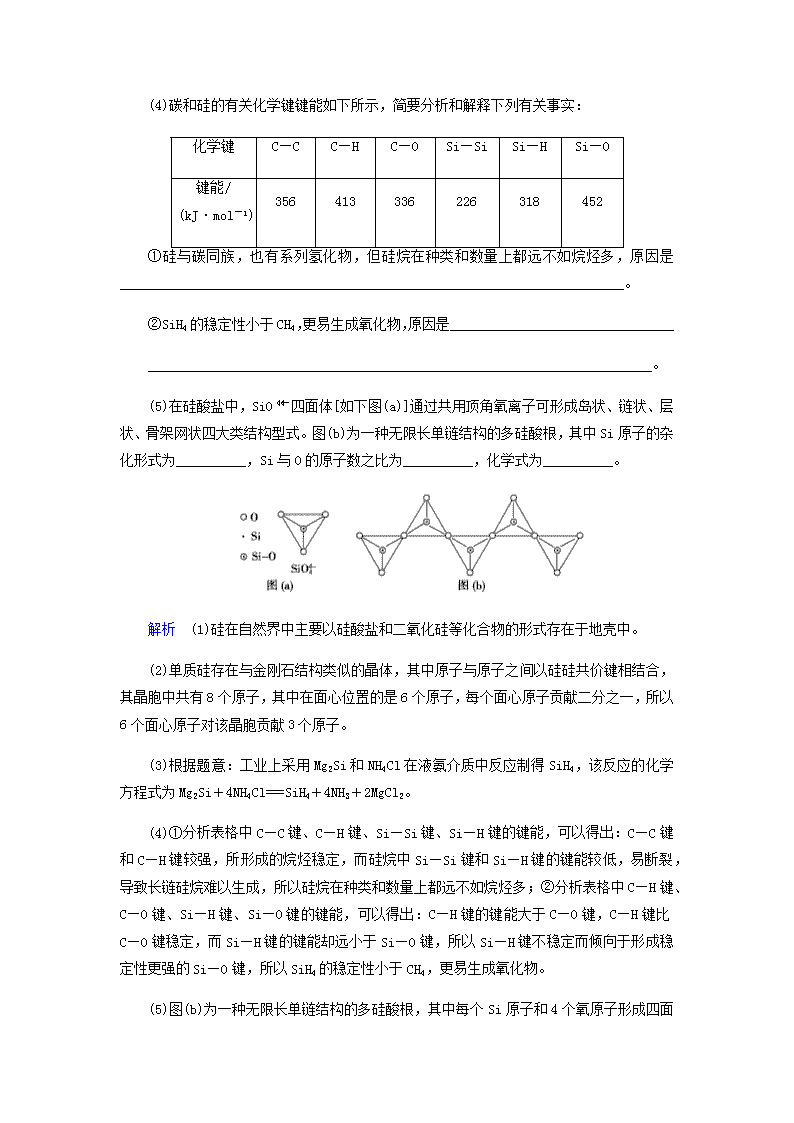
(5)在硅酸盐中,SiO四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为__________,Si与O的原子数之比为__________,化学式为__________。
解析 (1)硅在自然界中主要以硅酸盐和二氧化硅等化合物的形式存在于地壳中。
(2)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以硅硅共价键相结合,其晶胞中共有8个原子,其中在面心位置的是6个原子,每个面心原子贡献二分之一,所以6个面心原子对该晶胞贡献3个原子。
(3)根据题意:工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl===SiH4+4NH3+2MgCl2。
(4)①分析表格中C—C键、C—H键、Si—Si键、Si—H键的键能,可以得出:C—C键和C—H键较强,所形成的烷烃稳定,而硅烷中Si—Si键和Si—H键的键能较低,易断裂,导致长链硅烷难以生成,所以硅烷在种类和数量上都远不如烷烃多;②分析表格中C—H键、C—O键、Si—H键、Si—O键的键能,可以得出:C—H键的键能大于C—O键,C—H键比C—O键稳定,而Si—H键的键能却远小于Si—O键,所以Si—H键不稳定而倾向于形成稳定性更强的Si—O键,所以SiH4的稳定性小于CH4,更易生成氧化物。
(5)图(b)为一种无限长单链结构的多硅酸根,其中每个Si原子和4
个氧原子形成四面体结构,故Si原子杂化方式为sp3,Si与O原子数之比为1∶3,化学式为[SiO3](或SiO)。
答案 (1)二氧化硅 (2)共价键 3 (3)Mg2Si+4NH4Cl===SiH4+4NH3+2MgCl2 (4)①C—C键和C—H键较强,所形成的烷烃稳定。而硅烷中Si—Si键和Si—H键的键能较低,易断裂。导致长链硅烷难以生成 ②C—H键的键能大于C—O键,C一H键比C—O键稳定。而Si—H键的键能却远小于Si—O键,所以Si—H键不稳定而倾向于形成稳定性更强的Si—O键 (5)sp3 1∶3 [SiO3](或SiO)
7.(15分)MnO2是碱锰电池材料中最普通的正极材料之一,在活性材料MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能。
(1)写出基态Mn原子的核外电子排布式______________________________________。
(2)CoTiO3晶体结构模型如图1所示。在CoTiO3晶体中1个Ti原子、1个Co原子,周围距离最近的O原子数目分别为________个、________个。
(3)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。O2在其催化作用下,可将CN-氧化成CNO-,进而得到N2。与CNO-互为等电子体的分子、离子化学式分别为________、________(各写一种)。
(4)三聚氰胺是一种含氮化合物,其结构简式如图2所示。
三聚氰胺分子中氮原子轨道杂化类型是________,1 mol三聚氰胺分子中σ键的数目为________。
解析 (1)1s22s22p63s23p63d54s2。
(2)采用沿X、Y、Z三轴切割的方法确定个数,所以分别是6和12。
(4)根据价层电子对数判断杂化类型,环上的N原子含有2个σ键,氨基含有3个σ键和一个孤电子对,所以sp2、sp3杂化;一个分子中含有15个σ键,所以1 mol三聚氰胺中含有15NA。
答案 (1)1s22s22p63s23p63d54s2 (2)6 12
(3)CO2(或N2O、CS2、BeCl2等合理均可) N (4)sp2、sp3 15NA
8.(15分)铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第ⅠB族。Cu2+的核外电子排布式为________________________。
(2)如图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为________。
(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构示意图如下:
下列说法正确的是________(填字母)。
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________________________。
(5)Cu2O的熔点比Cu2S的________(填“高”或“低”),请解释原因_______________________________________________________________________。
解析 (1)电子排布为结构化学中的重点。特别是24号、29号,存在半充满和全充满状态的元素。Cu2+应先写出Cu原子的电子排布,然后从外向内失去2个电子。
(2)对O2-个数的计算,面上的按算,顶点上按算,棱上按算,体心按1个算,可得O2-个数为:×8+×2+×4+1=4(个)。
(3)H2O中氧原子采用sp3杂化,SO中的氧不是。CuSO4应是离子晶体,不是分子晶体。
(4)电负性:F>N>H,所以NH3中的N原子提供孤对电子共用,Cu2+提供空轨道,形成配位键,而NF3中N原子受F原子的影响,不易提供孤对电子。
(5)离子晶体中,离子键越短,离子键越强,离子化合物熔点越高,由于O2-的半径小于S2-的半径,所以Cu+与O2-形成的离子键强于Cu+与S2-形成的离子键。
答案 (1)1s22s22p63s23p63d9或[Ar]3d9 (2)4 (3)BD (4)F的电负性比N大,N—F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子 (5)高 Cu2O与Cu2S相比,阳离子相同、阴离子所带电荷也相同,但O2-的半径比S2-小,所以Cu2O的晶格能更大,熔点更高
9.(15分)图A所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸,a的一种同素异形体的晶胞如图B所示。
回答下列问题:
(1)图B对应的物质名称是________,其晶胞中的原子数为________,晶体类型为________。
(2)d中元素的原子核外电子排布式为________________________________________。
(3)图A中由二种元素组成的物质中,沸点最高的是________,原因是____________________,该物质的分子构型为________,中心原子的杂化轨道类型为________。
(4)图A中的双原子分子中,极性最大的分子是____________________________________。
(5)k的分子式为________,中心原子的杂化轨道类型为________,属于________分子(填“极性”或“非极性”)。
解析 (1)每个原子周围有4个键,判断为金刚石。(2)a为C,则b为H2、c为O2,因i是常见的酸,只由b、d形成可判断为盐酸,则d为Cl2。(3)除a、b、c、d外,f为CO,g为CO2,i为HCl,而k与水反应生成CO2与盐酸,该反应没在教材中出现过,且由f、d反应得到,应含C、O、Cl三种元素,只能判断为COCl2。所有两元素形成的物质中,只有水是液态,其它都是气体。(4)所有双原子分子中,只有H、Cl电负性差值最大,因而极性最大。(5)COCl2中羰基的平面结构显示其为sp2杂化。
答案 (1)金刚石 8 原子晶体 (2)1s22s22p63s23p5 (3)H2O 分子间形成氢键 Ⅴ形(或角形) sp3 (4)HCl (5)COCl2 sp2 极性
10.(15分)氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如图所示:
请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是__________________________________、
___________________________________________________________________________;
(2)基态B___________________________________________________________________;
B和N相比,电负性较大的是________,BN中B元素的化合价为________;
(3)在BF3分子中,F—B—F的键角是________,B原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4,BF的立体构型为____________;
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间化学键为____________,层间作用力为___________________________________________________________________;
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5 pm。立方氮化硼晶胞中含有________个氮原子、________个硼原子,立方氮化硼的密度是________ g·cm-3(只要求列算式,不必计算出数值。阿伏加德罗常数为NA)。
解析 (1)已知反应物和主要的生成物,根据原子守恒判断出次要生成物,写出化学方程式,配平即可。
(2)B原子核外有5个电子,其基态电子排布式为1s22s22p1;BN中N的电负性较大,N为-3价,那么B就为+3价。
(3)因为BF3的空间构型为平面三角形,所以F—B—F的键角为120°。
(4)六方氮化硼晶体结构与石墨相似,故B、N以共价键相结合构成分子晶体,其层间作用力是分子间作用力。
答案 (1)B2O3+3CaF2+3H2SO42BF3↑+3CaSO4+3H2O B2O3+2NH32BN+3H2O (2)1s22s22p1 N +3 (3)120° sp2 正四面体 (4)共价键(极性共价键) 分子间作用力 (5)4 4