- 621.00 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
化学高考一轮复习《离子反应及离子方程式》质量评估试题
(考试时间:45分钟 满分:100分)
一、单项选择题:本题包括10小题,每小题5分,共50分。
1.与氢硫酸反应有沉淀生成的电解质是( )
A.硫酸铜 B.氢氧化钠
C.硫酸亚铁 D.二氧化硫
答案:A
解析:A项,CuSO4是盐,属于电解质,加入氢硫酸,会发生反应:CuSO4+H2S===CuS↓+H2SO4,产生黑色沉淀,正确;B项,氢氧化钠是碱,属于电解质,与氢硫酸发生反应:2NaOH+H2S===Na2S+2H2O,产生的Na2S是可溶性的物质,没有沉淀产生,错误;C项,硫酸亚铁是盐,属于电解质,由于酸性:硫酸>氢硫酸,属于二者不能发生反应,无沉淀产生,错误;D项,二氧化硫与硫化氢会发生反应:SO2+2H2S===3S↓+2H2O,产生沉淀,但是SO2是非电解质,错误。
2.为防止流感病毒的传播,许多公共场所都注意环境消毒,以下消毒药品属于强电解质的是( )
答案:B
解析:A项为混合物,酒精为非电解质,醋酸为弱电解质。
3.某未知溶液可能含Cl-、CO、Na+、SO、Al3+,将溶液滴在蓝色石蕊试纸上,试纸变红。取少量试液,滴加硝酸酸化的氯化钡溶液,有白色沉淀生成;在上层清液中滴加硝酸银溶液,产生白色沉淀。下列判断合理的是( )
A.一定有Cl- B.一定有SO
C.一定没有Al3+ D.可能有CO
答案:B
解析:本题考查离子共存、检验。溶液滴在蓝色石蕊试纸上,试纸变红,说明溶液呈酸性含有H+,则一定没有CO;取少量试液,滴加硝酸酸化的氯化钡溶液,有白色沉淀生成,一定有SO;在上层清液中滴加硝酸银溶液,产生白色沉淀,可以为Ag2SO4,无法判断是否含有Cl-,所以选B。
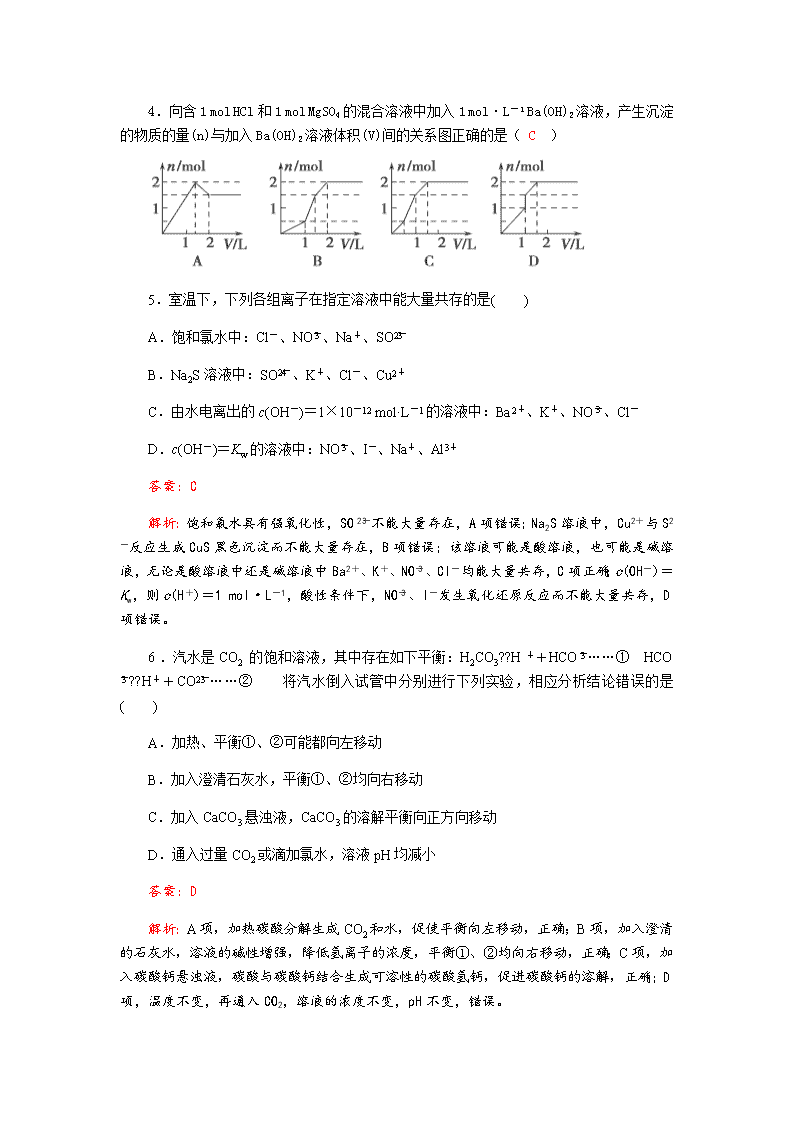
4.向含1 mol HCl和1 mol MgSO4的混合溶液中加入1 mol·L-1 Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是( C )
5.室温下,下列各组离子在指定溶液中能大量共存的是( )
A.饱和氯水中:Cl-、NO、Na+、SO
B.Na2S溶液中:SO、K+、Cl-、Cu2+
C.由水电离出的c(OH-)=1×10-12 mol·L-1的溶液中:Ba2+、K+、NO、Cl-
D.c(OH-)=Kw的溶液中:NO、I-、Na+、Al3+
答案:C
解析:饱和氯水具有强氧化性,SO不能大量存在,A项错误;Na2S溶液中,Cu2+与S2-反应生成CuS黑色沉淀而不能大量存在,B项错误;该溶液可能是酸溶液,也可能是碱溶液,无论是酸溶液中还是碱溶液中Ba2+、K+、NO、Cl-均能大量共存,C项正确;c(OH-)=Kw,则c(H+)=1 mol·L-1,酸性条件下,NO、I-发生氧化还原反应而不能大量共存,D项错误。
6.汽水是CO2的饱和溶液,其中存在如下平衡:H2CO3??H++HCO……① HCO??H++CO……② 将汽水倒入试管中分别进行下列实验,相应分析结论错误的是( )
A.加热、平衡①、②可能都向左移动
B.加入澄清石灰水,平衡①、②均向右移动
C.加入CaCO3悬浊液,CaCO3的溶解平衡向正方向移动
D.通入过量CO2或滴加氯水,溶液pH均减小
答案:D
解析:A项,加热碳酸分解生成CO2和水,促使平衡向左移动,正确;B项,加入澄清的石灰水,溶液的碱性增强,降低氢离子的浓度,平衡①、②均向右移动,正确;C项,加入碳酸钙悬浊液,碳酸与碳酸钙结合生成可溶性的碳酸氢钙,促进碳酸钙的溶解,正确;D项,温度不变,再通入CO2,溶液的浓度不变,pH不变,错误。
7.下列解释事实的化学方程式或离子方程式正确的是( )
A.钢铁发生吸氧腐蚀:2Fe+O2+2H2O===2Fe2++4OH-
B.SO2使紫色石蕊溶液变红色:SO2+H2O===2H++SO
C.利用NaOH溶液除去金属铝表面的氧化膜:Al2O3+2OH-===2AlO+H2O
D.向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O===HClO+HSO
答案:C
8.下列各反应所对应的方程式不正确的是( )
A.Cl2与H2O反应:Cl2+H2O===Cl-+H++HClO
B.向NaNO2溶液中滴加酸性KMnO4溶液:5NO+2MnO+3H2O===5NO+2Mn2++6OH-
C.向NaHSO4溶液中加入Ba(OH)2溶液至SO刚好沉淀:H++SO+Ba2++OH-===BaSO4↓+H2O
D.在水溶液中,硫酸银与单质硫作用,沉淀变为硫化银,分离,所得溶液中加碘水不褪色:3Ag2SO4+4S+4H2O===3Ag2S+4H2SO4
答案:B
解析:Cl2与水反应生成HCl和HClO,其中HCl是强酸应该拆为氢离子和氯离子,HClO是一种弱酸,在离子方程式中不能拆分,所以选项A正确;向NaNO2溶液中滴加酸性KMnO4溶液,因为加入的是酸性溶液,所以不会生成氢氧根离子,而是应该在反应物中补充H+,生成物中补充H2O,反应方程式为5NO+2MnO+6H+===5NO+2Mn2++3H2O,选项B错误;NaHSO4溶液中加入等物质的量的Ba(OH)2,使硫酸根和钡离子等物质的量,就可以使SO刚好沉淀,两者1∶1反应的方程式为NaHSO4+Ba(OH)2===BaSO4↓+H2O+NaOH,对应的离子方程式为H++SO+Ba2++OH-===BaSO4↓+H2O,选项C正确;硫酸银与单质硫作用,沉淀变为硫化银,可以得到部分反应方程式:Ag2SO4+S…―→Ag2S…,Ag2S中-2价的S由单质S得电子化合价降低得到,所以化合价的升高只能还是单质硫的升高。题目中说“所得溶液中加碘水不褪色”,说明单质硫化合价升高得到的不是亚硫酸(单质碘可以被+4价硫还原而褪色),那就只能是硫酸,所以得到部分反应方程式:Ag2SO4+S…―→Ag2S+H2SO4…再根据原子守恒和化合价升降相等,补齐并配平方程式得到:3Ag2SO4+4S+4H2O===3Ag2S+4H2SO4,选项D正确。
9.已知PbSO4不溶于水,也不溶于盐酸或硝酸,但可溶于醋酸铵溶液中,形成无色溶液,其化学方程式为PbSO4+2CH3COONH4===(CH3COO)2Pb+(NH4)2SO4。若在(CH3COO)2Pb溶液中通入H2S气体时有黑色沉淀PbS生成,该反应的离子方程式为( A )
A.(CH3COO)2Pb+H2S===PbS↓+2CH3COOH
B.Pb2++H2S===PbS↓+2H+
C.Pb2++2CH3COO-+H2S===PbS↓+2CH3COOH
D.Pb2++2CH3COO-+2H++S2-===PbS↓+2CH3COOH
解析:PbSO4+2CH3COONH4===(CH3COO)2Pb+(NH4)2SO4的反应是一个复分解反应。该反应的生成物中既无沉淀、又无气体生成,则一定有难电离的物质生成。因(NH4)2SO4在水溶液中是能够完全电离的,那么,难电离的物质应是(CH3COO)2Pb,在书写离子方程式时(CH3COO)2Pb不能拆开写。只有A正确。
10.下列实验对应的现象以及离子方程式不正确的是( )
实验
现象
离子方程式
A
向淀粉KI溶液中滴加硫酸氢钠溶液
在空气中放置一段时间后,溶液呈蓝色
4H++4I-+O2===2I2+2H2O
B
将氯水滴加到含KSCN溶液的绿矾溶液中
溶液由浅绿色变为红色
2Fe2++Cl2===2Fe3++2Cl-,
Fe3++3SCN-=== Fe(SCN)3
C
向硫化钠和亚硫酸钠的混合液中滴加稀盐酸
产生淡黄色沉淀
2S2-+SO+6H+===3S↓+
3H2O
D
向含酚酞的氢氧化钡溶液中滴加稀硫酸
有白色沉淀生成,溶液由红色变为无色
Ba2++OH-+H++SO
===BaSO4↓+H2O
答案:D
解析:Ba(OH)2与H2SO4反应的离子方程式为Ba2++2OH-+SO+2H+===BaSO4↓+2H2O。
二、非选择题:本题包括4个小题,共50分.
11.(10分)有M、N两种溶液,经测定这两种溶液中含有下列12种离子:Al3+、Cl-、Na+、K+、NO、OH-、Fe2+、AlO、CO、NH、SO、H+。
(1)完成下列表格中实验①的结论和实验②的实验内容以及现象:
实验内容以及现象
结论
①取少量N溶液滴加足量的硝酸钡溶液,无沉淀产生
②
确定M溶液中含有Na+,不含K+
③用pH试纸检测M溶液,pH试纸呈蓝色
(2) 根据(1)中的实验回答:NO存在于________溶液中,理由是_____________________
______________________________________________________________________________;
Cl-存在于________溶液中,理由是___________________________________________。
(3) 根据(1)中的实验确定,M溶液中含有的离子为_______________________________。
答案:(1)①N溶液中不含CO、SO(或M溶液中一定含有CO、SO)。
②取M溶液进行焰色反应,焰色为黄色,再透过蓝色钴玻璃观察火焰颜色,不呈紫色
(2)M N溶液中含有H+、Fe2+、Al3+、NH、K+,由于N溶液为酸性,又含有Fe2+,所以N溶液中不含NO
N 根据溶液呈电中性原则,可以确定Cl-存在于N溶液中
(3)OH-、AlO、CO、SO、Na+、NO
解析:少量N溶液中滴加足量的硝酸钡溶液,无沉淀产生,说明N溶液中不含CO、SO,那么M溶液中一定含有CO、SO。取M溶液进行焰色反应,焰色为黄色,证明含有Na+,再透过蓝色钴玻璃观察火焰颜色,不呈紫色,说明M中不含K+;用pH试纸检测M溶液,pH试纸呈蓝色,说明M溶液显碱性,含有大量的OH-,那么N溶液中含有大量的H+。AlO不可能存在于酸性溶液中,Al3+、Fe2+、NH不可能存在于碱性溶液中,所以判断M溶液中有OH-、AlO、CO、SO、Na+,N溶液中含有H+、Fe2+、Al3+、NH、K+。由于N溶液为酸性,又含有Fe2+,所以N溶液中不含NO;根据溶液呈电中性原则,可以确定Cl-存在于N溶液中。
12.(12分)某无色溶液中含有下列8种离子中的某几种:Na+、H+、Mg2+、Ag+、Cl-、OH-、HCO、NO。已知该溶液可与Al2O3反应,则:
(1)该溶液与Al2O3反应后有Al3+生成,则原溶液中一定含有______________,一定不会含有大量的________________。
(2)该溶液与Al2O3反应后有AlO生成,则原溶液中一定含有______,可能含有大量的________。
(3)写出该溶液与Al2O3反应生成AlO的离子方程式:____________________________。
答案 (1)H+ OH-、HCO
(2)OH-、Na+ Cl-、NO
(3)Al2O3+2OH-===2AlO+H2O
解析:(1)溶液与Al2O3反应后有Al3+生成,说明该溶液显酸性,一定含有H+,OH-、HCO一定不会大量存在。
(2)该溶液与Al2O3反应后有AlO生成说明该溶液显碱性,H+、Mg2+、Ag+与OH-不能大量共存,必定要含有一种阳离子:Na+,故溶液中一定含有OH-、Na+,可能含有Cl-、NO。
13.(12分)向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式________________________________________。
(2)下列三种情况下,离子方程式与(1)相同的是________(填序号)。
A.向NaHSO4溶液中,逐滴加入Ba(OH2)溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用右图中的________曲线表示(填序号)。
(4)若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如图所示,向该烧杯里缓缓注入与Ba(OH)2溶液等密度的稀硫酸至恰好完全反应。在此实验过程中,小球将_________________。
答案:(1)Ba2++2OH-+SO+2H+===BaSO4↓+2H2O (2)A
(3)C (4)沉到烧杯底部
14.(16分)某矿样含有大量的CuS、少量铁的氧化物及少量其它不溶于酸的杂质。某化学课外小组设计以下流程,取该矿样为原料生产CuC12·2H2O 晶体。
已知:常温下,金属离子开始沉淀和沉淀完全时的pH 见下表。
金属
离子
氢氧化物开始沉淀的pH
氢氧化物沉淀完全的pH
Fe2+
7.0
9.0
Fe3+
1.9
3.2
Cu2+
4.7
6.7
回答下列问题:
(l)步骤①的焙烧过程中需要通入氧气。在实验室中,可使用常见化学物质利用如图所示装置制取氧气,试写出熟悉的符合上述条件的两个化学方程式:_________________________、
_______________________________。
(2)焙烧产生的尾气中含有的一种气体是形成酸雨的污染物,若将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式:__________________、__________________。
(3)步骤②酸浸过程中,需要用到3 mol · L-1的盐酸100 mL,配制该盐酸溶液时,除了用到烧杯、玻璃棒、胶头滴管外,还需要的仪器有__________________________________。
(4)步骤④加入物质X的目的是______________________________,物质X 可以选用下列物质中的__________________________。
(A)氢氧化钠 (B)稀盐酸 (C)氨水 (D)氧化铜
(5)当溶液中金属离子浓度低于1×10-5 mol · L-1时,认为该金属离子沉淀完全,则Ksp[Fe(OH)2]=________。
答案:(1)2H2O2 2H2O + O2 ↑,2Na2O2 + 2H2O===4NaOH + O2 ↑
(2)2H2SO3+O2===2H2SO4,2(NH4)2SO3+O2===2(NH4)2SO4,2NH4HSO3+O2===2NH4HSO4
(3)100 mL容量瓶、量筒
(4)调节溶液的pH,使Fe3+以Fe( OH )3 沉淀的形式析出 D
(5)1×10-15
解析:(1)在MnO2作催化剂条件下,双氧水可以分解制O2,Na2O2能与水反应生成O2。(2)CuS在焙烧时会产生有害气体SO2,+4价的硫具有强还原性,故SO2、H2SO3、SO能被空气中的氧气所氧化。(4)由所给表格数据知,Fe3+在pH>3.2时已完全沉淀,故加入物质X的目的是调节溶液的pH,将Cu2+溶液中的Fe3+变成Fe( OH )3沉淀除去,但不能引入新的杂质,可选择CuO、Cu(OH)2、CuCO3等。(5)由表格数据知:Fe2+在pH=9时完全沉淀,此时溶液中c(OH-)=10-5 mol · L-1,c(Fe2+)=1×10-5 mol · L-1,Ksp[Fe(OH)2]=c(Fe2+)·c2(OH-)=10-15。