- 631.00 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
四川省雅安市高中2020届高三第三次诊断理综
7.下列有关说法错误的是( )
A.聚丙烯纤维是生产医用口罩的重要材料
B.在月饼包装盒中放入生石灰,可防止月饼氧化变质
C.84消毒液、医用酒精等都可以用于抗新冠病毒的消毒
D.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
8.下列说法正确的是( )
A.苯的硝化、油脂的皂化均可看作取代反应
B.蛋白质和淀粉都是高分子化合物,都能水解生成葡萄糖,提供生命活动的能量
C.用酸性KMnO4溶液无法鉴别乙醇与苯
D.分子式为C4H9Cl的同分异构体有5种
9.复旦大学研发的一种新型水锂电池,一极采用复合膜包裹的金属锂,另一极采用锰酸锂(LiMn2O4),以0.5 mol·L−1 Li2SO4水溶液作电解质,安全性能和成本较现有的锂离子电池都具有明显的优势。下列有关该电池的说法不正确的是( )
A.电极a是负极,电极b是正极
B.工作时电池的总反应为:LiMn2O4+Li==Li2Mn2O4
C.放电时,溶液中Li+从a向b迁移
D.电池放电时的阳极反应式为: Li2Mn2O4−e−==LiMn2O4+Li+
10.有原子序数依次增大的a、b、c、d四种元素,最外层电子数分别为4、1、x、7,已知c原子的电子层数等于x,d-的电子层结构与Ar元素相同。下列说法错误的是( )
A.元素a与氢形成原子比为1:1的化合物有多种
B.元素b的单质能与水、无水乙醇反应
C.c的简单离子与d-的简单离子最外层电子数和电子层数都不相同
D.元素a与元素d可形成既含有极性共价键又含非极性共价键的化合物
11.设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.1.0 L 0.5 mol·L-1 FeBr2溶液与1 mol Cl2反应时转移的电子数目为2NA
B.25℃,1L pH=9的CH3COONa溶液中,发生电离的水分子数为1×10-9NA
C.3.0g甲醛(HCHO)和冰醋酸的混合物中含有的原子总数为0.4NA
D.标准状况下,2.24 L二氯甲烷中含有的原子数目为0.5NA
12.下列实验过程可以达到实验目的的是( )
编号
实验目的
实验过程
A
测定NaHCO3溶液的浓度
用标准HCl溶液滴定NaHCO3溶液来测定其浓度,并选择酚酞为指示剂
B
鉴别KI、AgNO3、Na2CO3、NaAlO2四种溶液
向盛有KI、AgNO3、Na2CO3、NaAlO2四种溶液的试管中分别滴加盐酸,观察实验现象
C
探究浓度对反应速率的影响
向2支盛有5 mL不同浓度NaHSO3溶液的试管中同时加入2 mL 5%H2O2溶液,观察实验现象
D
除去乙醇中混有的乙酸
混合液蒸馏,收集78.3℃左右的馏分(乙醇的沸点为78.3℃)
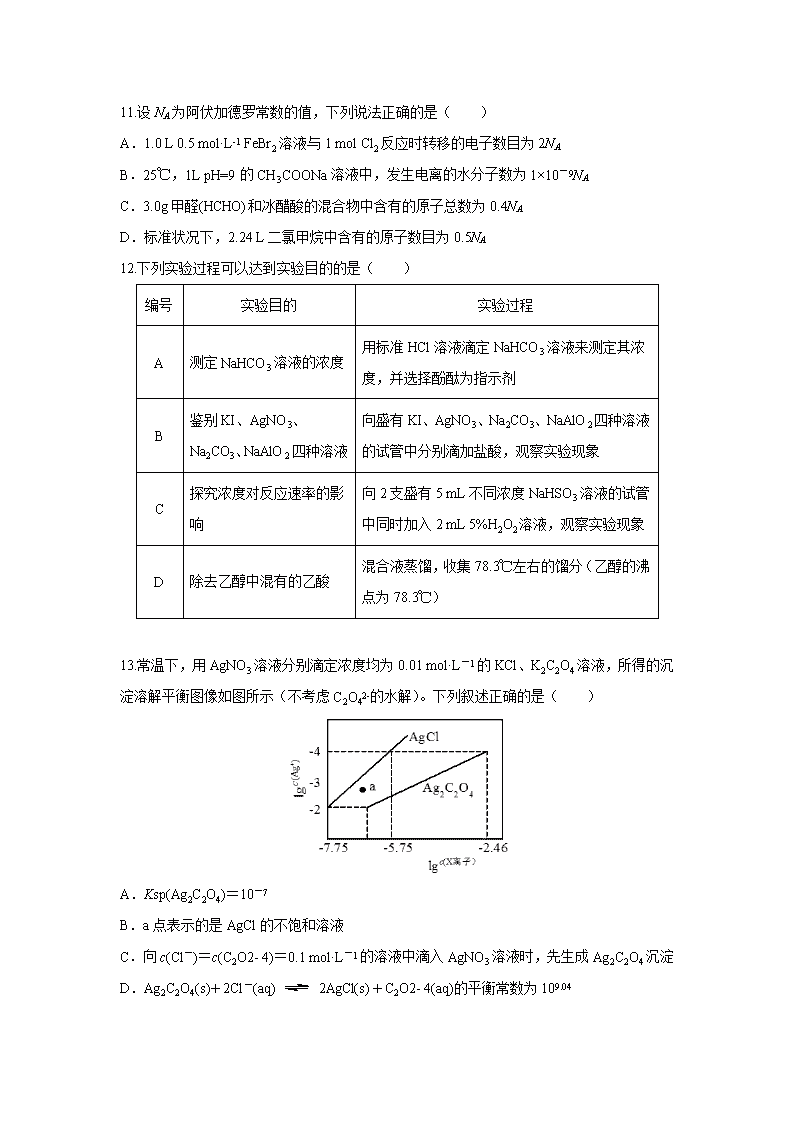
13.常温下,用AgNO3溶液分别滴定浓度均为0.01 mol·L-1的KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O42-的水解)。下列叙述正确的是( )
A.Ksp(Ag2C2O4)=10-7
B.a点表示的是AgCl的不饱和溶液
C.向c(Cl-)=c(C2O2- 4)=0.1 mol·L-1的溶液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
D.Ag2C2O4(s)+2Cl-(aq)2AgCl(s)+C2O2- 4(aq)的平衡常数为109.04
26.(14分)
氯苯是染料、医药、有机合成的中间体,是重要的有机化工产品。其合成反应原理是:
C6H6+Cl2 C6H5Cl+HCl
某实验室制取氯苯的装置如图所示(加热和夹持装置已略去)。
请回答下列问题:
(1)仪器a、b组合成制取氯气的装置,反应不需要加热,则仪器a中的固体反应物是________(填化学式)。
(2)把氯气干燥后通入装有40mL苯(密度0.88g/mL)的反应器d中(内有铁屑作催化剂),维持反应温度在50~60℃,回流40分钟。对仪器d加热的方法是______________。
(3)仪器c的名称是_________,仪器c出口的气体成分有HCl、Cl2和_________。
(4)将d中的液体倒入分液漏斗中,分别用蒸馏水和NaOH溶液洗涤,分离出的产物干燥后,进行蒸馏纯化,得到24g纯净的氯苯。
①碱洗之前要进行水洗,其目的是___________________________。
②用10% NaOH溶液碱洗时发生氧化还原反应的化学方程式为_______________________。
③该实验所得氯苯的产率为________(保留小数点后一位),该产率低于理论产率的原因 (填写两条)。
27.(14分)
碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物
Fe(OH)3
Fe(OH)2
Al(OH)3
开始沉淀
2.0
5.9
3.7
完全沉淀
3.5
8.4
4.7
请回答下列问题:
(1)该工艺中“搅拌”的作用是___________________________,写出反应I中发生氧化还原反应的离子方程式___________________________。
(2)“滤渣”的主要成分是___________(填化学式),加入适量NaHCO3的目的是调节pH在___________范围内。
(3)反应Ⅱ中加入NaNO2的离子方程式为_______________________________________,在实际生产中,可以同时通入O2以减少NaNO2的用量,若参与反应的O2有5.6L(标况),则理论上相当于节约NaNO2(Mr=69)用量_________g。
(4)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解为Fe2(OH)2+ 4 聚合离子,该水解反应的离子方程式为________________________________。
(5)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:取25.00mL溶液,稀释到250mL,准确量取20.00mL于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应后,再用0.01000 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。已知:2Fe3++2I-=2Fe2++I2 2S2O2- 3+I2=2I-+S4O2- 6
则溶液中铁元素的总含量为_________g·L-1。
28.(15分)
脱除工业废气中的氮氧化物(主要是指NO和NO2)可以净化空气、改善环境,是环境保护的主要课题。
(1)早期是利用NH3还原法,可将NOx还原为N2进行脱除。
已知:①4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH=-905.9 kJ·mol-1
②N2(g)+O2(g)2NO(g) ΔH=+180 kJ·mol-1
③H2O(g)H2O(l) ΔH=-44 kJ·mol-1
写出常温下,NH3还原NO反应的热化学方程式____________________________________。
(2)以漂粉精溶液为吸收剂可以有效脱除烟气中的NO。
①漂粉精溶液的主要成分是Ca(ClO)2,若吸收过程中,消耗的Ca(ClO)2
与吸收的NO的物质的量之比为3∶4,则脱除后NO转化为_____________。
②某一兴趣小组研究不同温度下相同浓度漂粉精溶液对NO脱除率的影响,结果如下左图所示。图中,40~60℃NO脱除率上升可能的原因为___________________________;60~80℃NO脱除率下降可能的原因为____________________________________。
(3)过硫酸钠(Na2S2O8)氧化去除NO
第一步:NO在碱性环境中被Na2S2O8氧化为NaNO2
第二步:NaNO2继续被氧化为NaNO3,反应为NO2-+S2O82-+2OH-NO3-+2SO42- +H2O。
不同温度下,平衡时NO2-的脱除率与过硫酸钠(Na2S2O8)初始浓度(指第二步反应的初始浓度)的关系如上右图所示。
①a、b、c、d四点平衡常数K由大到小的顺序为_______________________,原因是_________________________________________。
② 若a点(0.1,40%)时,NO-2的初始浓度为a mol·L-1,平衡时pH=13,则65℃时,第二步反应的平衡常数K=_________。(用含a的代数式表示,已知65℃时Kw=1.0×10-13)
(4)利用新型材料光催化脱除NO法如右图所示。
某电化学小组将过程A、B设计成酸性电解池反应,则该反应中阴极反应方程式为 。
35.[化学—选修3:物质结构与性质] (15分)
碳族元素的单质及其化合物在生产、生活中是一类重要物质。请回答下列问题
(1)碳原子核外有____种不同运动状态的电子,第一电离能介于硼和碳之间的元素的名称为______,碳族元素外围电子排布的通式为__________________。
(2)青蒿素(C15H22O5)的结构如右图所示,图中数字标识的五个碳原子
的杂化轨道类型为______________,组成青蒿素的三种元素电负性由大到小排序是 ____________________。
(3)青蒿素分子中,氧元素的成键方式有 ;从青蒿中提取青蒿素的最佳溶剂是 。
a.乙醇 b.乙醚 c.水
(4)SnO2是一种重要的半导体传感器材料,用来制备灵敏度高的气敏传感器,SnO2与熔融NaOH反应生成Na2SnO3,Na2SnO3中阴离子空间构型为________。
(5)第三代太阳能电池利用有机金属卤化物碘化铅甲胺(CH3NH3PbI3,相对分子质量为Mr)半导体作为吸光材料,CH3NH3PbI3具有钙钛矿(AMX3)的立方结构,其晶胞如右图所示。AMX3晶胞中与金属阳离子(M)距离最近的卤素阴离子(X)形成正八面体结构,则X处于_______位置。CH3NH3PbI3晶体的晶胞参数为a nm,其晶体密度为d g·cm-3,则阿伏加德罗常数的值NA的计算表达式为_________。
36.[化学—选修5:有机化学基础](15分)
奥司他韦是一种高效、高选择性神经氨酸酶抑制剂,是目前治疗流感的最常用药物之一,是公认的抗禽流感、甲型H1N1等病毒最有效的药物之一。其合成路线如下图所示:
回答下列问题:
(1)莽草酸的含氧官能团名称有__________;反应③的反应类型____________。
(2)反应①的反应试剂和反应条件_________。
(3)1molB最多可以消耗 molNaOH溶液。
(4)请写出反应②的化学方程式___________________________________。
(5)芳香化合物X是B的同分异构体,则符合官能团只含酚羟基的X有 种。
(6)设计由对甲基苯甲醛制备对醛基苯甲酸的合成路线______________________________________________________________。
【参考答案】