- 361.50 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
黑龙江省实验中学2020届高三下学期开学考试
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Cl 35.5 Fe 56 Co 59 Ga 70 As 75
7.化学与生产、生活密切相关,下列有关说法正确的是( )
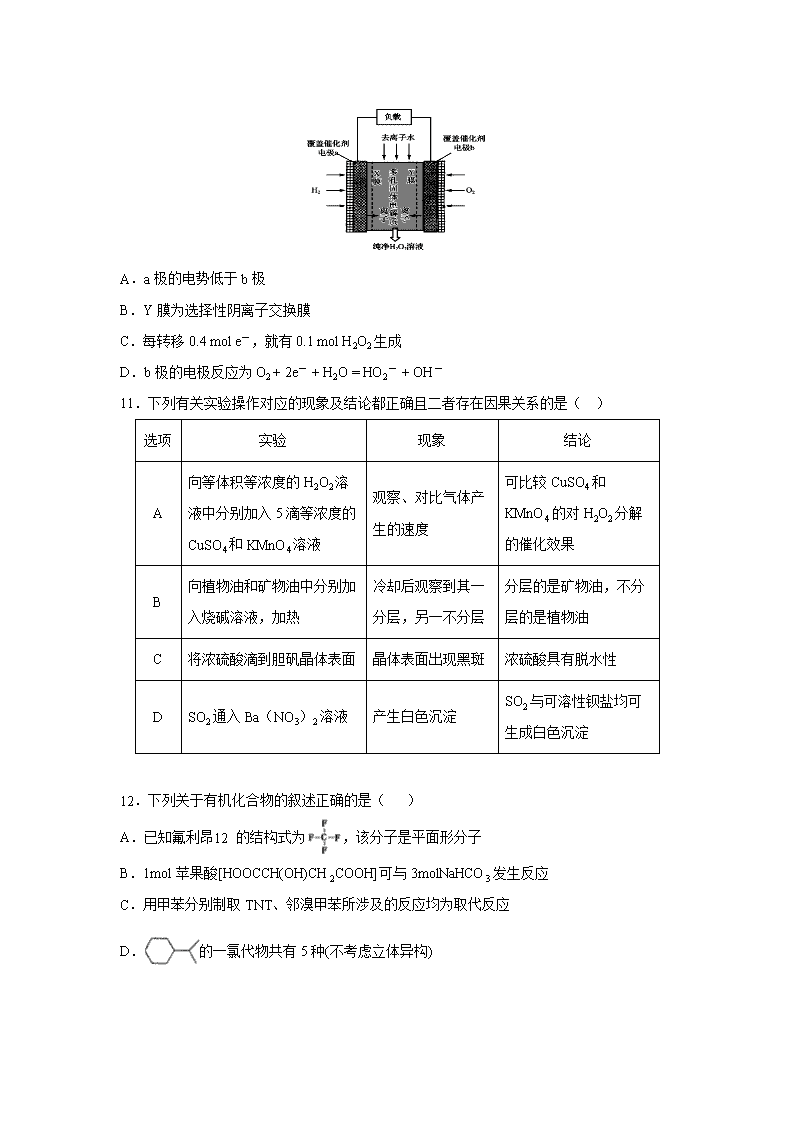
A.工业上用电解MgO、Al2O3的方法来冶炼对应的金属
B.煤的气化、液化与石油的裂化、裂解均为化学变化
C.“血液透析”和“静电除尘”利用了胶体的同一种性质
D.刚玉主要成分是氧化铝,玛瑙、分子筛主要成分是硅酸盐
8.NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,11.2 L Cl2溶于水,溶液中Cl-,ClO-和HClO的微粒数之和为NA
B.32.5 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.2NA
C.1 mol PC13与1 mol 36C12反应达到平衡时,产物中含P—36C1键数目为2NA
D.反应 + → + 中,每生成294g 释放的中子数为3NA
答案:D
9.A、B、C、D为原子序数依次增大的短周期主族元素,a、d分别是A、D元素对应的单质,m、n、p、q是由这些元素中的部分元素组成的化合物,气体p常作果实催熟剂,m、n为两种常见的液体。上述物质发生的转化关系如下图所示(反应条件已略去)。下列说法错误的是( )
A.原子半径由大到小的顺序为:D>B>C>A
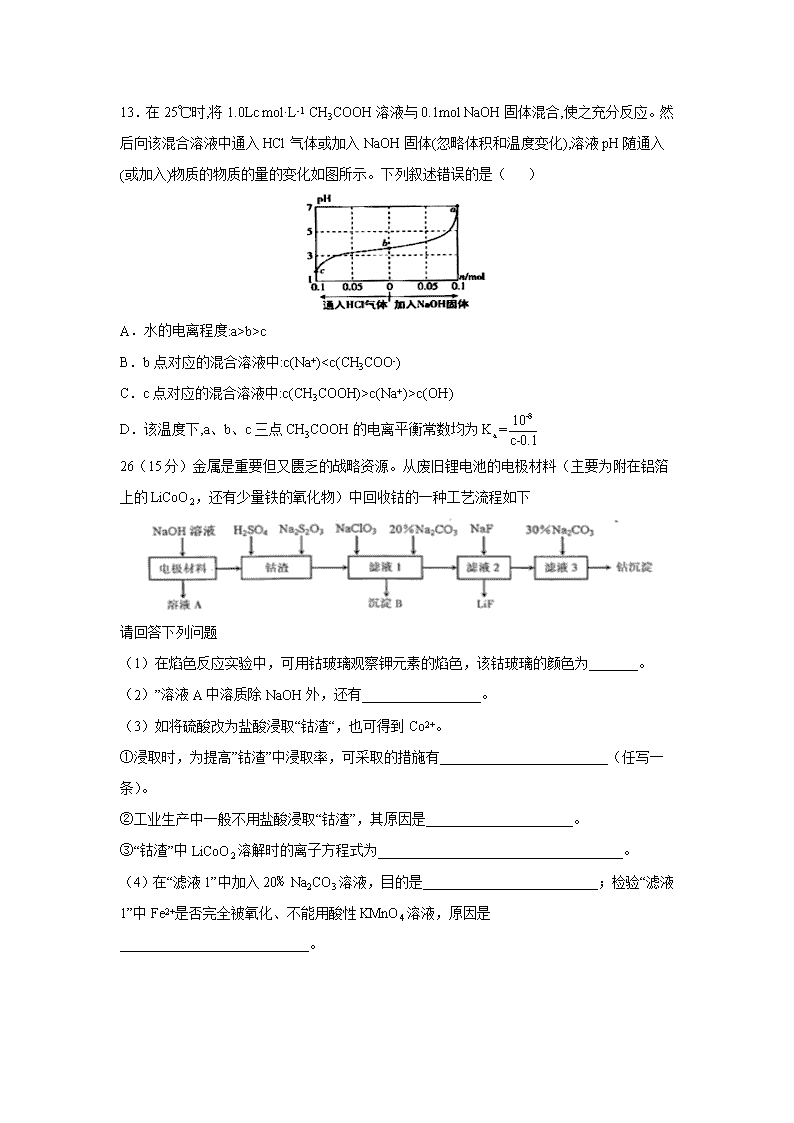
B.简单氢化物的沸点:Bb>c
B.b点对应的混合溶液中:c(Na+)c(Na+)>c(OH-)
D.该温度下,a、b、c三点CH3COOH的电离平衡常数均为
26(15分)金属是重要但又匮乏的战略资源。从废旧锂电池的电极材料(主要为附在铝箔上的LiCoO2,还有少量铁的氧化物)中回收钴的一种工艺流程如下
请回答下列问题
(1)在焰色反应实验中,可用钴玻璃观察钾元素的焰色,该钴玻璃的颜色为_______。
(2)”溶液A中溶质除NaOH外,还有_________________。
(3)如将硫酸改为盐酸浸取“钴渣“,也可得到Co2+。
①浸取时,为提高”钴渣”中浸取率,可采取的措施有________________________(任写一条)。
②工业生产中一般不用盐酸浸取“钴渣”,其原因是_____________________。
③“钴渣”中LiCoO2溶解时的离子方程式为___________________________________。
(4)在“滤液1”中加入20﹪Na2CO3溶液,目的是_________________________;检验“滤液1”中Fe2+是否完全被氧化、不能用酸性KMnO4溶液,原因是___________________________。
(5)”钴沉淀”的化学式可表示为CoCO3·yCo(OH)2。称取5.17g该样品置于硬质玻璃管中,在氮气中加热.使样品完全分解为CoO,生成的气体依次导入足量的浓硫酸和碱石灰中,二者分别增重0.54g和0.88g。则“钴沉淀”的化学式为__________。
27(14分)工业上制备丙烯的方法有多种,具体如下(本题丙烯用C3H6表示):
(1)丙烷(C3H8)脱氢制备丙烯(C3H6)
由下图可得,C3H8(g)C3H6(g)+H2(g),△H=_________kJ/.mol
(2)以丁烯(C4H8)和乙烯(C2H4)为原料反应生成丙烯(C3H6)的方法被称为“烯歧化法”,反应为:C4H8(g)+C2H4(g)2C3H6(g) △H>0
一定温度下,在一体积恒为VL的密闭容器中充入一定量的C4H8和C2H4,发生烯烃歧化反应。
I.该反应达到平衡的标志是______________
A.反应速率满足:2v生成(C4H8)=v生成(C3H6)
B.C4H8、C2H4、C3H6的物质的量之比为1:1:2
C.混合气体的平均相对分子质量不再改变
D.C4H8、C2H4、C3H6的浓度均不再变化
Ⅱ.已知t1min时达到平衡状态,测得此时容器中n(C4H8)=mmol,n(C2H4)=2mmol,n(C3H6)=nmol,且平衡时C3H6的体积分数为。
①该时间段内的反应速率v(C4H8)= _______mol/(L·min)。(用只含m、V、t1的式子表示)。
②此反应的平衡常数K=______________。
③t1min时再往容器内通入等物质的量的C4H8和C2H4,在新平衡中C3H6的体积分数_______(填“>”“<”“=”)。
(3)“丁烯裂解法”是另一种生产丙烯的方法,但生产过程中伴有生成乙烯的副反应发生,具体反应如下:主反应:3C4H84C3H6;副反应:C4H82C2H4
①从产物的纯度考虑,丙烯和乙烯的质量比越高越好。则从下表现的趋势来看,下列反应条件最适宜的是__________(填字母序号)。
A.300℃0.1MPa B.700℃0.1MPa C.300℃0.5MPa D.700℃0.5MPa
②下图中,平衡体系中丙烯的百分含量随压强增大呈上升趋势,从平衡角度解释其可能的原因是_________________________________________________________________。
28(14分)连二亚硫酸钠(Na2S2O4)俗称保险粉,可用作食品保鲜剂(不直接加入食品中,安全、卫生),还可用于纸浆、肥皂等的漂白剂。Na2S2O4易溶于水,难溶于乙醇。在碱性介质中较稳定,在空气中易被氧化。回答下列问题:
(1)Na2S2O4用于保鲜剂时能去除O2,先生成Na2SO3并缓慢释放SO2,该反应的化学方程式为____________________________________________。
(2)锌粉法制备Na2S2O4的工艺流程如图所示:
①实验室可用浓硫酸和亚硫酸钠反应制取SO2,并希望能控制反应速度,图中可选用的发生装置是________(填字母)。
②工业上常将锌块进行预处理得到锌粉—水悬浊液,其目的是____________。步骤Ⅱ中发生反应的化学方程式为________________________。
③在步骤.中得到的Na2S2O4固体要用乙醇洗涤,其优点是____________________。
(3)目前,我国普遍采用甲酸钠法生产连二亚硫酸钠,其原理是先将HCOONa和烧碱加人乙 醇水溶液液中,然后通入SO2发生反应,有CO2气体放出,总反应的化学方程式是_______________________________________________。
(4)连二亚硫酸钠的分析检测。铁氰化钾法:铁氰化钾K3[Fe(CN)6]是一种比较弱的氧化剂,其具有强氧化剂所没有的选择性氧化性,能将S2O42−氧化为SO32−,[Fe(CN)6]3−还原为[Fe(CN)6]4−。取50.00mLNa2S2O4样品溶液,用0.02mol•L−1的K3[Fe(CN)6]标准液滴定至终点,消耗10.00mL。该样品中Na2S2O4的含量为_______g•L−1。(以SO2计)
35(15分)以氮化镓(GaN)、砷化镓(GaAs)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点,如砷化镓灯泡寿命是普通灯泡的100倍,而耗能即为10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措。请回答下列问题:
(1)基态镓原子的价电子排布式为__________________。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为_______和+3。砷的电负性比镓__________(填“大”或“小”)。
(3)比较下列镓的卤化物的熔点和沸点, GaCl3、GaBr3、GaI3的熔、沸点依次升高, 分析其变化原因:__________________________________________________________________。
镓的卤化物
GaCl3
GaBr3
GaI3
熔点/℃
77.75
122.3
211.5
沸点/℃
201.2
279
346
GaF3的熔点超过1000℃,可能的原因是_______________________________________。
(4)① 砷化镓是将(CH3)3Ga和AsH3用MOCVD(金属有机物化学气相淀积)方法制备得到的,该反应在700℃进行,反应的方程式为:______________________________。
②反应物AsH3分子的几何构型为_________,(CH3)3Ga中镓原子杂化方式为___。
(5)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565pm,As的配位数为__________,晶体的密度为________________(设NA 为阿伏加德罗常数的数值,列出算式即可)g·cm-3。
36(15分)化合物J是一种常用的抗组胺药物,一种合成路线如下:
已知:①C为最简单的芳香烃,且A、C互为同系物。
②2ROH+NH3HNR2+2H2O(R代表烃基)。
请回答下列问题:
(1)A的化学名称是_________,H中的官能团名称是_____________。
(2)由E生成F的反应类型是____________,G的结构简式为____________。
(3)A→B的化学方程式为_____________________________________________________。
(4)L是F的同分异构体,含有联苯()结构,遇FeCl3溶液显紫色,则L有___种(不考虑立体异构)。其中核磁共振氢谱为六组峰,峰面积之比为3∶2∶2∶2∶2∶1的结构简式为___________。
(5)写出用氯乙烷和2-氯-1-丙醇为原料制备化合物的合成路线(其他无机试剂任选)。______________________________________________________________________
【参考答案】
7-13:BDCCBCD
26.【答案】(1)蓝色 (2)NaAlO2 (3) 粉碎;搅拌;升高温度 LiCoO2可氧化盐酸,产生的Cl2会污染环境 8LiCoO2+S2O32-+22H+==8Li++8Co2++2SO42-+11H2O (4) 调节溶液pH,使Fe3+转换为Fe(OH)3沉淀Co2+、S2O32-也能使KMnO4溶液褪色 (5) 2CoCO3·3Co(OH)2
27.【答案】+124.2 ad 0.5 > c 压强增大,生成乙烯的副反应平衡逆向移动,丁烯浓度增大,导致主反应的平衡正向移动,丙烯含量增大
28.【答案】(1)2Na2S2O4+O2=2Na2SO3+2SO2
(2)①ad ②增大锌粉的表面积,加快反应速率 ZnS2O4+Na2CO3=Na2S2O4+ZnCO3↓ ③除去晶体表面的水分,并减少Na2S2O4的溶解损失
(3)HCOONa+NaOH+2SO2=Na2S2O4+CO2+H2O
(4)0.256
35.【答案】4s24p1 (2’) +1 (1’) 大 (1’) GaCl3、GaBr3、GaI3均为分子晶体,结构相似,相对分子质量依次增大,分子间作用力依次增强(2’) GaF3为离子晶体(2’) 共8分
(CH3)3Ga+AsH3 GaAs+3CH4 (2’) 三角锥形 (1’) sp2 (1’) 4 (1’) (2’) 共7分
36.【答案】甲苯 (2’) 醚键、氯原子 (2’) 还原反应 (1’) CH2OHCH2Cl (2’) +Cl2+HCl (2’) 19 (2’) (2’) (2’)