- 241.50 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
化学平衡状态及其移动
时间:45分钟
1.在一定条件下,可逆反应N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,达到化学平衡状态时,下列说法正确的是( D )
A.降低温度,可提高反应速率
B.加入合适的催化剂,可提高N2的转化率
C.N2的正反应速率等于NH3的逆反应速率
D.反应物和生成物的浓度都不再发生变化
解析:降低温度,反应速率减慢,A项错误;加入合适的催化剂,反应速率加快,但平衡不移动,N2的转化率不变,B项错误;反应达到平衡时,N2的正反应速率等于NH3的逆反应速率的1/2,C项错误;反应达到平衡时,反应物和生成物的浓度不变,D项正确。
2.用铜、铬的氧化物作催化剂时,HCl制Cl2的原理为4HCl(g)+O2(g) 2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1,下列说法正确的是( A )
A.平衡时,将生成的水蒸气除去,有利于提高HCl的转化率
B.在恒容绝热容器中进行时,随着反应的进行,气体的压强一定不断减小
C.恒压容器中,反应达到平衡后通入惰性气体,平衡不移动
D.平衡时,其他条件不变,增大催化剂用量,反应的平衡常数将变大
解析:平衡时除去水蒸气,平衡向正反应方向移动,有利于提高HCl的转化率,A项正确;该反应为放热反应,随着反应的进行,温度将不断升高,虽然该反应是气体体积减小的反应,但很难确定压强是否减小,B项错误;恒压容器中,反应达到平衡后通入惰性气体,相当于减小反应体系气体的压强,平衡向逆方向移动,C项错误;催化剂对平衡常数没有影响,D项错误。
3.一定条件下,在体积恒定的密闭容器中发生反应:N2(g)+3H2(g) 2NH3(g) ΔH=-Q kJ·mol-1(Q
>0),下列说法正确的是( C )
A.升高温度,逆反应速率减小
B.当混合气体的密度不再发生变化时,说明反应达到平衡状态
C.达到平衡时反应放出的热量可达Q kJ
D.达到平衡时,v(N2)=3v(H2)
解析:升高温度,反应混合物中活化分子数目及活化分子百分数均增大,故正、逆反应速率均增大,A错误。体积恒定的密闭容器中,反应物及生成物均为气体,混合气体的密度始终不变,不能据此判断是否达到平衡状态,B错误。题目中未指明N2和H2的物质的量,若起始N2和H2的物质的量分别大于1 mol和3 mol,则达到平衡时放出的热量可达到Q kJ,C正确。达到平衡时,N2、H2的反应速率之比等于其化学计量数之比,则有3v(N2)=v(H2),D错误。
4.国际空间站处理CO2的一种重要方法是将CO2还原,所涉及的反应方程式为CO2(g)+4H2(g) CH4(g)+2H2O(g)。若温度从300 ℃升至400 ℃,反应重新达到平衡,H2的体积分数增加。下列关于该过程的判断正确的是( A )
A.该反应的ΔH<0
B.化学平衡常数K增大
C.CO2的转化率增加
D.正反应速率增大,逆反应速率减小
解析:温度从300 ℃升至400 ℃,反应重新达到平衡,H2的体积分数增加,说明升高温度,平衡逆向移动,则该反应的ΔH<0,A正确。升高温度,平衡逆向移动,则化学平衡常数K减小,CO2的转化率减小,B、C错误。升高温度,活化分子的百分数增大,则正、逆反应速率均增大,D错误。
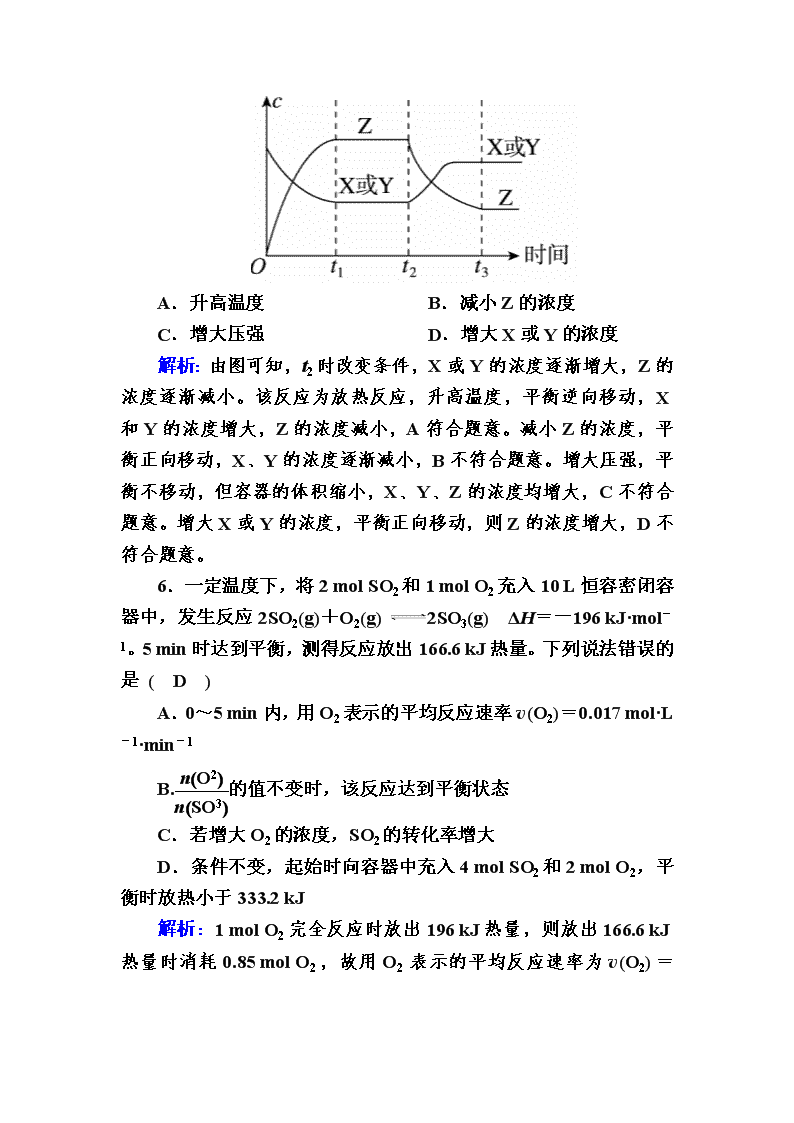
5.已知X(g)+Y(g) 2Z(g) ΔH<0。反应发生后,t1时达到平衡,t2时改变条件,t3时达到新平衡,则t2时改变的条件可能是( A )
A.升高温度 B.减小Z的浓度
C.增大压强 D.增大X或Y的浓度
解析:由图可知,t2时改变条件,X或Y的浓度逐渐增大,Z的浓度逐渐减小。该反应为放热反应,升高温度,平衡逆向移动,X和Y的浓度增大,Z的浓度减小,A符合题意。减小Z的浓度,平衡正向移动,X、Y的浓度逐渐减小,B不符合题意。增大压强,平衡不移动,但容器的体积缩小,X、Y、Z的浓度均增大,C不符合题意。增大X或Y的浓度,平衡正向移动,则Z的浓度增大,D不符合题意。
6.一定温度下,将2 mol SO2和1 mol O2充入10 L恒容密闭容器中,发生反应2SO2(g)+O2(g) 2SO3(g) ΔH=-196 kJ·mol-1。5 min时达到平衡,测得反应放出166.6 kJ热量。下列说法错误的是 ( D )
A.0~5 min内,用O2表示的平均反应速率v(O2)=0.017 mol·L-1·min-1
B.的值不变时,该反应达到平衡状态
C.若增大O2的浓度,SO2的转化率增大
D.条件不变,起始时向容器中充入4 mol SO2和2 mol O2,平衡时放热小于333.2 kJ
解析:1 mol O2完全反应时放出196 kJ热量,则放出166.6 kJ热量时消耗0.85 mol O2,故用O2表示的平均反应速率为v(O2)==0.017 mol·L-1·min-1,A正确。
的值不变时,各物质的浓度保持不变,该反应达到平衡状态,B正确。增大O2的浓度,平衡正向移动,则SO2的转化率增大,C正确。条件不变,起始时向容器中充入4 mol SO2和2 mol O2,达到新的平衡时SO2的转化率比原平衡中大,则平衡时放出热量大于333.2 kJ,D错误。
7.活性炭可处理大气污染物NO。为模拟该过程,T ℃时,在3 L密闭容器中加入NO和活性炭粉,反应体系中各物质的物质的量变化如下表所示。下列说法正确的是( D )
活性炭/mol
NO/mol
X/mol
Y/mol
起始时
2.030
0.100
0
0
10 min达平衡时
2.000
0.040
0.030
0.030
A.X一定是N2,Y一定是CO2
B.10 min后增大压强,NO的吸收率增大
C.10 min后加入活性炭,平衡向正反应方向移动
D.0~10 min的平均反应速率v(NO)=0.002 mol·L-1·min-1
解析:由表中数据可知,10 min内n(活性炭)、n(NO)的变化量之比为0.030 mol∶0.060 mol=1∶2,据此推知该反应为C(s)+2NO(g)N2(g)+CO2(g),则X、Y分别是N2、CO2中的一种,A错误。增大压强,平衡不移动,则NO的吸收率不变,B错误。活性炭是固体,10 min后加入活性炭,平衡不移动,C错误。0~10 min内n(NO)由0.100 mol变为0.040 mol,则有v(NO)==0.002 mol·L-1·min-1,D正确。
8.科学家研究以太阳能为热源分解Fe3O4,最终循环分解水制H2,其中一步重要反应为2Fe3O4(s)6FeO(s)+O2(g) ΔH=a kJ·mol-1。在一定压强下,Fe3O4的平衡转化率随温度变化的曲线如图所示。下列有关说法中不正确的是( B )
A.a>0
B.压强p1>p2
C.升高温度,该反应的平衡常数增大
D.将体系中O2分离出去,能提高Fe3O4的转化率
解析:根据图象分析,压强一定,温度升高,Fe3O4的平衡转化率升高,则正反应为吸热反应,ΔH>0,即a>0,A项正确;温度一定时,压强增大,平衡逆向移动,Fe3O4的平衡转化率降低,故p1p2,则在较低温度下有利于该反应自发进行
B.图乙中,若T2>T1,则ΔH<0且a+b=c+d
C.图丙中,t1时刻改变的条件一定是使用了催化剂
D.图丁中,若ΔH<0,则纵坐标不可能表示的是反应物的转化率
解析:图甲中压强一定时,温度越高,平衡体系中A%越大,说明升高温度,平衡逆向移动,则有ΔH<0;若p1>p2,温度一定时,压强越大,平衡体系中A%越小,则有a+b>c+d,ΔS<0;若使ΔH-TΔS<0,则在较低温度下有利于该反应自发进行,A正确。图乙中温度一定时,增大压强,A的平衡转化率不变,则有a+b=c+d;压强一定时,若T2>T1,温度越高,A的平衡转化率越小,说明升高温度,平衡逆向移动,则有ΔH<0,B正确。图丙中t1时刻,改变条件后v正、v逆同等程度地改变,平衡不移动,则改变的条件可能是使用了催化剂,若a+b=c+d改变的条件也可能是增大了压强,C错误。图丁中温度为T1时先达到平衡状态,则温度:T1>T2;若ΔH<0,升高温度,平衡逆向移动,反应物的转化率降低,故纵坐标不可能表示的是反应物的转化率,D正确。
11.开发新能源是解决环境污染的重要举措,工业上常用CH4与CO2反应制备H2和CO,再用H2和CO合成甲醇。
(1)已知:①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH1=-1 274.0 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0 kJ·mol-1
③H2O(g)===H2O(l) ΔH3=-44 kJ·mol-1
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________________________________________________。
(2)在恒容密闭容器中通入CH4与CO2,使其物质的量浓度均为1.0 mol·L-1,在一定条件下发生反应:CO2(g)+CH4(g)2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如下图所示:
则:①该反应的ΔH________0(填“<”“=”或“>”)。
②压强p1、p2、p3、p4由大到小的关系为__________________,压强为p4时,在b点:v(正)________v(逆)(填“<”“=”或“>”)。
③对于气相反应,用某组分(B)的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数(记作Kp),则该反应的平衡常数的表达式Kp=________;如果p4=0.36 MPa,求1 100 ℃时的平衡常数Kp=________。(保留3位有效数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
④为探究速率与浓度的关系,该实验中,根据相关实验数据,粗略绘制出了2条速率—浓度关系曲线:v正~c(CH4)和v逆~c(CO)。
则:a.与曲线v正~c(CH4)相对应的是上图中曲线__________(填“甲”或“乙”)。
b.当降低到某一温度时,反应重新达到平衡,相应的平衡点分别为________(填字母)。
解析:(1)根据盖斯定律,由(①-②+③×4)×可得:CH3OH(l)+O2(g)===CO(g)+2H2O(l) ΔH=(ΔH1-ΔH2+ΔH3×4)×=(-1 274.0 kJ·mol-1+566.0 kJ·mol-1-44kJ·mol-1×4)×=-442 kJ·mol-1。
(2)①根据图示,压强不变时,升高温度,CH4的平衡转化率增大,说明正反应为吸热反应,ΔH>0。
②正反应为气体分子数增大的反应,温度不变时,降低压强,平衡向正反应方向移动,CH4的平衡转化率增大,故p4>p3>p2>p1。压强为p4时,b点时反应尚未达到平衡,反应正向进行,故v(正)>v(逆)。
③由用平衡浓度表示的平衡常数类推可知,用平衡分压表示的平衡常数Kp=。1 100 ℃、p4条件下,CH4的平衡转化率为80%,则平衡时c(CH4)=c(CO2)=0.2 mol·L-1,c(CO)=c(H2)=1.6 mol·L-1,则p(CH4)=p(CO2)=p4×=p4,p(CO)=p(H2)==p4,故Kp===1.64(MPa)2。
④a.CH4的浓度由1.0 mol·L-1逐渐减小,而CO的浓度由0逐渐增加,故与v(正)~c(CH4)相对应的曲线为乙。
b.降低温度,正、逆反应速率均减小,平衡向逆反应方向移动,则CH4的浓度增大,而CO的浓度减小,故相应的平衡点分别为B、F。
答案:(1)CH3OH(l)+O2(g)===CO(g)+2H2O(l) ΔH=-442
kJ·mol-1
(2)①> ②p4>p3>p2>p1 >
③ 1.64(MPa)2 ④乙 B、F
12.工业废气、汽车尾气排放出的NOx、SO2等,是形成酸雨的主要物质,其综合治理是当前重要的研究课题。
Ⅰ.NOx的消除。
汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生如下反应:2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH。
已知:CO燃烧热的ΔH1=-283.0 kJ·mol-1,N2(g)+O2(g)2NO(g) ΔH2=+180.5 kJ·mol-1,则ΔH=________。
(2)某研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如下图所示。
①以下说法中正确的是________(填字母)。
A.两种催化剂均能降低活化能,但ΔH不变
B.相同条件下,改变压强对脱氮率没有影响
C.曲线Ⅱ中的催化剂适用于450 ℃左右脱氮
D.曲线Ⅱ中催化剂脱氮率比曲线Ⅰ中的高
②若低于200 ℃,图中曲线Ⅰ脱氮率随温度升高而变化不大的主要原因为____________________________________________。
Ⅱ.SO2的综合利用
(3)某研究小组对反应NO2(g)+SO2(g) SO3(g)+NO(g) ΔH<0进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n0(NO2) ∶n0(SO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[α(NO2)]。部分实验结果如图所示。
①如果将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是________。
②图中C、D两点对应的实验温度分别为TC和TD,通过计算判断:TC________TD(填“>”“=”或“<”)。
解析:(1)CO燃烧热的ΔH1=-283.0 kJ·mol-1,则①CO(g)+O2(g)===CO2(g) ΔH1=-283.0 kJ·mol-1,
②N2(g)+O2(g) 2NO(g) ΔH2=+180.5 kJ·mol-1。根据盖斯定律,①式×2-②式得,2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH=(-283.0 kJ·mol-1)×2-(+180.5 kJ·mol-1)=-746.5 kJ·mol-1。(2)①两种催化剂均能降低活化能,加快反应速率,但ΔH不变,A项正确;该反应的正反应为气体分子数减小的反应,增大压强平衡向正反应方向移动,脱氮率增大,B项错误;根据图象,曲线Ⅱ中催化剂在450 ℃左右脱氮率最高,曲线Ⅱ中的催化剂适用于450 ℃
左右脱氮,C项正确;催化剂只影响化学反应速率,不影响转化率,不影响脱氮率,D项错误。②低于200 ℃,曲线Ⅰ脱氮率随温度升高而变化不大的主要原因为温度较低时(低于200 ℃),催化剂的活性偏低,对化学反应速率的影响小。(3)①C点和B点原料气配比相同,B点NO2的平衡转化率大于C点,说明将C点的平衡状态改变为B点的平衡状态,平衡向正反应方向移动,该反应的正反应为气体分子数不变的放热反应,故应采取的措施是降低温度。②C点,原料气配比为1,NO2的平衡转化率为50%,
则 NO2(g)+SO2(g) SO3(g)+NO(g)
c(起始)(mol·L-1) 1 1 0 0
c(转化)(mol·L-1) 1×50% 0.5 0.5 0.5
c(平衡)(mol·L-1) 0.5 0.5 0.5 0.5
C点,化学平衡常数KC===1。D点,原料气配比为1.5,NO2的平衡转化率为40%,则
NO2(g)+ SO2(g) SO3(g)+NO(g)
c(起始)(mol·L-1) 1.5 1 0 0
c(转化)(mol·L-1) 1.5×40% 0.6 0.6 0.6
c(平衡)(mol·L-1) 0.9 0.4 0.6 0.6
D点,化学平衡常数KD===1。
C点和D点的化学平衡常数相等,则TC=TD。
答案:(1)-746.5 kJ·mol-1
(2)①AC ②温度较低时,催化剂的活性偏低
(3)①降低温度 ②=