- 1.04 MB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2020-2021 年高考化学一轮复习第七单元 水溶液中的离子平衡测试题
1.下列有关电解质溶液的说法正确的是( )
A.向 0.1 mol•L-1CH3COOH 溶液中加入少量水,溶液中 c(H+)/c(CH3COOH)减小
B.将 CH3COONa 溶液从 20℃升温至 60℃,溶液中 c(CH3COO-)/[c(CH3COOH)·c (OH-)]增大
C.向盐酸中加入氨水至中性,溶液中 c(NH4+)/c(Cl-)>1
D.pH=4.5 的番茄汁中 c(H+)是 pH=6.5 的牛奶中 c(H+)的 100 倍
2.下列说法正确的是
A.除去 FeSO4 溶液中的 Fe3+, 可向溶液中加入铜粉, 通过反应 Cu + 2Fe3+ = Cu2+ + 2Fe2+除去 Fe3+
B.常温下,pH 为 5 的 NH4Cl 溶液和 pH 为 5 的稀盐酸中,水的电离程度相同
C.由于存在水的电离,0.1 mol•L-1 的 H2C2O4 溶液中, c(H+)/c(C2O 2-
4 )略大于 2
D.向氨水中滴加等浓度的盐酸溶液,滴加过程中,c(NH 4
)先增大后减小
3.已知某二元酸 H2A 在溶液中存在如下电离:H2A=H++HAˉ,HAˉ H++A2ˉ,K=1.2×10-2。设 NA 为阿伏
加德罗常数值。关于常温下 0.01mol·L-1 的 H2A 溶液,下列说法正确的是
A.
2-
-
(A) >1.2
(HA)
c
c
B.pH<2
C.c(H+)=2c(H2A)+c(HAˉ)+c(OHˉ) D.1L 溶液中的 H+数目为 0.02NA
4.常温下,向 10 mL 0.2mol•L-1 的 MOH 中逐滴加入 0.2 mol•L-1 的 CH3COOH 溶液,溶液的导电能力如图 1
所示,溶液的 pH 变化如图 2 所示(已知:常温时,NH3∙H2O 和 CH3COOH 的电离常数均为 1.8×10-5), 下列
说法正确的是
A.图 l 中 N 点时,加入 CH3COOH 溶液的体积为 l 0 mL
B.MOH 是一种弱碱,相同条件下其碱性弱于 NH3•H2O 的碱性
C.图 2 中 b 点时,加入 CH3COOH 溶液的体积为 l 0 mL
D.若 c 点对应醋酸的体积是 15 mL,则此时溶液中:c(CH3COOH) + c(CH3COO-) < 0.1 mol•L-1
5.常温下,0.1mol·L-1 的 H2A 溶液中各种微粒浓度的对数值(lgc)与 pH 的关系如图所示。
下列说法不正确的是
A.H2A 是二元弱酸
B.HA- H++A2-的电离平衡常数 Ka=10-12
C.0.1mol·L-1 的 H2A 溶液中:c(H+)=c(HA-)+2c(A2-)+c(OH-)
D.pH=4.2 时:c(HA-)=c(A2-)>c(H+)>c(H2A)>c(OH-)
6.25°C, 在 0. 1 mol• L-1 的 CH3COOH 溶液中滴加 NaOH 溶液,溶液中 c(CH3COOH)、c(CH3COO-)与 pH
的关系如图所示。下列叙述正确的是
A.曲线 I 表示混合溶液中 c(CH3COO-)随 pH 变化关系
B.a 点溶液的导电能力比 b 点的强
C.25℃时,CH3COOH 的电离平衡常数为 10-4.75
D.pH=5.5 的溶液中:c(Na+)>c(CH3COO-)>c(CH3COOH)
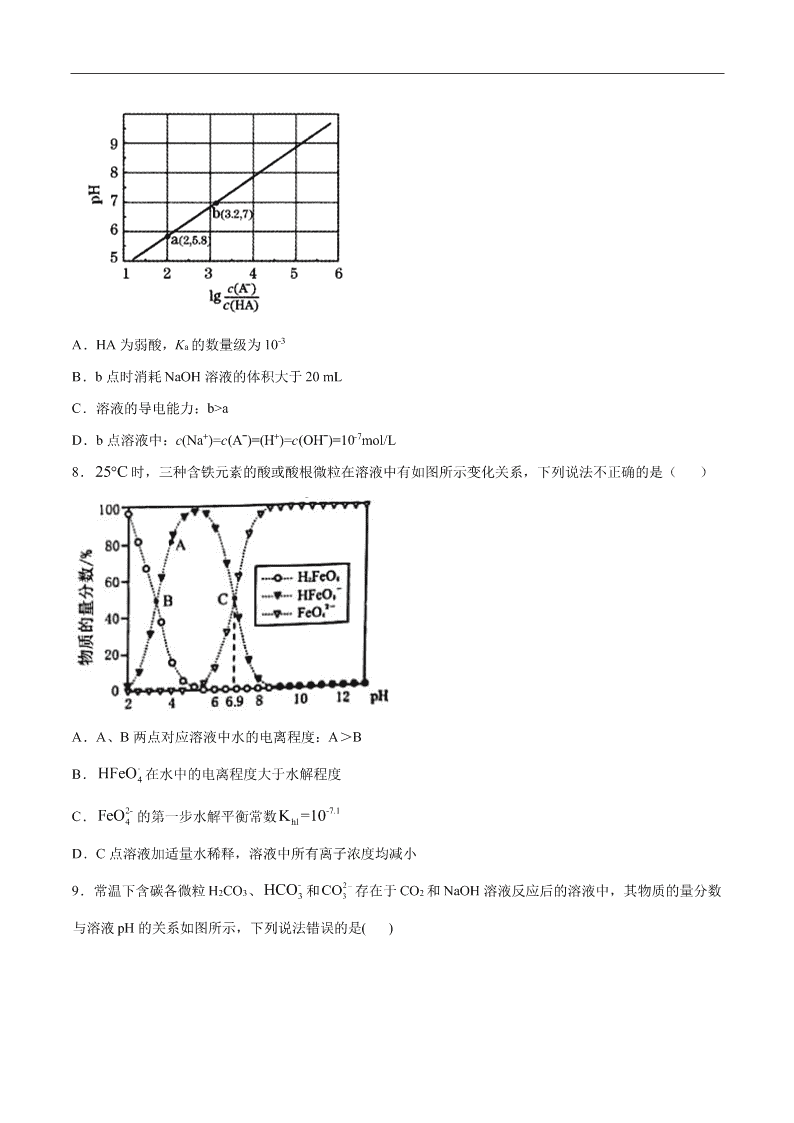
7.室温下,用 0.10 mol·L-1NaOH 溶液滴定 20 mL 0.10 mol·L-1HA 溶液,测得混合溶液的 pH 与 lg
-
HA
Ac
c
的
关系如图所示。下列叙述正确的是
A.HA 为弱酸,Ka 的数量级为 10-3
B.b 点时消耗 NaOH 溶液的体积大于 20 mL
C.溶液的导电能力:b>a
D.b 点溶液中:c(Na+)=c(Aˉ)=(H+)=c(OHˉ)=10-7mol/L
8. 2 5 C 时,三种含铁元素的酸或酸根微粒在溶液中有如图所示变化关系,下列说法不正确的是( )
A.A、B 两点对应溶液中水的电离程度:A>B
B. -
4HFeO 在水中的电离程度大于水解程度
C. 2-
4FeO 的第一步水解平衡常数 -7.1
hlK=10
D.C 点溶液加适量水稀释,溶液中所有离子浓度均减小
9.常温下含碳各微粒 H2CO3、 -
3HCO 和 2
3CO 存在于 CO2 和 NaOH 溶液反应后的溶液中,其物质的量分数
与溶液 pH 的关系如图所示,下列说法错误的是( )
A.pH=10.25 时,c(Na+)=c( 2
3CO )+c( -
3H C O )
B.为获得尽可能纯的 NaHCO3,宜控制溶液的 pH 为 7~9 之间
C.根据图中数据,可以计算得到 H2CO3 第一步电离的平衡常数 K1(H2CO3)=10-6.37
D.若是 0.1molNaOH 反应后所得的 1L 溶液,pH=10 时,溶液中存在以下关系:c(Na
+)>c( )>c( )>c(OH-)>c(H+)
10.常温下,浓度均为 0.10 mol/L、体积均为 V0 的 HA 和 HB 溶液,分别加水稀释至体积 V,pH 随 的
变化如图所示,下列叙述正确的是( )
A.该温度下 HB 的电离平衡常数约等于 1.11×10-5
B.当
0
lg3V
V 时,若两溶液同时升高温度,则 ()
()
cB
cA
减小
C.相同条件下 NaA 溶液的 pH 大于 NaB 溶液的 pH
D.溶液中水的电离程度:a=c>b
11.已知锌及其化合物的性质与铝及其化合物相似。如图横坐标为溶液的 pH,纵坐标为 Zn2+或[Zn(OH)4 ]2-
的物质的量浓度的对数。25℃时,下列说法中不正确的是
A.往 ZnCl2 溶液中加入过量氢氧化钠溶液,反应的离子方程式为 Zn2++4OH-=[Zn(OH)4]2-
B.若要从某废液中完全沉淀 Zn2+,通常可以调控该溶液的 pH 在 8.0—12.0 之间
C.pH=8.0 与 pH=12.0 的两种废液中,Zn2+浓度之比为 108
D.该温度时,Zn(OH)2 的溶度积常数(Ksp)为 1×l0-10
12.以菱镁矿(主要成分为 MgCO3,含少量 SiO2,Fe2O3 和 A12O3)为原料制备高纯镁砂的工艺流程如下:
已知浸出时产生的废渣中有 SO2,Fe(OH)3 和 Al(OH)3。下列说法错误的是
A.浸出镁的反应为 4232MgO+2NH Cl=MgCl +2NH+H O
B.浸出和沉镁的操作均应在较高温度下进行
C.流程中可循环使用的物质有 NH3、NH4Cl
D.分离 Mg2+与 Al3+、Fe3+是利用了它们氢氧化物 Ksp 的不同
13.实验室由炼钢污泥(简称铁泥,主要成份为铁的氧化物)制备软磁性材料 α-Fe2O3。
其主要实验流程如下:
(1)酸浸:用一定浓度的 H2SO4 溶液浸取铁泥中的铁元素。若其他条件不变,实验中采取下列措施能提高铁
元素浸出率的有___________(填序号)。
A.适当升高酸浸温度
B.适当加快搅拌速度
C.适当缩短酸浸时间
(2)还原:向“酸浸”后的滤液中加入过量铁粉,使 Fe3+完全转化为 Fe2+。“还原”过程中除生成 Fe2+外,还会生
成___________(填化学式);检验 Fe3+是否还原完全的实验操作是______________。
(3)除杂:向“还原”后的滤液中加入 NH4F 溶液,使 Ca2+转化为 CaF2 沉淀除去。若溶液的 pH 偏低、将会导
致 CaF2 沉淀不完全,其原因是___________[ -9
sp2 CaF=5.310K , -4
a (HF)=6.310K ]。
(4)沉铁:将提纯后的 FeSO4 溶液与氨水-NH4HCO3 混合溶液反应,生成 FeCO3 沉淀。
①生成 FeCO3 沉淀的离子方程式为____________。
②设计以 FeSO4 溶液、氨水- NH4HCO3 混合溶液为原料,制备 FeCO3 的实验方案:__。
(FeCO3 沉淀需“洗涤完全”,Fe(OH)2 开始沉淀的 pH=6.5)。
14.某化学兴趣小组的同学利用酸碱滴定法测定某变质烧碱样品(含 Na2CO3 杂质)中 NaOH 的质量分数。实
验步骤如下:
(I)迅速地称取烧碱样品 0.50 g,溶解后配制成 100 mL 溶液,备用。
(II)将 0.1000 mol·L−1HCl 标准溶液装入酸式滴定管,调零,记录起始读数 V0;用碱式滴定管取 20.00mL 样
品溶液于锥形瓶中,滴加 2 滴酚酞;以 HCl 标准溶液滴定至第一终点,记录酸式滴定管的读数 V1;然后再
向锥形瓶内滴加 2 滴甲基橙,继续用 HCl 标准溶液滴定至第二终点,记录酸式滴定管的读数 V2。重复上述
操作两次,记录数据如下:
实验序号 1 2 3
V0/ mL 0.00 0.00 0.00
V1/ mL 22.22 22.18 22.20
V2/ mL 23.72 23.68 23.70
(1)步骤 I 中所需的玻璃仪器有烧杯、玻璃棒、胶头滴管和__。酸式滴定管用蒸馏水洗净后、装入标准溶液
并调零之前,应进行的操作是__。
(2)溶液中的 H2CO3、 -
3H C O 、 2-
3CO 的物质的量分数随 pH 的变化如图所示:
酚酞和甲基橙指示剂的变色 pH 范围及对应颜色见表。
酚酞
无色
pH < 8.0
粉红
pH 8.0~9.8
红
pH > 9.8
甲基橙
红
pH < 3.1
橙
pH 3.1~4.4
黄
pH > 4.4
①滴定至第一终点时,溶液中含碳微粒的主要存在形式为__。
②滴定至第一终点的过程中,发生反应的离子方程式为__。
③已知:pKa1= −lgKa1,结合图像可知,H2CO3 的 pKa1 约为__。
a.5.0 b.6.4 c.8.0 d.10.3
(3)下列有关滴定的说法正确的是__。
a.滴定至第一终点时,溶液中 c(H+)+c(Na+) = 2c( 2
3CO ) + c( 3H C O ) + c(OH−)
b.滴定至第一终点时,溶液中 n(Cl−) +n( ) + n( ) + n(H2CO3) =n(Na+)
c.判断滴定至第二终点的现象是溶液由黄色变为橙色
d.记录酸式滴定管读数 V1 时,俯视标准液液面,会导致测得的 NaOH 质量分数偏低
(4)样品中 NaOH 的质量分数 ω(NaOH) =__%(计算结果保留小数点后 1 位)
15.为探究 Na2SO3 溶液和铬(VI)盐溶液的反应规律,某小组同学进行实验如下: 已知: 2-
27C r O (橙色)+ H2O⇌
2-
4CrO (黄色)+ 2H+
(1)配制溶液
序号 操作 现象
i 配制饱和 Na2SO3 溶液,测溶液的 pH pH 约为 9
ii
配制 0.05 mol·L−1 的 K2Cr2O7 溶液,把溶液平均分成两
份,向两份溶液中分别滴加浓硫酸和浓 KOH 溶液,得
到 pH=2 的溶液 A 和 pH=8 的溶液 B
pH=2 的溶液 A 呈橙
色;pH=8 的溶液 B 呈
黄色
① 用化学用语表示饱和 Na2SO3 溶液 pH 约为 9 的原因:__。
(2)进行实验 iii 和 iv:
序号 操作 现象
iii 向 2 mL 溶液 A 中滴加 3 滴饱和 Na2SO3 溶液 溶液变绿色(含 Cr3+)
iv 向 2 mL 溶液 B 中滴加 3 滴饱和 Na2SO3 溶液 溶液没有明显变化
② 用离子方程式解释 iii 中现象:__。
(3)继续进行实验 v:
序号 操作 现象
v 向 2 mL 饱和 Na2SO3 溶液中滴加 3 滴溶液 A 溶液变黄色
vi 向 2 mL 蒸馏水中滴加 3 滴溶液 A 溶液变浅橙色
③ 实验 vi 的目的是__。
④ 用化学平衡移动原理解释 v 中现象:__。
⑤ 根据实验 iii~v,可推测:Na2SO3 溶液和铬(VI)盐溶液的反应与溶液酸碱性有关,__。
⑥ 向实验 v 所得黄色溶液中滴加__,产生的现象证实了上述推测。
(4)继续探究溶液酸性增强对铬(VI)盐溶液氧化性的影响,该同学利用如图装置继续实验(已知电压大小反映
了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大)。
a.K 闭合时,电压为 a。
b.向 U 型管左侧溶液中滴加 3 滴浓硫酸后,电压增大了 b。
⑦ 上述实验说明:__。
⑧ 有同学认为:随溶液酸性增强,溶液中 O2 的氧化性增强也会使电压增大。利用如图装置选择合适试剂
进行实验,结果表明 O2 的存在不影响上述结论。该实验方案是__,测得电压增大了 d(d < b)。
16.某实验小组同学对影响 CuSO4 溶液和浓氨水反应产物的因素进行了如下探究。
(查阅资料)
①Cu(OH)2(s) ⇌ Cu2+ + 2OH- Ksp = 2.2×10-20; 2+
3 4Cu NH ⇌Cu2+ + 4NH3 K = 4.8×10-14
②Cu(NH3)4SO4·H 2O 是一种易溶于水、难溶于乙醇的深蓝色固体, 加热分解有氨气放出。Cu(NH3)4SO4·H 2O
在乙醇-水混合溶剂中的溶解度如下图所示。
(实验 1)CuSO4 溶液和浓氨水的反应。
序号 实验内容 实验现象
1-1
向 2 mL 0.1 mol/L CuSO4(pH=3.2)
中逐滴加入 2 mL 1 mol/L 氨水
立即出现浅蓝色沉淀,溶液变无色; 随后
沉淀逐渐溶解,溶液变为蓝色;最终得到澄
清透明的深蓝色溶液 A
1-2
向 2 mL 1 mol/L 氨水中逐滴加入
2 mL 0.1 mol/L CuSO4(pH=3.2)
始终为澄清透明的深蓝色溶液 B
(1)进一步实验证明,深蓝色溶液 A、B 中均含有 2+
3 4Cu NH ,相应的实验方案____(写出实验操作及现象)。
(实验 2)探究影响 CuSO4 溶液和浓氨水反应产物的因素。
序号 实验内容 实验现象
2-1
向实验 1-2 所得深蓝色溶液 B 中继续加
入 2 mL 0.1 mol/L CuSO4(pH=3.2)
有浅蓝色沉淀生成,溶液颜色变浅
2-2
向实验 1-2 所得深蓝色溶液 B 中继续加
入 1 mol/L NaOH
有浅蓝色沉淀生成,上层清液接近无色
2-3
向 2 mL 0.1 mol/L 氨水中逐滴加入 2 mL
0.1 mol/L CuSO4(pH=3.2)
有浅蓝色沉淀生成,上层清液接近无色
(2)依据实验 2-1,甲同学认为 Cu2+浓度是影响 CuSO4 溶液和浓氨水反应产物的因素之一。乙同学认为实验
2-1 没有排除硫酸铜溶液呈酸性的干扰,并设计了如下对比实验:
序号 实验内容 实验现象
2-4
向实验 1-2 所得深蓝色溶液 B 中继
续加入 2 mL 试剂 a
无明显现象
①用化学用语表示硫酸铜溶液呈酸性的原因:___________________________。
②试剂 a 为 ___________________________。
(3)利用平衡移动原理对实验 2-2 的现象进行解释:____________________________。
(4)实验 2-3 的目的是__________________________。
(5)综合上述实验可以推测, 影响 CuSO4 溶液和浓氨水反应产物的因素有____________。
参考答案
1.D【解析】A.向 0.1 mol•L-1CH3COOH 溶液中加入少量水,醋酸电离平衡正向移动,溶液中
3
cH
c CH COOH
( )
( )
增大,故 A 错误;
B.将 CH3COONa 溶液从 20℃升温至 60℃,醋酸根离子水解平衡正向移动,溶液中 c(CH3COO-)减小,c
(CH3COOH)、 c(OH-)均增大,所以 3
3 ]·[
c CH COO
c CH COOH c OH
( )
( )( )减小,故 B 错误;
C.向盐酸中加入氨水至中性,根据电荷守恒,溶液中 c(NH4+)=c(Cl-),所以:c(NH4+): c(Cl-)=1,
故 C 错误;
D.pH=4.5 的番茄汁中 c(H+)= 4.51 10 ,是 pH=6.5 的牛奶中 c(H+)= 6.51 1 0 ,pH=4.5 的番茄汁中 c(H+)
是 pH=6.5 的牛奶中 c(H+)的 100 倍,故 D 正确;
故选 D。
2.D【解析】A.向溶液中加入铜粉,铜与 Fe3+发生反应 Cu + 2Fe3+ = Cu2+ + 2Fe2+,会引入 Cu2+ 杂质,不
符合除杂原则,故 A 错误;
B.NH4Cl 水解促进水的电离,稀盐酸中盐酸电离出的氢离子抑制水的电离,因此常温下,pH 为 5 的 NH4Cl
溶液和 pH 为 5 的稀盐酸中,水的电离程度不相同,故 B 错误;
C.草酸为弱酸,以第一步电离为主,因此 0.1 mol•L-1 的 H2C2O4 溶液中 c(H+)/c(C2O 2-
4 )远大于 2,故 C 错误;
D.氨水中存在 NH3·H 2O NH4++OH-,滴加等浓度的盐酸溶液,c(OH-)减小,平衡正向移动,c(NH 4
)
增大,当二者恰好完全反应后继续滴加等浓度的盐酸溶液,溶液的体积增大,c(NH )又减小,故 D 正确;
故选 D。
3.B【解析】A.
2-2-+
--++
(A)(A)(H)
(HA)(HA)(H)(H)
==cccK
cccc
,根据题意可知 H2A 第一步完全电离,第二步部分电离,
所以 0.01mol·L-1 的 H2A 溶液中 c(H+)>0.01mol/L,K=1.2×10-2,所以 +( H )
K
c
<1.2,故 A 错误;
B.H2A 第一步完全电离,第二步部分电离,所以 0.01mol·L-1 的 H2A 溶液中 c(H+)>0.01mol/L,则溶液的
pH 小于 2,故 B 正确;
C.由于第一步完全电离,所以溶液中并不存在 H2A,故 C 错误;
D.H2A 第一步完全电离,第二步部分电离,所以 0.01mol·L-1 的 H2A 溶液中 0.01mol/L<c(H+)<0.02mol/L,
则 1L 该溶液中氢离子数目小于 0.02NA,故 D 错误;
答案为 B。
4.A【解析】根据图 2 可知,0.2mol•L-1 的 MOH 的 pH=12,说明 MOH 为弱碱,则 MOH 的电离平衡常数
=
M OH
M
)
OH
( cc
c
= 0 .0 1 0 .0 1
0 .2 0 .0 1
=5.2×10-4;向 10 mL 0.2mol•L-1 的 MOH 中逐滴加入 0.2 mol•L-1 的 CH3COOH
溶液,随着醋酸的加入,溶液的导电能力逐渐增强,是因为反应生成了强电解质 CH3COOM,当二者恰好
完全反应时,溶液中 CH3COOM 浓度最大,溶液的导电能力最强,继续滴加醋酸溶液,溶液的体积增大,
溶液的导电能力又逐渐减小,结合滴定曲线分析解答。
A.MOH 为弱碱,向 10 mL 0.2mol•L-1 的 MOH 中逐滴加入 0.2 mol•L-1 的 CH3COOH 溶液,随着醋酸的加入,
溶液的导电能力逐渐增强,是因为反应生成了强电解质 CH3COOM,当二者恰好完全反应时,溶液中
CH3COOM 浓度最大,溶液的导电能力最强,因此图 l 中 N 点时,加入 CH3COOH 溶液的体积为 l 0 mL,故
A 正确;
B.根据上述计算,MOH 的电离平衡常数= = =5.2×10-4>1.8×10-5,即相同条件
下其碱性比 NH3•H2O 的碱性强,故 B 错误;
C.常温时,NH3∙H2O 和 CH3COOH 的电离常数均为 1.8×10-5,说明醋酸铵溶液显中性;MOH 的碱性比
NH3•H2O 的碱性强,与醋酸恰好中和时,溶液显碱性,而 b 点 pH=7,因此 b 点不是滴定终点,而且 b 点加
入 CH3COOH 溶液的体积大于 l 0 mL,故 C 错误;
D.若 c 点对应醋酸的体积是 15 mL,此时溶液中含有醋酸和 CH3COOM,根据物料守恒,c(CH3COOH) +
c(CH3COO-)= 0.2mol / L 0.
0.
0 5L
L
1
025
>0.1 mol•L-1,故 D 错误。
故选 A。
5.B【解析】A. 溶液中存在 H2A、H+、HA-、A2-,说明 H2A 是二元弱酸,故 A 正确;B. HA- H++A2-
的电离平衡常数 Ka=
AH
HA
cc
c
=c(H+)=10-4.2,故 B 不正确;C. 0.1mol·L-1 的 H2A 溶液中:
c(H+)=c(HA-)+2c(A2-)+c(OH-),故 C 正确;D. 由图可知 pH=4.2 时:c(HA-)=c(A2-)>c(H+)>c(H2A)>c(OH-),故
D 正确。故选 B。
6.C【解析】A.根据分析,曲线Ⅱ表示混合溶液中 c(CH3COO-)随 pH 变化关系,故 A 错误;
B.a、b 点均在曲线Ⅱ上,从 a 到 b 溶液的 c(CH3COO-)浓度增大,c(CH3COOH)逐渐减小,溶液中离子的含
量最多,导电能力增强,则 a 点溶液的导电能力比 b 点的若,故 B 错误;
C.25℃时,CH3COOH 的电离平衡常数表达式为:Ka=
-+
3
3
cCHCOOcH
cCHCOOH
,c 点时,c(CH3COO-)=
c(CH3COOH),溶液 pH=4.75,即溶液中 c(H+)=10-4.75mol/L,则 Ka=c(H+)=10-4.75mol/L,故 C 正确;
D.由图像可知,pH=5.5 的溶液中,c(CH3COO-)>c(CH3COOH),溶液中存在电荷守恒:c(Na+)+ c(H+)=
c(CH3COO-)+ c(OH-),溶液显酸性,则 c(H+)>c(OH-),因此 c(Na+)<c(CH3COO-),故 D 错误;
答案选 C。
7.C【解析】A.据图可知溶液 pH 为 7 时溶液中同时存在 HA 和 Aˉ,说明 NaA 溶液显碱性,存在 Aˉ的水
解,所以 HA 为弱酸;根据 a 点可知当 lg
-
HA
Ac
c
=2 时 pH=5.8,即 =102 时 c(H+)=10-5.8,Ka=
-+
2 -5.8
HA
AH
=10 10
cc
c =10-3.8≈1.58×10-4,所以数量级为 10-4,故 A 错误;
B.当 NaOH 溶液为 20mL 时,溶液中的溶质为 NaA,由于 HA 为弱酸,所以溶液显碱性,所以当溶液 pH=7
时加入的 NaOH 溶液体积小于 20mL,故 B 错误;
C.a 点和 b 点溶液中均存在电荷守恒 c(Na+)+c(H+)=c(Aˉ)+c(OHˉ),所以溶液中总离子浓度均为
2[c(Aˉ)+c(OHˉ)],b 点 c(Aˉ)和 c(OHˉ)均更大,所以 b 点溶液中总离子浓度更大,离子所带电荷数相同,所
以 b 点溶液导电能力更强,故 C 正确;
D.b点溶液中溶质为NaA和HA,存在电荷守恒:c(Na+)+c(H+)=c(Aˉ)+c(OHˉ),溶液显中性,所以c(H+)=c(OHˉ),
所以 c(Na+)=c(Aˉ),弱电解质的电离和弱酸根的水解都是微弱的,所以 c(Na+)=c(Aˉ)>(H+)=c(OHˉ),故 D 错
误;
综上所述答案为 C。
8.D【解析】A.图中 A、B 点溶液均为酸性,主要存在 24H F e O 和 4H F e O 的电离平衡,A 点 pH 值大于
B 点,A 点 OHc 大于 B 点,OH-几乎由水电离出,故水的电离程度 A 点大于 B 点,故 A 正确;
B.当 4HFeOc 最大时溶液为酸性,故 在水中的电离大于水解, 故 B 正确;
C. 2
4F eO 的第一步水解反应为: 2
424FeOHOHFeOOH,
4
hl 2
4
HFeOOH
FeO
cc
K
c
,C 点
2
44HFeOFeOcc ,pH=6.9,即 6.9H 10c mol/L,
-14
7.1W
h1 -6.9
10OH=10 10H
KKc
c ,故
C 正确;
D. 2 5 C 时,温度不变,水的离子积常数不变, Hc 与 不可能同时减小,故 D 错误;
答案选 D。
9.A【解析】A.pH=10.25 时,溶质为碳酸钠和碳酸氢钠,碳酸钠溶液中满足物料守恒:
2--
3323Na222H COCOHCOcccc ,碳酸氢钠溶液中存在物料守恒:
2-
3 23
-
3N CO Ha COCO Hc c c c ,则混合液中 2- -
33CO H ONa Cc c c ,故 A 说法错
误;
B.根据图示可知,pH 在 7∼9 之间,溶液中主要存在 -
3H C O ,该 pH 范围内可获得较纯的 NaHCO3,故 B
说法正确;
C.根据图象曲线可知,pH=6.37 时,H2CO3 和 的浓度相等,碳酸的第一步电离的平衡常数
6.37
1
23
-
3 H
10H
HCO
CO
cc
K c
,故 C 说法正确;
D.pH=10 时的溶液为碱性,则 c(OH−)>c(H+),溶质为碳酸钠和碳酸氢钠,c(Na+)离子浓度最大,结合图象
曲线变化可知: - 2-
33HCO COcc ,OH-为 2-
3CO 、 水解所得,水解程度微弱,因此离子浓度大
小为: -2-
33HCOCNaOHH Occccc ,故 D 说法正确;
综上所述,说法错误的是 A,故答案为:A。
10.A【解析】0.1mol/L 的 HA 溶液的 pH=1,说明 HA 完全电离,所以 HA 为强酸,0.1mol/L 的 HB 溶液的
pH>2,说明 HB 在溶液中部分电离,所以 HB 是弱酸。
A.a 点时,存在平衡:HB⇌H++B-,稀释 100 倍后,HB 溶液的 pH=4,溶液中 c(B-)≈c(H+)=10-4mol/L,
则 Ka=c(H+)c(B−)/c(HB)=10−4×10−4/(0.001−10−4)=1.11×10-5,A 正确;
B.升高温度促进弱酸的电离,所以 HB 中 B-浓度增大,强酸的酸根离子浓度不变,所以 A-的浓度不变,因
此 c(B−)/c(A−)增大,B 错误;
C.HA 为强酸,NaA 是强酸强碱盐不水解,溶液显中性,NaB 为强碱弱酸盐,水解显碱性,所以相同条件
下 NaA 溶液的 pH 小于 NaB 溶液的 pH,C 错误;
D.酸抑制水的电离,酸电离出的氢离子浓度越大,对水的抑制程度越大,氢离子浓度:a=c>b,所以溶液
中水的电离程度:a=c<b,D 错误;
答案选 A。
11.D【解析】由题意知,锌及其化合物的性质与铝及其化合物相似,则氢氧化锌是两性氢氧化物。由图可
知,在 a 点,pH=7.0,lgc(Zn2+)=-3.0,所以 c(OH-)=10-7mol/L、c(Zn2+)=10-3mol/L,Ksp[Zn(OH) 2]=10-17。当
pH=8.0 时,c(Zn2+)=
17
5
26
10 10
10
mol/L,当 pH=12.0 时,c(Zn2+)=
17
13
22
10 10
10
mol/L,所以 pH=8.0 与
pH=12.0 的两种废液中,Zn2+浓度之比为 108。A. 往 ZnCl2 溶液中加入过量氢氧化钠溶液,反应的离子方程
式为 Zn2++4OH-=[Zn(OH)4]2-,A 正确;B. 若要从某废液中完全沉淀 Zn2+,由图像可知,通常可以调控该溶
液的 pH 在 8.0—12.0 之间,B 正确;C. pH=8.0 与 pH=12.0 的两种废液中,Zn2+浓度之比为 108,C 正确;D.
该温度时,Zn(OH)2 的溶度积常数(Ksp)为 1×l0-17,D 不正确。本题选 D。
12.B【解析】菱镁矿煅烧后得到轻烧粉,MgCO3 转化为 MgO,加入氯化铵溶液浸取,浸出的废渣有 SiO2、
Fe(OH)3、Al(OH)3,同时产生氨气,则此时浸出液中主要含有 Mg2+,加入氨水得到 Mg(OH)2 沉淀,煅烧得
到高纯镁砂。
A.高温煅烧后 Mg 元素主要以 MgO 的形式存在,MgO 可以与铵根水解产生的氢离子反应,促进铵根的水
解,所以得到氯化镁、氨气和水,化学方程式为 MgO+2NH4Cl=MgCl2+2NH3↑+H2O,故 A 正确;
B.一水合氨受热易分解,沉镁时在较高温度下进行会造成一水合氨大量分解,挥发出氨气,降低利用率,
故 B 错误;
C.浸出过程产生的氨气可以回收制备氨水,沉镁时氯化镁与氨水反应生成的氯化铵又可以利用到浸出过程
中,故 C 正确;
D.Fe(OH)3、Al(OH)3 的 Ksp 远小于 Mg(OH)2 的 Ksp,所以当 pH 达到一定值时 Fe3+、Al3+产生沉淀,而 Mg2+
不沉淀,从而将其分离,故 D 正确;
故答案为 B。
13.(1)AB(2)H2;取少量清液,向其中滴加几滴 KSCN 溶液,观察溶液颜色是否呈血红色(3)pH 偏
低形成 HF,导致溶液中 F-浓度减小,CaF2 沉淀不完全(4)①
2
332342FeHCONHH OFeCONHH O 或 2
3334FeHCONHFeCONH ②在搅
拌下向 FeSO4 溶液中缓慢加入氨水-NH4HCO3 混合溶液,控制溶液 pH 不大于 6.5;静置后过滤,所得沉淀用
蒸馏水洗涤 2~3 次;取最后一次洗涤后的滤液,滴加盐酸酸化的 BaCl2 溶液,不出现白色沉淀
【解析】铁泥的主要成份为铁的氧化物,铁泥用 H2SO4 溶液“酸浸”得到相应硫酸盐溶液,向“酸浸”后的滤液
中加入过量铁粉将 Fe3+还原为 Fe2+;向“还原”后的滤液中加入 NH4F 使 Ca2+转化为 CaF2 沉淀而除去;然后
进行“沉铁”生成 FeCO3,将 FeCO3 沉淀经过系列操作制得 α—Fe2O3;据此分析作答。
(1)A.适当升高酸浸温度,加快酸浸速率,能提高铁元素的浸出率,A 选;
B.适当加快搅拌速率,增大铁泥与硫酸溶液的接触,加快酸浸速率,能提高铁元素的浸出率,B 选;
C.适当缩短酸浸时间,铁元素的浸出率会降低,C 不选;
答案选 AB。
(2)为了提高铁元素的浸出率,“酸浸”过程中硫酸溶液要适当过量,故向“酸浸”后的滤液中加入过量的铁粉
发生的反应有:Fe+2Fe3+=3Fe2+、Fe+2H+=Fe2++H2↑,“还原”过程中除生成 Fe2+外,还有 H2 生成;通常用 KSCN
溶液检验 Fe3+,故检验 Fe3+是否还原完全的实验操作是:取少量清液,向其中滴加几滴 KSCN 溶液,观察
溶液颜色是否呈血红色,若不呈血红色,则 Fe3+还原完全,若溶液呈血红色,则 Fe3+没有还原完全,故答案
为:H2,取少量清液,向其中滴加几滴 KSCN 溶液,观察溶液颜色是否呈血红色。
(3)向“还原”后的滤液中加入 NH4F 溶液,使 Ca2+转化为 CaF2 沉淀,Ksp(CaF2)=c(Ca2+)·c2(F-),当 Ca2+完全沉
淀(某离子浓度小于 1×10-5mol/L 表明该离子沉淀完全)时,溶液中 c(F-)至少为
9
5
5.3 10
1 10
mol/L= 5.3
×10-2mol/L;若溶液的 pH 偏低,即溶液中 H+浓度较大,H+与 F-形成弱酸 HF,导致溶液中 c(F-)减小,CaF2
沉淀不完全,故答案为:pH 偏低形成 HF,导致溶液中 F-浓度减小,CaF2 沉淀不完全。
(4)①将提纯后的 FeSO4 溶液与氨水—NH4HCO3 混合溶液反应生成 FeCO3 沉淀,生成 FeCO3 的化学方程式为
FeSO4+NH3·H 2O+NH4HCO3=FeCO3↓+(NH4)2SO4+H2O[或 FeSO4+NH3+NH4HCO3=FeCO3↓+(NH4)2SO4],离子
方程式为 Fe2++ -
3HCO +NH3·H 2O=FeCO3↓+ +
4NH +H2O(或 Fe2++ +NH3=FeCO3↓+ ),答案为:Fe2++
+NH3·H 2O=FeCO3↓+ +H2O(或 Fe2++ +NH3=FeCO3↓+ )。
②根据题意 Fe(OH)2 开始沉淀的 pH=6.5,为防止产生 Fe(OH)2 沉淀,所以将 FeSO4 溶液与氨水—NH4HCO3
混合溶液反应制备 FeCO3 沉淀的过程中要控制溶液的 pH 不大于 6.5;FeCO3 沉淀需“洗涤完全”,所以设计
的实验方案中要用盐酸酸化的 BaCl2 溶液检验最后的洗涤液中不含 2-
4SO ;则设计的实验方案为:在搅拌下
向 FeSO4 溶液中缓慢加入氨水—NH4HCO3 混合溶液,控制溶液 pH 不大于 6.5;静置后过滤,所得沉淀用蒸
馏水洗涤 2~3 次;取最后一次洗涤后的滤液,滴加盐酸酸化的 BaCl2 溶液,不出现白色沉淀,故答案为:在
搅拌下向 FeSO4 溶液中缓慢加入氨水—NH4HCO3 混合溶液,控制溶液 pH 不大于 6.5;静置后过滤,所得沉
淀用蒸馏水洗涤 2~3 次;取最后一次洗涤后的滤液,滴加盐酸酸化的 BaCl2 溶液,不出现白色沉淀。
14.(1)100mL 容量瓶(量筒);用标准盐酸溶液润洗酸式滴定管(2) ① -
3H C O ②H++OH-═H2O、H+ + 2
3CO =
3H C O ③b(3)bcd(4)84.1
【解析】(1)配制一定物质的量浓度溶液的一般步骤为:计算、称量、溶解、移液、洗涤、定容、摇匀,
用到的仪器:托盘天平、药匙、烧杯、玻璃棒、胶头滴管;还缺少的玻璃仪器:100mL 容量瓶(量筒),酸式
滴定管用蒸馏水洗净后、装入标准溶液前,应进行的操作是:用 HCl 标准溶液润洗酸式滴定管,故答案为:
100 mL 容量瓶;用 HCl 标准溶液润洗酸式滴定管;
(2) ①第一阶段滴定使用了酚酞做指示剂,故滴定到 pH 为 8 时,即为滴定终点,对照微粒分布图中可知,
此时,溶液中含碳微粒的主要存在形式为 ,故答案为: ;
②滴定至第一终点的过程中 OH-和 与盐酸反应分别生成水和 ,故该过程中发生反应的离子方程
式为 H++OH-═H2O,H+ + = ,故答案为:H++OH-═H2O,H+ + = ;
③根据电离平衡常数表达式可知H2CO3 的Ka1=
-+
3
23
c(HCO)c(H)
c(HCO) 结合图像可知,当 pH=6.4左右时,c( 23H CO )
= c( ),故 H2CO3 的 pKa1 约为 6.4,故答案为:b;
(3) a.滴定至第一终点时,溶液中的电荷守恒式为 c(H+)+c(Na+) = 2c( ) + c( ) +c(OH−)+c(Cl−),
故 a 错误;
b.滴定至第一终点时,溶液中是氯化钠和碳酸氢钠的混合溶液,故由物料守恒式:n(Cl−) +n( ) + n( )
+n(H2CO3) =n(Na+),故 b 正确;
c.根据图中可知,碳酸氢根基本完全转化为碳酸时,pH 大致为 4,故滴定至第二终点的现象是溶液由黄色
变为橙色,故 c 正确;
d.记录酸式滴定管读数 V1 时,俯视标准液液面,记录盐酸溶液体积 V1 减小,计算得到碳酸钠质量增大,
氢氧化钠质量减小,质量分数减小,故 d 正确;
故答案为:bcd;
(4)将 0.1000mol/L HCl 标准溶液装入酸式滴定管,调零,记录起始读数 V0;用碱式滴定管取 20.00 mL 样品
溶液于锥形瓶中,滴加 2 滴酚酞;以 HCl 标准溶液滴定至第一终点(此时溶质为 NaCl 和 NaHCO3),记录
酸式滴定管的读数 V1,发生的反应为 NaOH+HCl=NaCl+H2O,Na2CO3+HCl=NaHCO3+NaCl,然后再向锥形
瓶内滴加 2滴甲基橙,继续用 HCl标准溶液滴定至第二终点,发生的反应为:NaHCO3+HCl=NaCl+H2O+CO2↑,
记录酸式滴定管的读数 V2。重复上述操作两次,记录数据如表,
平均 V1= 22.22mL+22.18mL+22.20mL =22.20mL3
,平均 V2= 23.72mL+23.68mL+23.70mL =3 23.70mL ,
发生反应 NaHCO3+HCl=NaCl+H2O+CO2↑,消耗的盐酸溶液体积=23.70mL-22.20mL=1.50mL,结合反应过程
计算样品中碳酸钠的质量=0.0015L×0.1mol/L×1 0 0 m L
2 0 m L =0.00075mol,得到样品中氢氧化钠的质量分数=
0.50g-0.00075mol?106g/mol×100%=84.1%0.50g ,故答案为:84.1。
15.(1)① 2
3SO +H2O 3H SO +OH-(2)② 2
27C r O +3 +8H+=2Cr3++3 2
4SO +4H2O(3)③排除水的稀释对溶
液颜色变化造成的影响④ 2-
27C r O (橙色)+ H2O⇌ 2-
4CrO (黄色)+2H+,溶液中大量的 或 OH-,与 H+结合,
导致溶液中 c(H+)下降,平衡正向移动,溶液颜色变黄色⑤在碱性条件下,Na2SO3 溶液和铬(VI)盐溶液
不发生氧化还原反应,在酸性条件下,Na2SO3 溶液和铬(VI)盐溶液不发生氧化还原反应,生成 Cr3+⑥硫酸
(4)⑦溶液酸性增强,铬(VI)盐溶液的氧化性增强⑧U 型管左侧盛放 pH=2 的 0.05 mol·L−1 的 K2SO4 溶液,右
侧盛放 Na2SO3 溶液,闭合 K,记录电压,左侧溶液中滴加 3 滴浓硫酸后,再记录电压
【解析】 (1)①Na2SO3 溶液中 会水解使溶液显碱性,pH 约为 9,其水解方程式为: +H2O
+OH-,故答案为: +H2O +OH-;
(2)②酸性环境下,K2Cr2O7 与 Na2SO3 发生氧化还原反应生成 Cr3+,其离子反应方程式为: +3
+8H+=2Cr3++3 +4H2O,故答案为: +3 +8H+=2Cr3++3 +4H2O;
(3)③实验 vi 的目的是排除水的稀释对溶液颜色变化造成的影响,故答案为:排除水的稀释对溶液颜色变化
造成的影响;
④向 2 mL 饱和 Na2SO3 溶液中滴加酸性 K2Cr2O7 溶液,根据 (橙色)+ H2O⇌ (黄色)+2H+,溶液中
大量的 或 OH-,与 H+结合,导致溶液中 c(H+)下降,平衡正向移动,溶液颜色变黄色,故答案为:
2-
27C r O (橙色)+ H2O⇌ 2-
4CrO (黄色)+2H+,溶液中大量的 2
3SO 或 OH-,与 H+结合,导致溶液中 c(H+)下降,
平衡正向移动,溶液颜色变黄色;
⑤根据实验 iii~v,可推测:Na2SO3 溶液和铬(VI)盐溶液的反应与溶液酸碱性有关,在碱性条件下,Na2SO3
溶液和铬(VI)盐溶液不发生氧化还原反应,在酸性条件下,Na2SO3 溶液和铬(VI)盐溶液不发生氧化还原反
应,生成 Cr3+,故答案为:在碱性条件下,Na2SO3 溶液和铬(VI)盐溶液不发生氧化还原反应,在酸性条件下,
Na2SO3 溶液和铬(VI)盐溶液不发生氧化还原反应,生成 Cr3+;
⑥向实验 v 所得黄色溶液中继续滴加硫酸,溶液变绿,产生的现象证实了上述推测,故答案为:硫酸;
(4)⑦U 型管左侧溶液 A 为 pH=2 的 0.05 mol·L−1 的 K2Cr2O7 溶液,滴加浓硫酸,电压增大,说明溶液酸性增
强,K2Cr2O7 溶液的氧化性增强,故答案为:溶液酸性增强,铬(VI)盐溶液的氧化性增强;
⑧U 型管左侧盛放 pH=2 的 0.05 mol·L−1 的 K2SO4 溶液,右侧盛放 Na2SO3 溶液,闭合 K,记录电压,左侧
溶液中滴加 3 滴浓硫酸后,再记录电压,故答案为:U 型管左侧盛放 pH=2 的 0.05 mol·L−1 的 K2SO4 溶液,
右侧盛放 Na2SO3 溶液,闭合 K,记录电压,左侧溶液中滴加 3 滴浓硫酸后,再记录电压。
16.(1)向深蓝色溶液中加入大量乙醇,出现深蓝色沉淀,过滤洗涤沉淀后,将沉淀置于试管中加热,并
将湿润的红色石蕊试纸放在试管口,观察到红色的石蕊试纸变蓝(2)①Cu2+
+2H2O⇌Cu(OH)2+2H+②c(SO42-)= 0.1 mol/L 且 pH=3.2 的硫酸—硫酸钠混合溶液(3)存在 2+
3 4CuNH ⇌Cu2+
+ 4NH3,当加入氢氧化钠溶液,氢氧根离子和铜离子结合成氢氧化铜浅蓝色沉淀,使平衡向右移动,
浓度降低,溶液变为无色(4)与实验 1-2 对比,探究其它条件相同的情况下,氨水浓度对反
应产物的影响(5)铜离子的浓度、溶液的碱性、氨水的浓度(或氨水的浓度、硫酸铜和氨水的相对用量)
【解析】(1)因为 Cu(NH3)4SO4·H 2O 是一种易溶于水、难溶于乙醇的深蓝色固体, 加热分解有氨气放出,
所以检验溶液 A、B 中均含有 ,向溶液中加入大量乙醇,出现深蓝色沉淀,过滤洗涤沉淀后,
将沉淀置于试管中加热,并将湿润的红色石蕊试纸放在试管口,观察到红色的石蕊试纸变蓝;
(2)①硫酸铜是强酸弱碱盐,铜离子水解使溶液显酸性,水解的离子方程式是 Cu2++2H2O⇌ Cu(OH)2+2H+;
②跟据乙同学认为实验 2-1 没有排除硫酸铜溶液呈酸性的干扰,根据控制变量法,应设计一个对比实验,
对比在没有 Cu2+且 c(SO42-)和 pH 相同的条件下对反应产物的影响,所以可以加入 c(SO42-)= 0.1 mol/L 且
pH=3.2 的硫酸—硫酸钠混合溶液,排除酸性溶液的干扰;
(3) ⇌ Cu2++ 4NH3 是可逆反应,当加入氢氧化钠溶液时,铜离子与氢氧根离子反应生成氢氧化
铜沉淀,使铜离子浓度减少,依据勒夏特列原理,平衡向向右移动, 浓度降低,溶液变为无色;
(4)实验 2-3 是对比实验,与实验 1-2 对比,探究其它条件相同的情况下,氨水浓度对反应产物的影响;
(5)有实验 2-1、2-2、2-3 可以推测,影响 CuSO4 溶液和浓氨水反应产物的因素有铜离子的浓度、溶液的碱性、
氨水的浓度(或氨水的浓度、硫酸铜和氨水的相对用量)。