- 1.62 MB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2019~2020学年度第二学期期中调研测试
高二化学试题
本卷包括Ⅰ、Ⅱ两部分,总分100分,考试时间90分钟。
第Ⅰ卷(选择题,共62分)
一定条件
单项选择题(本题包括14小题,每小题只有1个选项符合题意,每小题3分,共42分)
1.反应2NO + 2CON2 + 2CO2可应用于汽车尾气的净化,下列关于该反应的说法正确的是
A.升高温度能减慢反应速率
B.减小CO浓度能加快反应速率
C.使用恰当的催化剂能加快反应速率
D.达到化学平衡时,NO能100%转化为产物
2.下列变化过程中,熵变小于0的是
高温高压
催化剂
A.H2O(s)→H2O(l)→H2O(g)
B.N2(g)+3H2(g)2NH3(g)
△
C.NaOH(s)=Na+(aq)+OH—(aq)
D.2NaHCO3(s) Na2CO3(s)+CO2(g)+H2O(g)
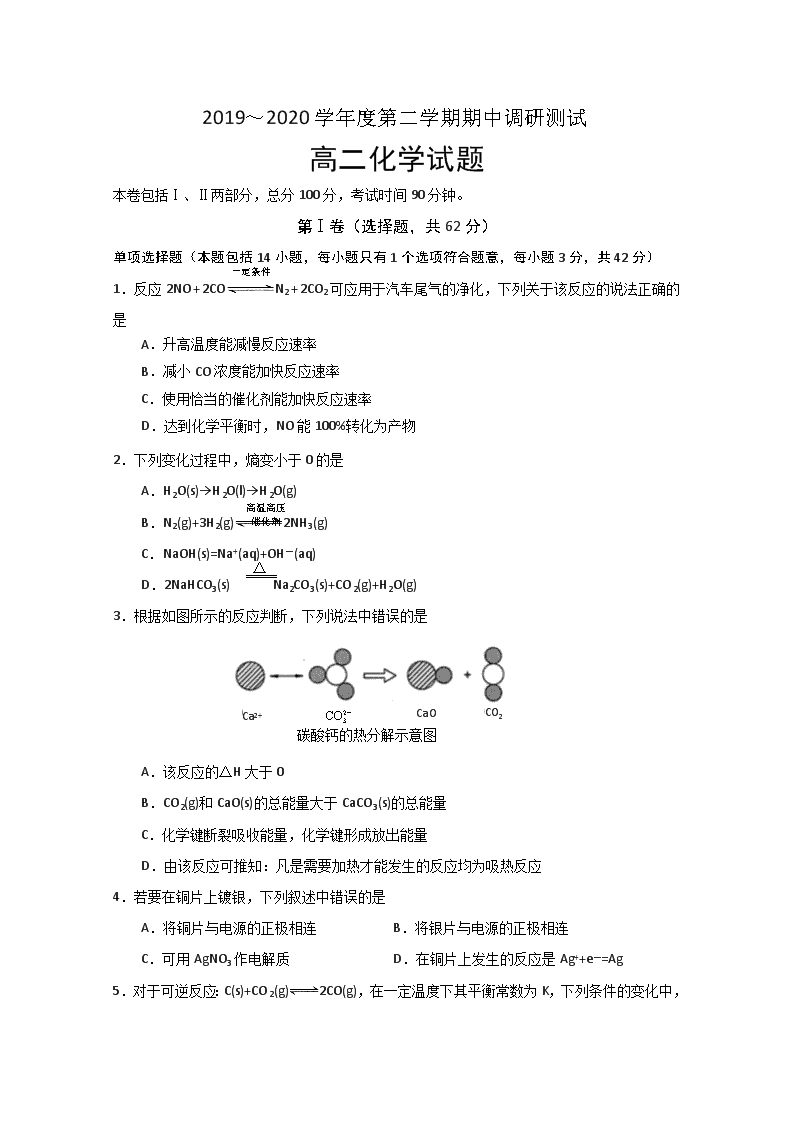
3.根据如图所示的反应判断,下列说法中错误的是
碳酸钙的热分解示意图
Ca2+
CaO
CO2
A.该反应的△H大于0
B.CO2(g)和CaO(s)的总能量大于CaCO3(s)的总能量
C.化学键断裂吸收能量,化学键形成放出能量
D.由该反应可推知:凡是需要加热才能发生的反应均为吸热反应
4.若要在铜片上镀银,下列叙述中错误的是
A.将铜片与电源的正极相连 B.将银片与电源的正极相连
C.可用AgNO3作电解质 D.在铜片上发生的反应是Ag++e—=Ag
5.对于可逆反应:C(s)+CO2(g)
2CO(g),在一定温度下其平衡常数为K,下列条件的变化中,能使K值发生变化的是
A.将碳块粉碎 B.升高体系的温度 C.增大体系的压强 D.使用合适的催化剂
6.下列事实与电化学腐蚀无关的是
A.埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀
B.为保护海轮的船壳,常在船壳上镶入锌块
C.在空气中,金属银的表面生成一层黑色物质
D.镀银的铁制品,镀层部分受损后,露出的铁表面易被腐蚀
7.已知:①2 H2(g)+ O2(g)=2 H2O(l) △H= a kJ·mol—1
②H2(g)+ 1/2O2(g)= H2O(g) △H= b kJ·mol—1
A.a=2b>0 B.a<2b C.a>2b D.a=2b<0
8.下列不能用勒夏特列原理解释的是
A.H2、I2(g)、HI组成的平衡体系加压后颜色变深
B.红棕色的NO2加压后颜色先变深后变浅
C.黄绿色的氯水光照后颜色变浅
D.合成氨工业中使用高压以提高氨的产量
9.已知反应A2(s)+2B2(g)2AB2(g)的△H<0。下列说法正确的是
A.升高温度,正反应速率增大,逆反应速率减小
B.达到平衡后,升高温度,平衡正向移动
C.达到平衡后,增大压强,B2的转化率增大
D.达到平衡后,减小压强,平衡不移动
10.人类与自然和谐发展需要节约能源和保护生态环境。下列行为中有悖于人类与社会和谐发展的是
A.研究采煤、采油新技术,提高产量以满足工业生产的快速发展
B.开发太阳能、风能、水能等新能源,减少使用化石燃料
C.减少资源损耗,增加资源的重复利用和资源的循环再生
D.将煤转化为水煤气,是将煤转化为洁净燃料的过程
11.某同学设计了一种电解法制取Fe(OH)2的实验装置(如图),分别用铁棒和碳棒作电极,通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中错误的是
煤油
A
B
NaOH溶液
A.NaOH溶液加热煮沸以除去其中溶解氧
B.A电极用碳棒,B电极用铁棒
C.B电极发生的反应是:2H2O+2e— = H2↑+ 2OH—
D.电解池中的电解液也可以用NaCl溶液
12.已知反应:
①101kPa时,C(s)+1/2O2(g)=CO(g) △H1=—110.5kJ/mol
②稀溶液中,H+(aq)+OH—(aq)=H2O(l) △H2=—57.3kJ/mol
下列结论中正确的是
A.若碳的燃烧热用△H3来表示,则△H3<△H1
B.若碳的燃烧热用△H3来表示,则△H3>△H1
C.稀硫酸与稀Ba(OH)2溶液反应生成2mol水,放出2×57.3kJ的热量
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ的热量
13.已知2SO2(g)+O2(g)2SO3(g)△H<0,且压强p1<p2,下列图象中的曲线变化错误的是
14.羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)COS(g)+H2(g)
K=0.1,反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法错误的是
A.升高温度,H2S浓度增加,表明该反应是放热反应
B.CO的平衡转化率为20%
C.反应前H2S的物质的量为7mol
D.通入CO后,正反应速率逐渐增大
不定项选择题(本题包括5小题,每小题只有1-2个选项符合题意,每小题4分,共20分,漏选得2分,错选或多选得0分)
15.在一定温度下,可逆反应A(g)+3B(g)2C(g)达到平衡的标志是
A.A、B、C的浓度不再变化
B.A、B、C的物质的量之比为1:3:2
C.单位时间内生成1mol A的同时生成3mol B
D.2υ正(B)= 3υ逆(C)
16.下列有关说法正确的是
A.MgO(s)+C(s)=CO(g)+Mg(s)在高温下能自发进行,则该反应的△H>0,△S>0
B.铅蓄电池放电时,正极和负极的质量均增大
C.钢铁发生电化学腐蚀时,负极的电极反应式为Fe—3e—=Fe3+
D.对于反应2SO2+O22SO3,使用催化剂能加快反应速率并提高SO2的平衡转化率
17.根据下列图示所得出的结论不正确的是
反应过程
时间/s
c(I)/(mol·L-1)
v/(mol·L-1·s-1)
能量/kJ
c(CO2)/(mol·L-1)
2molXY(g)
1molX2(g)、1molY2(g)
t1
t/s
t1
O
O
O
O
T1
T2
T/K
甲 乙 丙 丁
A.图甲镁条与盐酸反应的化学反应速率随时间变化的曲线,说明t1时刻溶液的温度最高
B.图乙是1mol X2(g)、1mol Y2(g)反应生成2mol XY(g)的能量变化曲线,说明反应物所含化学键的键能总和小于生成物所含化学键的键能总和
C.图丙是恒温密闭容器中发生CaCO3(s)CaO(s)+CO2(g)反应时c(CO2)随反应时间变化的曲线,说明t1时刻改变的条件可能是缩小容器的体积
多孔固体电解质
纯净H2O2溶液
X
膜
Y
膜
去离子水
负载
H2
O2
覆盖催化剂
电极
覆盖催化剂
电极
离子
离子
a极
b极
D.图丁是室温下,I2+I-I3-的平衡浓度随温度变化的曲线,说明平衡常数K(T1)>K(T2)
18.2019年11月《Science》杂志报道了王浩天教授团队发明的制取H2O2的绿色方法,原理如右图所示(已知:H2O2H++HO2-)。下列说法错误的是
A.X膜为选择性阳离子交换膜
B.催化剂可促进反应中电子的转移
C.每生成1molH2O2电极上流过4mol e-
D.b极上的电极反应为:O2+H2O+2e-=HO2-+OH-
19.一定温度下,在容积为1L的密闭容器中,存在如下关系:xH2O(g)(H2O)x(g),反应物和生成物的物质的量随时间的变化关系如图。
下列说法不正确的是
A.x=3
B.该温度下,K=0.125 L2/mol2
C.从反应开始到平衡,该反应速率为v(H2O)=3mol·L—1·min—1
D.t1时刻,保持温度和容积不变,再充入1mol H2O(g),重新达到平衡时,将减小
第Ⅱ卷(非选择题,共38分)
20.(12分)在一定条件下,反应H2(g)+ I2(g)2HI(g) △H<0在一密闭体系中达到化学平衡。在448℃时,该反应的化学平衡常数为49。
(1)请写出该反应的平衡常数的表达式 。
(2)下列说法中能说明该反应已达平衡状态的是 (用字母序号填空)
A.压强不再改变
B.速率之比 v(H2):v(I2):v(HI)=1:1:2
C.混合气体的颜色不再改变
D.混合气体的密度不再改变
(3)只改变下列条件,该化学平衡如何移动?
①向正反应方向移动; ②向逆反应方向移动; ③不移动。
升高温度 ;(用数字序号填空,下同)缩小容器的体积 ;保持体积不变,通入氢气 ;保持压强不变,通入氩气 。
21.(12分)氮及其化合物在工业生产等方面有重要的应用。工业合成氨是煤化工产业链中非常重要的一部分,发射卫星时可用肼(N2H4)作燃料……
(1)已知:17g NH3(g)在一定条件下分解生成N2(g)和H2(g),吸收46.1kJ的热量。则反应
N2(g)+3H2(g)= 2NH3(g) △H= kJ·mol—1
(2)在一定条件下,向容积为5L的恒容密闭容器中充入1mol N2、3molH2,10min后,测得容器内NH3为1mol,则用N2表示的平均反应速率为 。
(3)已知在298K时1g肼气体燃烧生成N2和水蒸气,放出16.7kJ的热量。下列热化学方程式书写正确的是 (填字母序号)
A.N2H4+O2=N2+2H2O △H=-534.4kJ·mol—1
B.N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-534.4kJ·mol—1
C.N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534.4kJ·mol—1
D.N2H4(g)+O2(g)= N2(g)+2H2O(g) △H=-16.7kJ·mol—1
(4)N2H4、O2和KOH溶液组成的燃料电池生成水和氮气。
KOH溶液
N2
N2H4
负载
电
极
A
电
极
B
O2
①负极反应式为 。
②放电时,溶液中的阴离子向 极移动(填“正”或“负”)。
③放电时,正极区溶液的碱性 (填“增强”、“减弱”或“不变”)。
22.(14分)研究NO2、NO、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知:CO可将部分氮的氧化物还原为N2。
反应Ⅰ:2CO(g)+2NO(g)N2(g)+2CO2(g) △H=—746kJ/mol
反应Ⅱ:4CO(g)+2NO2(g)N2(g)+4CO2(g) △H=—1200kJ/mol
则反应NO2(g) + CO(g)CO2(g) + NO(g)的△H= kJ/mol。
(2)温度为T℃时,在一个容积为10L的恒容密闭容器中,充入1mol CO和0.5mol SO2发生反应:2CO(g)+ SO2(g)2CO2(g)+S(g)。实验测得生成的CO2的体积分数(ψ)随着时间的变化曲线如图所示:
①达到平衡时,SO2的转化率为 。
②该温度下反应的平衡常数K= 。
③其它条件保持不变,再向上述平衡体系中充入
CO(g)、SO2(g)、CO2(g)、S(g)各0.2mol,此时
v(正) v(逆)。(填>、<或=)
(3)SCR法是工业上消除氮氧化物的常用方法,反应原理为:
NO转化率/%
4NH3(g)+4NO(g)+O2(g)4N2(g)+6H2O(g) △H<0
在催化剂作用下,NO转化率与温度的关系如图所示:
①图中A点处NO的转化率 (填“可能是”、“一定是”或“一定不是”)该温度下的平衡转化率。
温度/℃
②B点之后,NO转化率降低的原因可能是 (选填字母)。
A.平衡常数变大 B.副反应增多
C.催化剂活性降低 D.反应的活化能增大
P1
P2
P3
P4
b
a
0 45 60 t/min
(4)2SO2(g)+O2(g)2SO3(g) △H=—198 kJ/mol是制备硫酸的重要反应。在VL恒容密闭容器中充入2molSO2和1molO2,在不同条件下进行反应,反应体系总压强随时间的变化如右图所示。a和b平衡时,SO3体积分数较小的是 (填“a”或“b”)。
2019~2020学年度第二学期期中调研测试
高二化学参考答案
单项选择题(本题包括14小题,每小题只有1个选项符合题意,每小题3分,共42分)
1-5CBDAB 6-10CBADA 11-14BACD
不定项选择题(本题包括5小题,每小题只有1-2个选项符合题意,每小题4分,共20分,漏选得2分,错选或多选得0分)
15AD 16B 17AB 18C 19CD
c2(HI)
c(H2)·c(I2)
20.(每空2分,共12分)
(1)K=
(2)C
(3)② ③ ① ③
21. (每空2分,共12分)
(1)—92.2
(2)0.01 mol·L—1·min—1
(3)C
(4)①N2H4-4e-+4OH- = N2+4H2O
②负
③增强
22.(每空2分,共14分)
(1)—227
(2)①60% ②3.375 ③>
(3)①一定不是 ②BC
(4)b