- 631.00 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
体验 探究 合作 展示
长春市十一高中2017-2018学年度高二上学期期末考试
化 学 试 题
可能用到的原子量:H-1 He-4 Li-7 C-12 N-14 O-16 Mg-24 Al-27 P-31 S-32 Cl-35.5 K-39 Ca-40 Fe-56 Cu-64 Zn-65 Br-80 Ag-108 Pb-207
第Ⅰ卷 选择题(共50分)
一、选择题(本题包括20小题,1-10题每小题2分,11-20题每小题3分,共50分。每小题只有1个选项符合题意。)
1.下列物质名称书写正确的是( )
A.石碳酸 B.乙酸乙脂 C.纯碱 D.2,4,6—三溴笨酚
2.下列物质中,其主要成分不属于烃的是( )
A.汽油 B.甘油 C.煤油 D.柴油
3.下列说法正确的是( )
A.植物油氢化过程属于物理变化
B.蛋白质是仅由碳、氢、氧元素组成的物质
C.淀粉、纤维素和油脂都属于天然高分子化合物
D.煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料
4.下列化学用语使用错误的是( )
A.甲基的电子式为
B.乙醛的结构简式为CH3COH
C.按系统命名法,的名称为2,5-二甲基-3-乙基庚烷
D.邻甲基苯酚的结构简式为
5.“绿色化学”是当今社会提出的一个新概念,在“绿色化学”工艺中,理想状态是反应物中原子全部转化为欲制得的产物,即原子利用率为100%,在用CH3C≡CH合成CH2=C(CH3)COOCH3的过程中,欲使原子利用率达到最高,还需要其它的反应物有( )
A.CO和CH3OH B.CO2和H2O C.H2和CO2 D.CH3OH和H2
6.分子式为C5H10的烯烃共有(要考虑顺反异构体)( )
A.5种 B.6种 C.7种 D.8种
7. 以下实验能获得成功的是( )
A.用酸性KMnO4溶液鉴别乙烯和乙炔
B.银镜反应实验后试管内壁附有银,可用氨水清洗
C.为除去苯中少量的苯酚,可加入足量浓溴水后过滤
D.为除去乙酸乙酯中少量的乙酸,可用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏
8.分子式为C5H12O的醇催化氧化后能生成的醛有( )
A.2种 B.3种 C.4种 D.5种
9.1999年,在欧洲国家发现饲料被污染,导致畜禽类制品及乳制品不能食用,经测定饲料中含有剧毒物质二恶英,其结构为,则它的六氯代物的异构体有( )种
A.15种 B.11种 C.10种 D.5种
10.某羧酸酯的分子式为C18H26O5,1mol该酯完全水解可得到1mol羧酸和2mol乙醇,该羧酸的分子式为( )
A.C14H18O5 B.C14H16O4 C.C14H22O5 D.C14H10O5
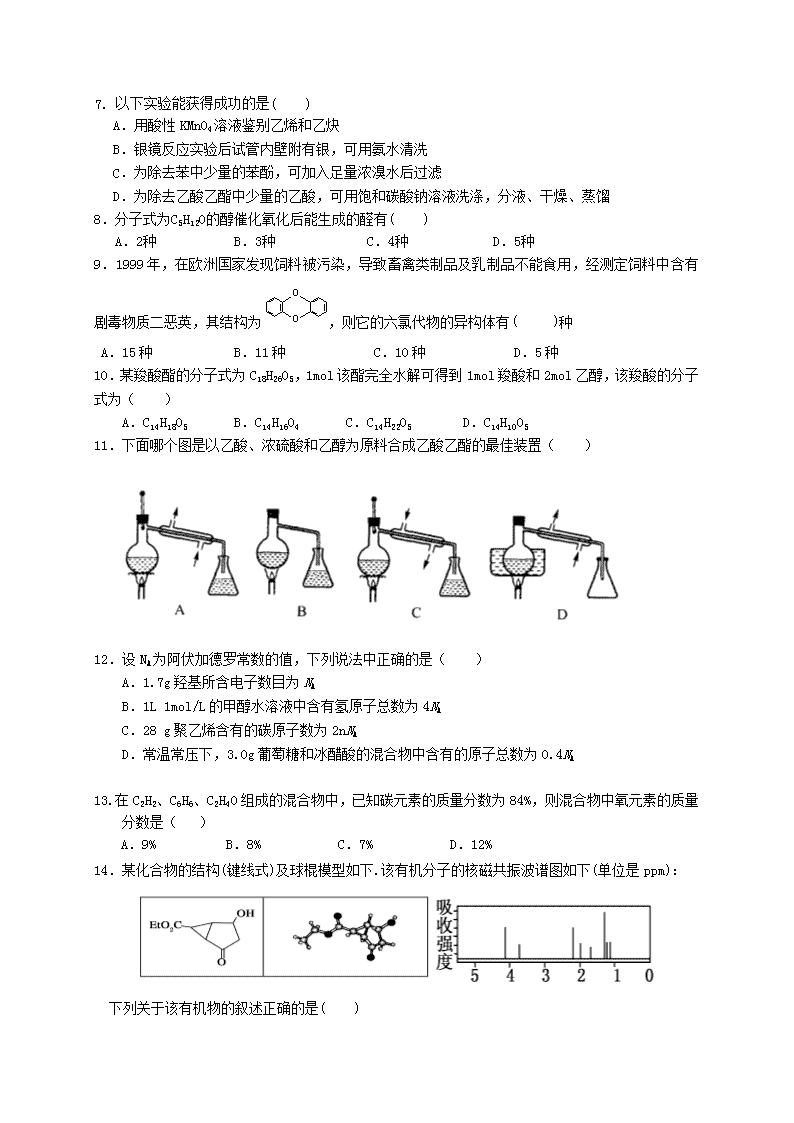
11.下面哪个图是以乙酸、浓硫酸和乙醇为原料合成乙酸乙酯的最佳装置( )
12.设NA为阿伏加德罗常数的值,下列说法中正确的是( )
A.1.7g羟基所含电子数目为NA
B.1L 1mol/L的甲醇水溶液中含有氢原子总数为4NA
C.28 g聚乙烯含有的碳原子数为2nNA
D.常温常压下,3.0g葡萄糖和冰醋酸的混合物中含有的原子总数为0.4NA
13. 在C2H2、C6H6、C2H4O组成的混合物中,已知碳元素的质量分数为84%,则混合物中氧元素的质量分数是( )
A.9% B.8% C.7% D.12%
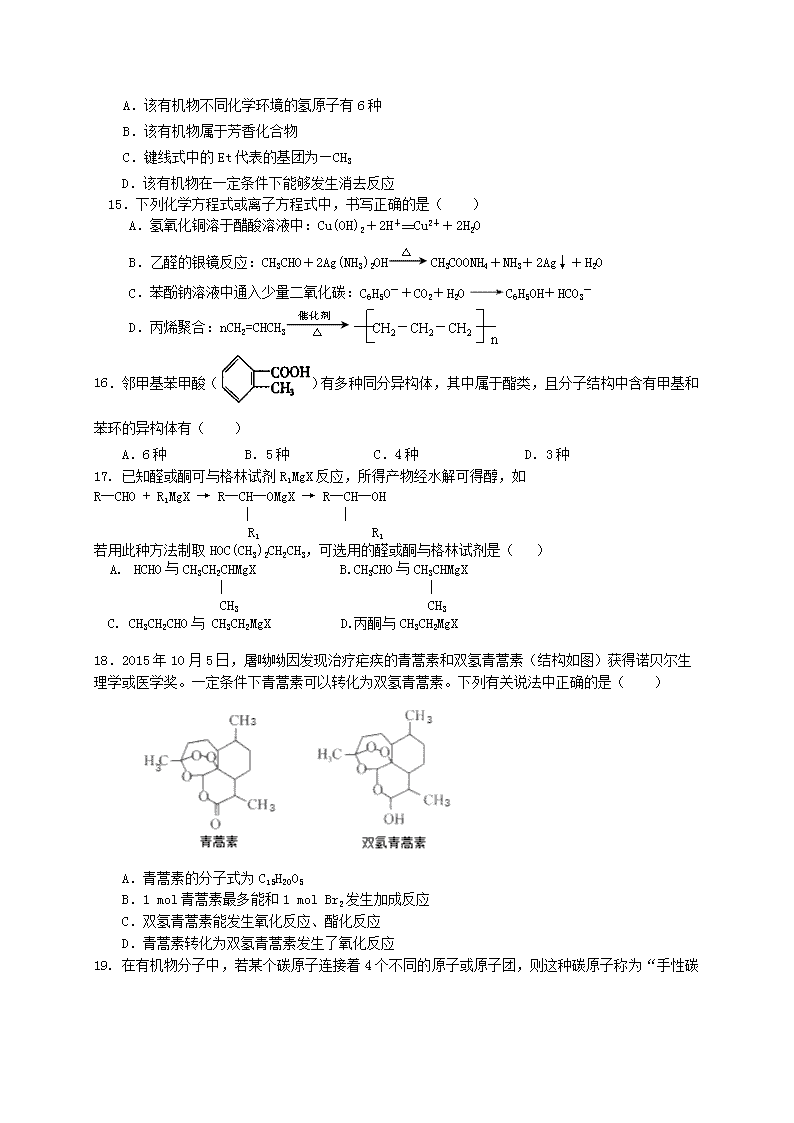
14.某化合物的结构(键线式)及球棍模型如下.该有机分子的核磁共振波谱图如下(单位是ppm):
[]
下列关于该有机物的叙述正确的是( )
A.该有机物不同化学环境的氢原子有6种
B.该有机物属于芳香化合物
C.键线式中的Et代表的基团为—CH3
D.该有机物在一定条件下能够发生消去反应
15.下列化学方程式或离子方程式中,书写正确的是( )
A.氢氧化铜溶于醋酸溶液中:Cu(OH)2+2H+==Cu2++2H2O
B.乙醛的银镜反应:CH3CHO+2Ag(NH3)2OHCH3COONH4+NH3+2Ag↓+H2O
C.苯酚钠溶液中通入少量二氧化碳:C6H5O-+CO2+H2OC6H5OH+HCO3-
CH2-CH2-CH2
n
D.丙烯聚合:nCH2=CHCH3
16.邻甲基苯甲酸()有多种同分异构体,其中属于酯类,且分子结构中含有甲基和苯环的异构体有( )
A.6种 B.5种 C.4种 D.3种
17. 已知醛或酮可与格林试剂R1MgX反应,所得产物经水解可得醇,如
R─CHO + R1MgX → R─CH─OMgX → R─CH─OH
│ │
R1 R1
若用此种方法制取HOC(CH3)2CH2CH3,可选用的醛或酮与格林试剂是( )
A. HCHO与CH3CH2CHMgX B.CH3CHO与CH3CHMgX
│ │
CH3 CH3
C. CH3CH2CHO与 CH3CH2MgX D.丙酮与CH3CH2MgX
18.2015年10月5日,屠呦呦因发现治疗疟疾的青蒿素和双氢青蒿素(结构如图)获得诺贝尔生理学或医学奖。一定条件下青蒿素可以转化为双氢青蒿素。下列有关说法中正确的是( )
A.青蒿素的分子式为C15H20O5
B.1 mol青蒿素最多能和1 mol Br2发生加成反应
C.双氢青蒿素能发生氧化反应、酯化反应
D.青蒿素转化为双氢青蒿素发生了氧化反应
19. 在有机物分子中,若某个碳原子连接着4个不同的原子或原子团,则这种碳原子称为“
手性碳原子”。凡有一个手性碳原子的物质一定具有光学活性,物质有光学活性,发生下列反应后生成的产物有光学活性的是( )
A.与NaOH水溶液共热 B.与银氨溶液作用
C.与乙酸发生酯化反应 D.在催化剂存在下与H2作用
20.某有机化合物的结构简式如下,关于它的性质叙述中不正确的是( )
A.它有酸性,能与纯碱溶液反应
B.它在一定条件下可以水解只生成一种物质
C.1 mol该有机物最多能和7 mol NaOH反应
D.该有机物既能发生取代反应又能发生加成反应
第Ⅱ卷 非选择题(共50分)
二、填空题:(本题包括4个小题,共50分)
21.(16分)推断题:
I.(10分)E的产量是衡量一个国家石油化工水平发展的标志,F为高分子化合物,能进行如图所示的反应。
(1)请写出E的电子式 。
(2)下列反应的化学方程式:(要求有机物必须写结构简式)
反应②: 反应类型 。
反应③: 反应类型 。
反应④: 反应类型 。
反应⑤: 反应类型 。
(3)比较反应①剧烈程度 (填>、= 或<)钠和水反应的剧烈程度。
Ⅱ.(6分)
2006年5月,齐齐哈尔第二制药厂生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭。“亮菌甲素”的结构简式为:
它配以辅料丙二醇溶成针剂用于临床。假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性。请回答下列问题:
(1)下列有关“亮菌甲素”的叙述正确的是________(填字母)。
A.“亮菌甲素”能与H2发生加成反应 B.不能使酸性KMnO4溶液褪色
C.“亮菌甲素” 的分子式是C12H10O5 D.“亮菌甲素”分子中含氧官能团只有2种
(2)丙二醇的分子式是C3H8O2,已知两个羟基连在同一个碳原子上的物质不存在。写出其所有属于醇类的同分异构体的结构简式_______________________________。
(3)依据核磁共振氢谱分析,二甘醇分子中有3个吸收峰,其峰面积之比为2∶2∶1。又知二甘醇中含碳、氧元素的质量分数相同,且氢元素的质量分数为9.4%,1 mol二甘醇与足量金属钠反应生成1 mol H2。写出二甘醇的结构简式 。
22.(10分)实验题:
阿司匹林(乙酰水杨酸,)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
制备基本操作流程如下:
主要试剂和产品的物理常数如下表所示:
名称
相对分子质量
熔点或沸点(℃)
水
水杨酸
138
158(熔点)
微溶
醋酸酐
102
139.4(沸点)
易水解
乙酰水杨酸
180
135(熔点)
微溶[]
请根据以上信息回答下列问题:
(1)制备阿司匹林时,要使用干燥的仪器的原因是 。
(2)合成阿司匹林时,最合适的加热方法是 。
(3)提纯粗产品流程如下,加热回流装置如图:
①沸石的作用是 ;
②冷凝水的流出方向是 (填“b”或“c”);
③使用温度计的目的是 。
(4)在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为 (用百分数表示,小数点后一位)。
23.(10分)合成题:
肉桂酸异戊酯G()是一种香料,一种合成路线如下:
已知以下信息:
①;
②C为甲醛的同系物,相同条件下其蒸气与氢气的密度比为22。
回答下列问题:
(1)A的化学名称为 。
(2)B和C反应生成D的化学方程式为 。
(3)F中含有官能团的名称为 。
(4)E和F反应生成G的化学方程式为 ,反应类型为 。
(5)F的同分异构体中不能与金属钠反应生成氢气的共有 种(不考虑立体异构),其中核磁共振氢谱只有两组峰,且峰面积比为3:1的为 (写结构简式)。
24.(14分)推断题:
有机物G(分子式为C13H18O2)是一种香料,如图是该香料的一种合成路线。
已知:
①E能发生银镜反应,在一定条件下,1 mol E能与2 mol H2反应生成F;
②R—CH===CH2R—CH2CH2OH;
③有机物D的摩尔质量为88 g·mol-1,其核磁共振氢谱有3组峰;
④有机物F是苯甲醇的同系物,苯环上只有一个无支链的侧链。
回答下列问题:
(1)用系统命名法命名有机物B________________;
(2)E的结构简式为__________________________;
(3)C与新制Cu(OH)2反应的化学方程式为____________________________;
(4)已知有机物甲符合下列条件:①为芳香族化合物;②与F互为同分异构体;③能被催化氧化成醛。符合上述条件的有机物甲有________种,写出一种满足苯环上有3个侧链,且核磁共振氢谱有5组峰,峰面积比为6∶2∶2∶1∶1的有机物的结构简式____________________;
(5)以丙烯等为原料合成D的路线如下:
X的结构简式为_______,步骤Ⅱ的反应条件为___________,步骤Ⅳ的反应类型为______。
长春市十一高中2017-2018学年度高二上学期期末考试
化学试题参考答案及评分标准(总分:100分)
一、选择题(本题包括20小题,共50分。每小题只有1个选项符合题意。)
1
2[]
3
4
5
6
7
8
9
10
C
B
D
B
A
B
D
C
C
A
11
12
13
14
15
16
17
18
19
20
A
D
B
D
C
B
D
C
B
C
二、填空题:(本题包括4个小题,共50分)
21.(16分)
I. (10分,每空各1分)(1)
(3)<
Ⅱ.(6分)(3)AC (2分) (4)(2分)
(5)HOCH2CH2OCH2CH2OH(2分)
22.(10分)
(1)醋酸酐和水易发生反应(2分) (2)水浴加热(2分)
(3)①防止暴沸(1分)
②c(1分)
③便于调控加热温度,防止乙酰水杨酸受热分解(2分) (4)84.3%(2分)
23.(10分)
(1)苯甲醇(1分)
(2)(2分,不写水不给分。)
(3)羟基(1分)
(4)(2分,不写水不给分。)
取代反应(或酯化反应)(1分)
(5)6 (2分) (1分)
24.(14分)
(1)2-甲基-1-丙醇(2分) (2)C6H5CH=CHCHO(2分)
(3)
(CH3)2CHCHO+2Cu(OH)2+NaOH(CH3)2CHCOONa+Cu2O↓+3H2O(2分,不写NaOH不给分。)
(4)13种(2分)(2分,只写其中一种即可)
(5)CH3CHBrCH3(2分) NaOH的水溶液,加热(1分) 消去反应(1分)