- 1017.00 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第
21
讲 物质的检验与定量分析
-
2
-
重点梳理
精选例题
考点一
物质的检验
1
.
物质的检验方法
物质的检验通常有鉴定、鉴别和推断三类
,
它们的共同点是
:
依据物质的特殊性质和特征反应
,
选择适当的试剂和方法
,
准确观察反应现象
,
如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等
,
通过现象进行判断、推理。
-
3
-
重点梳理
精选例题
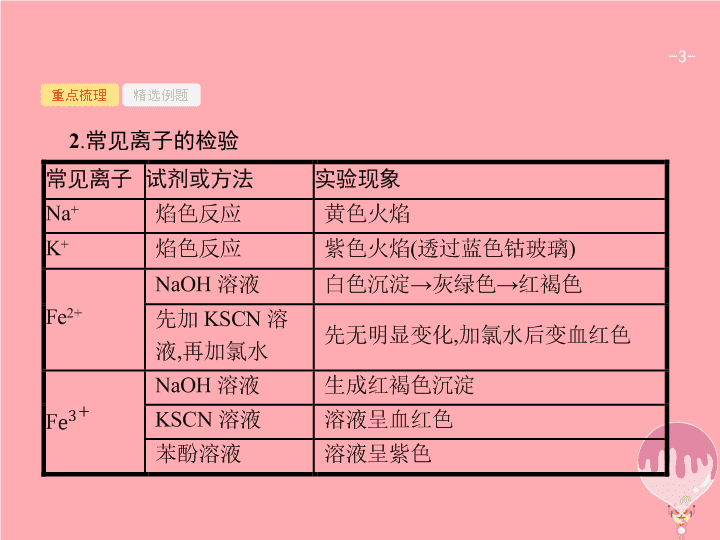
2
.
常见离子的检验
-
4
-
重点梳理
精选例题
-
5
-
重点梳理
精选例题
-
6
-
重点梳理
精选例题
3
.
常见气体的检验
-
7
-
重点梳理
精选例题
-
8
-
重点梳理
精选例题
4
.
牙膏和火柴头成分检验
-
9
-
重点梳理
精选例题
5
.
多角度鉴别
NaNO
2
和
NaCl
溶液
-
10
-
重点梳理
精选例题
(2017·11·
浙江选考
)
下列方法
(
必要时可加热
)
不合理的是
(
)
A.
用澄清石灰水鉴别
CO
和
CO
2
B.
用水鉴别苯和四氯化碳
C.
用氢氧化钡溶液鉴别
NH
4
Cl
、
(NH
4
)
2
SO
4
和
K
2
SO
4
D.
用淀粉碘化钾试纸鉴别碘水和溴水
答案
解析
解析
关闭
A.CO
不能使澄清石灰水变浑浊
,CO
2
可以使澄清石灰水变浑浊
;B.
苯的密度比水小
,
在上层
,
四氯化碳的密度比水大
,
在下层
;C.
氢氧化钡与
NH
4
Cl
混合产生有刺激性气味的气体
,
与
(NH
4
)
2
SO
4
反应产生白色沉淀硫酸钡
,
同时产生有刺激性气味的气体
,
与
K
2
SO
4
反应只产生白色沉淀
,
故可鉴别
;D.
碘水中有碘单质
,
溴水可以氧化淀粉碘化钾试纸中的碘离子变为碘单质
,
都可以使淀粉碘化钾试纸变蓝
,
故无法鉴别
,
选
D
。
答案
解析
关闭
D
-
11
-
重点梳理
精选例题
跟踪训练
1
.
某白色粉末由两种物质组成
,
为鉴别其成分进行如下实验
:
①
取少量样品加入足量水仍有部分固体未溶解
;
再加入足量稀盐酸
,
有气泡产生
,
固体全部溶解
;
②
取少量样品加入足量稀硫酸有气泡产生
,
振荡后仍有固体存在。
该白色粉末可能为
(
)
A.NaHCO
3
、
Al(OH)
3
B.AgCl
、
NaHCO
3
C.Na
2
SO
3
、
BaCO
3
D.Na
2
CO
3
、
CuSO
4
答案
解析
解析
关闭
NaHCO
3
、
Al(OH)
3
中加入足量稀硫酸有气泡产生
,
无固体存在
,A
项错误。
AgCl
不溶于盐酸
,
①中固体不能全部溶解
,B
项错误。
BaCO
3
不溶于水
,
加入稀盐酸
,
固体全部溶解
;
再将样品加入足量稀硫酸
,
稀硫酸和
BaCO
3
反应生成
BaSO
4
沉淀
,C
项正确。
Na
2
CO
3
、
CuSO
4
中加入足量稀硫酸
,
振荡后无固体存在
,D
项错误。
答案
解析
关闭
C
-
12
-
重点梳理
精选例题
2
.
下列设计的实验方案能达到实验目的的是
(
)
A.
制备
Al(OH)
3
悬浊液
:
向
1 mol·L
-1
AlCl
3
溶液中加过量的
6 mol·L
-1
NaOH
溶液
B.
提纯含有少量乙酸的乙酸乙酯
:
向含有少量乙酸的乙酸乙酯中加入适量饱和
NaOH
溶液
,
振荡后静置分液
,
并除去有机相的水
C.
检验溶液中是否含有
Fe
2+
:
取少量待检验溶液
,
向其中加入少量新制氯水
,
再滴加
KSCN
溶液
,
观察实验现象
D.
探究催化剂对
H
2
O
2
分解速率的影响
:
在相同条件下
,
向一支试管中加入
2 mL 5% H
2
O
2
溶液和
1 mL H
2
O,
向另一支试管中加入
2 mL 5% H
2
O
2
溶液和
1 mL FeCl
3
溶液
,
观察并比较实验现象
答案
解析
解析
关闭
A
项
,AlCl
3
与过量
NaOH
溶液反应生成
NaAlO
2
,
错误
;B
项
,
乙酸乙酯会与
NaOH
溶液反应
,
错误
;C
项
,
没有排除
Fe
3+
的干扰
,
正确的检验方法是
:
取少量的待检验溶液
,
滴加
KSCN
溶液
,
若不变红色
,
再滴加少量的新制氯水
,
若变红色
,
则说明原溶液中存在
Fe
2+
,
错误
;D
项
,
两试管中
H
2
O
2
浓度相同
,
后者加入
FeCl
3
溶液
,
若后者放出
O
2
速率大
,
说明
FeCl
3
对
H
2
O
2
的分解有催化作用
,
正确。
答案
解析
关闭
D
-
13
-
重点梳理
精选例题
规律小结
检验类型与检验方法
-
14
-
重点梳理
精选例题
考点二
物质组成的定量分析
1
.
食醋总酸含量测定与容量分析法
(1)
把食醋中的总酸都看成一元弱酸
(
乙酸
)
进行测定。
(2)
容量分析法
:
用一种已知浓度溶液
(
准确
)
测定未知浓度溶液的方法
,
其核心是体积测定精确和终点判断准确。
(3)
基本实验操作
:
取样
→
稀释
→
滴定
→
数据处理。
2
.
镀锌铁皮锌镀层厚度的测定
(1)
镀层厚度测定最常用的方法是用游标卡尺或螺旋测微器。如果镀层很薄
,
可以用化学方法测定
,
一般通过溶解镀层前后质量差
,
计算镀层金属的质量
;
求算镀锌铁皮的表面积
;
用镀层金属质量除以镀件的表面积
,
即可得到镀层的厚度。
(2)
锌镀层厚度测定实验的关键是准确判断锌完全溶解并及时取出、干燥和称量。
-
15
-
重点梳理
精选例题
3.
物质纯度测定方法
(
以
NaCl
中混有
Na
2
CO
3
为例
)
(1)
气体体积法
:
将其中一种物质通过反应产生气体并测定其体积
,
根据体积计算该成分的物质的量或质量
,
从而得到物质的纯度。例如
,NaCl(Na
2
CO
3
),
可以加盐酸
,
收集测定
CO
2
在标准状况下的体积
,
然后计算
Na
2
CO
3
的质量
,
进而计算
NaCl
的纯度。
(2)
气体质量法
:
将其中一种物质通过反应产生气体
,
测定气体质量
,
根据气体质量计算该成分的物质的量或质量
,
从而得到物质的纯度。例如
,NaCl(Na
2
CO
3
),
可以加盐酸
,
利用碱石灰吸收挥发出来
CO
2
,
通过测碱石灰吸收气体前后的质量差确定
CO
2
的质量
,
从而计算
Na
2
CO
3
质量
,
进而计算
NaCl
纯度。
-
16
-
重点梳理
精选例题
(3)
沉淀质量法
:
将一种物质转化为沉淀
,
通过测沉淀质量计算某一成分质量
,
从而计算其纯度。例如
,NaCl(Na
2
CO
3
),
溶解后加入足量
BaCl
2
溶液
,
过滤
,
洗涤、干燥
,
称量
BaCO
3
质量
,
计算
Na
2
CO
3
质量
,
进而计算
NaCl
纯度。
(4)
晶体质量法
:
将混合物转化为一种物质
,
称量晶体质量
,
然后利用差量法计算某一成分质量。例如
,NaCl(Na
2
CO
3
),
加入足量稀盐酸
,
蒸发结晶
,
称量实验前后固体质量
,
进而计算
NaCl
纯度。
(5)
容量分析法
:
利用滴定原理
,
根据标准液用量计算某一成分质量
,
从而计算纯度。例如
,NaCl(Na
2
CO
3
),
取一定量样品配制成溶液
,
用一定物质的量浓度盐酸滴定至不再产生气泡为止
,
根据盐酸用量计算碳酸钠质量
,
进而计算
NaCl
纯度。
-
17
-
重点梳理
精选例题
下列关于食醋中总酸含量的测定实验
,
说法错误的是
(
)
A.
实验室若选用陈醋
,
需用活性炭脱色
B.
食醋量取后要立即将试剂瓶瓶盖盖好
C.
稀释食醋的蒸馏水不需要煮沸
D.
食醋中总酸含量的测定实验主要利用中和滴定法
答案
解析
解析
关闭
A
项是为了防止陈醋的颜色影响滴定终点的判断
,B
项立即盖紧瓶盖是防止食醋挥发
,
蒸馏水中含有二氧化碳
,
煮沸时可除去二氧化碳。
答案
解析
关闭
C
-
18
-
重点梳理
精选例题
跟踪训练
硫酸亚铁铵又称摩尔盐
,
是浅绿色晶体。它在空气中比一般亚铁盐稳定
,
是常用的
Fe
2+
试剂。某实验小组利用工业废铁屑制取摩尔盐
,
并测定其组成
,
他们进行了摩尔盐的制取
,
请回答下列问题。
-
19
-
重点梳理
精选例题
(1)
废铁屑中含氧化铁
,
无需在制备前除去
,
理由是
、
(
用离子方程式回答
),
实验前需将废铁屑放入碳酸钠溶液中煮沸
,
倾倒出液体
,
用水洗净铁屑。从以下仪器中选择组装
,
完成该操作必需的仪器有
(
填编号
)
。
①
铁架台
②
玻璃棒
③
广口瓶
④
石棉网
⑤
烧杯
⑥
漏斗
⑦
酒精灯
(2)
步骤
2
中加热方式
(
填
“
直接加热
”
﹑
“
水浴加热
”
或
“
沙浴
”);
必须在铁屑少量剩余时
,
进行热过滤
,
其原因是
。
-
20
-
重点梳理
精选例题
①②④⑤⑦
(2)
水浴加热 防止
Fe
2+
被氧化
,
同时热过滤可防止硫酸亚铁以晶体形式析出
【解析】
(1)
废铁屑中的氧化铁与硫酸反应生成
Fe
3+
,Fe
3+
与
Fe
反应转化为
Fe
2+
,
因此无需在制备前除去
Fe
2
O
3
,
反应的离子方程
放入碳酸钠溶液中煮沸
,
倾倒
,
水洗
,
需要用到铁架台、玻璃棒、石棉网、烧杯、酒精灯。
(2)
在
70~75
℃
加热
,
用水浴加热。在铁屑少量剩余时
,
进行热过滤
,
其原因是防止
Fe
2+
被氧化
,
同时热过滤可防止硫酸亚铁以晶体形式析出。
-
21
-
重点梳理
精选例题
规律小结
定量型实验题的解题模板